檀香(Santalum album Linn.)隶属于檀香科檀属,是一种半寄生小乔木,其用途广泛,经济价极高,是世界上最昂贵的木材之一。檀香集芳香、用、材用于一身,被誉为“绿色金子”、“香料之”[1]。目前,为满足我国国内的需求,并且经过年栽培推广,在广东、海南、四川、云南、广西、建及浙江等地引种栽培了一定规模的檀香[2, 3, 4, 5, 6]。南省在开展了“绿化宝岛”大行动后,檀香的人工林种植面积明显增加[7]。然而2013 年在对海南檀香病虫害调查结果中发现,檀香的主要病害有疽病、苗木立枯病、煤污病、根腐病、白粉病等,中炭疽病是危害檀香幼树生长的主要病害,并且近年趋重发生。发病初期叶片会出现紫色或紫褐病斑,严重时导致檀香叶片大量提前落叶,对檀的健康生长造成严重影响,因此对檀香病害的研与防治具有重要意义。
目前主要通过化学杀菌剂控制该病害,这种方容易导致病原菌抗药性,甚至会污染环境。生物剂具有无污染,无公害,无残留,不易形成抗性特点[8],也是当今国内外病害防控研究的热点。用拮抗微生物防治檀香炭疽病害在国内外尚未有道,本研究拟从檀香优良单株根际土壤中分离筛出有效控制檀香炭疽病的生防细菌,以期为檀香疽病的生物防治提供参考。
1 材料与方法 1.1 材料 1.1.1 供试病原菌檀香炭疽病的病原菌(Colletotrichumructicola),编号SA-2,由本实验室分离鉴定保存。供试5 种病原菌,即降香黄檀炭疽病、油叶枯病菌、油茶软腐病菌、油茶根腐病和油茶炭病,均由经济林培育与保护省部共建教育部重点验室提供。
1.1.2 土样来源海南省国营澄迈林场,采集不同植区中檀香优良单株的根际土壤,编号封存于封袋中,带回实验室进行细菌的分离。
1.1.3 供试培养基PDA 培养基[9](用于植物病原菌培养及菌株拮抗效果测定):马铃薯 200.0 g,萄糖 20.0 g,琼脂 15.0-20.0 g,蒸馏水1 000 mL ;A 培养基[10](用于拮抗细菌分离纯化培养):蛋白 10.0 g,牛肉浸膏 5.0 g,琼脂15.0-20.0 g,蒸馏 1 000 mL,pH7.2-7.4 ;NB 培养基[11](用于拮抗菌液体培养):蛋白胨 10.0 g,牛肉浸膏 5.0 g,蒸水 1 000 mL,pH7.2-7.4。
1.2 方法 1.2.1 根际细菌的分离称取檀香优良单株的新根际土样10.0 g 放入装有90 mL 无菌水并带有玻珠的三角瓶中,摇床振荡20 min,制成土壤悬液10-1)。从中取1 mL 土壤悬液注入盛有9 mL 无菌水试管中,吹吸3 次,振荡混匀(10-2)。依此类推成10-3、10-4、10-5、10-6 和10-7 各种稀释度的土溶液备用。
分别吸取上述不同稀释度的土壤溶液 0.1 mL 至备好的NA 平板上,均匀涂布。细菌一般培养温为35-37℃,故选择35℃下进行恒温培养,48 h记录菌量,然后根据菌落形态、颜色、透明度、边缘、干湿等特征,挑取性状不同的菌落,在NA板上进行划线纯化、编号、培养,再4℃保存备[12, 13],共分离3 个批次的生防细菌。分离出的细于28℃和35℃下均可正常生长。
1.2.2 拮抗菌的筛选采用平板对峙法[14]初筛,PDA 平板中央接直径6 mm 的供试病原菌菌块,距菌块3 cm 处对角线接种土壤中已分离纯化的细菌株,以只接种病原菌菌块为对照。每组设置3重复,在28℃恒温培养,5 d 后观测抑菌圈大小,选出对檀香炭疽病菌有抑制作用的拮抗细菌。
采用发酵液法[15]复筛,将6 种初筛选出的拮菌株培养2 d 后接种到50 mL NA 培养液的三角(250 mL)中,30℃、160 r/min 摇床振荡培养48。发酵液经0.22 μm 细菌过滤器过滤得到发酵滤液,滤液与PDA 培养基按 1∶19 混匀后倒平板,中央檀香炭疽病原菌,以蒸馏水代替滤液为对照。每设置3 个重复,28℃恒温培养,5 d 后观测抑菌圈小。
1.2.3 拮抗细菌抗菌谱的测定 采用平板对峙法,离病原菌菌块中心 3 cm 处对角线接种4 点待测抗细菌,以中央接病原菌作对照;28℃恒温培养 d。每处理 3 次重复。测量病原菌菌落直径和抑菌宽度,计算拮抗菌对各供试病菌的抑菌率。
抑制率(%)=[(对照组菌落直径-处理组菌落径)/(对照组菌落直径-原菌饼直径)]×100%
1.2.4 拮抗菌株的鉴定 1.2.4.1 形态特征拮抗细菌经无菌水稀释适当浓后,接种于NA 培养基上,于35℃恒温培养2-3 d,出单菌落后,观察记录菌落形态[10]。同时,对菌进行革兰氏染色,显微镜下观察其菌体形态以及小。
1.2.4.2 生理生化特性测定参照《常见细菌系统定手册》[16]和《伯杰细菌鉴定手册》[17]的方法,行拮抗细菌常规生理生化反应测定。
1.2.4.3 分子生物学鉴定将培养3 d 的拮抗菌株种到40 mL NB 培养液的三角瓶(100 mL) 中,35 ℃、160 r/min,恒温振荡培养48 h 后制成菌悬浮液,离心收集菌体,采用常规CTAB 法[18]DNA 提取试剂盒(北京天根生化科技有限公)提取病原菌基因组DNA。采用细菌通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3') 和1492R5'-GGTTACCTTGTTACGACTT-3') 对提取的DNA行PCR 扩增。
将扩增后的DNA 产物送至上海生工生物有限公进行纯化测序。并且把测序结果与GenBank 中的列进行blast 比对。以16S rDNA 相似序列,利用EGA5.0 软件的Neighbor-Joining 法构建系统发育树。
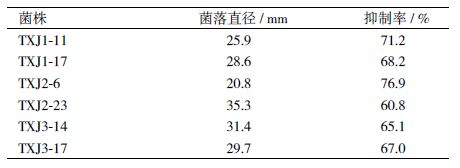
2 结果 2.1 拮抗细菌的分离与筛选从海南省国营澄迈林场檀香优良单株的根际土中,3 个批次共分离得到71 株细菌。以檀香炭疽病原菌为指示菌,筛选出抑菌带宽度D ≥ 6 mm 的抗菌6 株,分别为TXJ1-11、TXJ1-17、TXJ2-6、XJ2-23、TXJ3-14 和TXJ3-17(表 1)。筛选出的6拮抗细菌经发酵液法复筛,得到TXJ2-6 菌株的菌效果最好,抑菌率为76.9%(表 2)。 因此,将XJ2-6 作为檀香炭疽病的拮抗菌株进行后续实验。
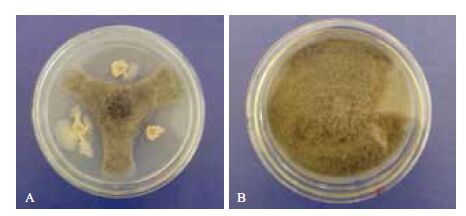
在PDA 平板对峙法中,接种TXJ2-6 菌株后,抗菌对檀香炭疽病菌SA-2 具有明显的抑菌带,病菌菌丝生长受到较明显抑制,并且在病原菌菌落边缘与抑菌带接触部位的菌丝发生溶解,整个菌的生长受到明显抑制(图 1)。
|
| 图 1 菌株TXJ2-6 对檀香炭疽病病原菌的拮抗作用 A :菌株TXJ2-6 ;B :对照 |
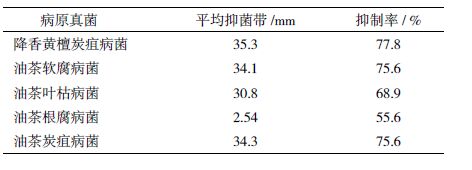
由表 3 可知,拮抗细菌TXJ2-6 对5 种病原真菌,即降香黄檀炭疽病菌、油茶软腐病菌、油茶叶病菌、油茶根腐病菌及油茶炭疽病菌均有抑菌作,其中对降香黄檀炭疽病菌、油茶软腐病菌和茶炭疽病菌的抑菌率分别达到77.8%、75.6% 和5.6%。因此,可初步说明TXJ2-6 菌株对植物病原菌有一定的广谱性,具有生防应用前景。
图 2 显示,菌株TXJ2-6 在牛肉膏白胨培养基上呈乳白色菌落,圆形或近圆形,表湿润不透明,边缘波状,有褶皱。菌体呈杆状,孢中生,孢囊不膨大,革兰氏染色呈阳性(图 2)

|
| 图 2 TXJ2-6 的形态特征 |
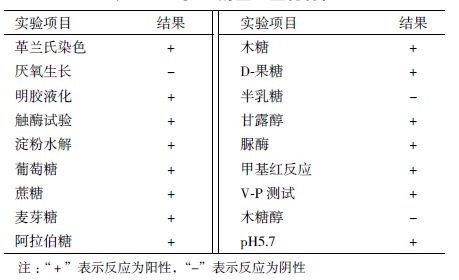
通过对菌株TXJ2-6 的部分理生化特性实验(表 4)结果并结合其形态特征,照《常见细菌系统鉴定手册》和《伯杰细菌鉴定册》,初步鉴定TXJ2-6 菌株为芽孢杆菌属。
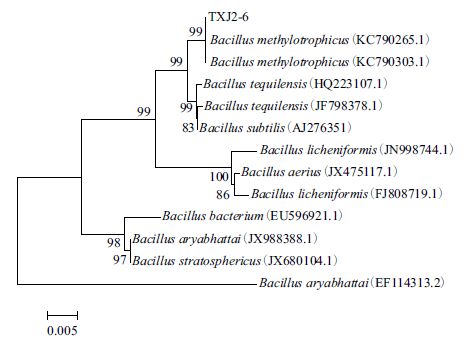
以TXJ2-6 基因组DNA 为板,用通用引物27F 和1492R 对16S rDNA 序列行PCR 扩增,将获得的扩增产物进行测序,得大小为1 411 bp 的核苷酸序列。将该序列通过LAST 程序与 GenBank 中序列进行对比分析,结果示菌株TXJ2-6 与其比对的芽孢杆菌属同源,相度高达100%,采用MEGA5.0 软件以GenBank 中6S rDNA 相似序列及其模式菌株16S rDNA 序列构系统进化树。结果(图 3)表明,菌株TXJ2-6 与株SK13(GenBank 登录号KC790303.1) 和菌株Y1(GenBank 登录号KC790265.1 )的亲缘关系最,且此两株菌均为甲基营养型芽孢杆菌菌综合菌的形态学特征、生理生化特征及分子生物学鉴,拮抗菌株可初步鉴定为甲基营养型芽孢杆菌Bacillus methylotrophicus)。
|
| 图 3 菌株TXJ2-6 的系统发育树 |
对海南省檀香的病害普查结果发现,炭疽病是檀香苗木及其幼树生长的主要病害,目前此病害的间防治方法主要是化学防治,即在病害发生的早,交替使用多菌灵、甲基托布津、波尔多液等药剂。是,化学药剂的预防作用很好,治疗作用效果较。另外,芽孢杆菌具有较强的抗菌防病功能,已功作为生物农药用于植物病害的生物防治[18, 19]。前关于檀香炭疽病及其防治尚无相关报道和系统究。本实验首次将甲基营养型芽孢杆菌用于该病生物防治,同时,该菌株拮抗作用具有一定的广性,对油茶软腐病、油茶叶枯病、油茶根腐病、茶炭疽病和热带树种降香黄檀炭疽病均具较强拮效果,尤其对降香黄檀炭疽病的抑菌效果显著,菌率达77.8%。由于降香黄檀常作为檀香长期寄二者通常混交,因此选择对二者都具有良好效果拮抗菌株更有意义。本研究所分离筛选到的甲基养型芽孢杆菌是在室内条件下对病原菌进行的拮实验,但在田间的防效如何尚不得而知,另外对香苗木生长有无促进作用,如何开发为生物农药其使用方法等还需进一步研究。
4 结论本实验从海南省国营澄迈林场土壤中分离纯得到71 株细菌,筛选出对檀香炭疽病拮抗效果好的一株,并且通过拮抗菌谱实验初步确定其广谱性,将该菌株命名为TXJ2-6。综合形态学察、生理生化特性及16S rDNA 序列分析,将XJ2-6 菌株鉴定为甲基营养型芽孢杆菌(Bacillusethylotrophicus)。
| [1] | 周亮, 黄自云, 黄建平. 热带芳香植物——檀香[J]. 园艺,014(4): 73. |
| [2] | 李应兰. 檀香引种研究[M]. 北京: 科学出版社, 2003 : 146-48. |
| [3] | 马国华, 何跃敏, 张静峰, 等. 檀香幼苗半寄生性初步研究[J].带亚热带植物学报, 2005, 13(3): 233-288. |
| [4] | 杨晓玲. 珍惜而又娇贵的檀香树[J]. 云南林业, 2005, 26(1): 1. |
| [5] | 陈荣, 张新华, 马国华. 檀香与不同豆科植物寄生关系的研[J]. 热带亚热带植物学报, 2014, 22(1): 53-60. |
| [6] | 邓乐君, 周伟平, 刘少峰, 等. 湛江南药场引种檀香 rDNA ITS列系统发育分析[J]. 广东药学院学报, 2014, 30(3): 314-18. |
| [7] | 董文统, 刘君昂, 周国英, 等. 海南省乡土树种病虫害发生现[J]. 中南林业科技大学学报, 2014, 34(6): 56-60. |
| [8] | 李凯, 袁鹤. 植物病害生物防治概述[J]. 山西农业科学,012, 40(7): 807-810. |
| [9] | 张瑾, 张树武, 徐秉良, 等. 长枝木霉抑菌普测定及抑菌作用理研究[J]. 中国生态农业学报, 2014, 22(6): 661-667. |
| [10] | 方中达. 植病研究方法[M]. 北京: 中国农业出版社, 1998. |
| [11] | 杨华, 纪明山, 李广旭, 等. 不同发酵条件对苹果轮纹病拮抗菌生长的影响[J]. 果树学报, 2007, 24(6): 799-802. |
| [12] | 耿海峰. 冬枣采后病害拮抗菌的筛选和鉴定[J]. 食品科学,010, 31(9): 150-155. |
| [13] | 张广志, 杨合同, 李纪顺, 等. 多功能芽孢杆菌的分离, 筛选活性测定[J]. 江苏农业大学, 2009(1): 298-299. |
| [14] | 朱宏建, 欧阳小燕, 周倩, 等. 一株辣椒尖孢炭疽病菌拮抗株的分离鉴定与发酵条件优化[J]. 植物病理学报, 2012,442): 418-424. |
| [15] | 路宗研, 周国英, 陈玉华, 等. 杉木炭疽病拮抗菌 HY32 的筛及其应用[J]. 生物技术通报, 2013(3): 181-185. |
| [16] | 东秀珠, 蔡妙英. 常用细菌系统鉴定手册[M]. 北京: 科学版社, 2001 : 399-417. |
| [17] | 布坎南 RE, 吉本斯 NE. 伯杰细菌鉴定手册[M]. 北京: 科学版社, 1984. |
| [18] | Hillis DM, Moritz CM, Mable BK. Molecular Systematics[M].asSachusetts : Sinauer Associates, 1990 : 411-501. |
| [19] | Oita S, Horita M, Yanagi SO. Purification properties of a newhitinbinging antifungal CB21 from Bacillus licheniformis[J].ioscience, Biotechnology & Biochemistry, 1996, 60(3): 481-83. |