2. 长春市南关区中医院,长春 130118;
3. 吉林农业大学中药材学院,长春 130118
2. Traditional Medicine Hospital of Nanguan District,Changchun 130118;
3. College of Chinese Medicines,Jilin Agricultural University,Changchun 130118
百合科玉竹[Polygonatum odoratum(Mill.)Druce]为多年生草本植物,可药食两用,其功效已被世人所熟知,属于我国大宗地道性药材之一[1]。近些年来,伴随着玉竹相关研究的不断深入,玉竹药材的市场需求量在不断增加,大面积开采野生玉竹已无法满足市场的供需平衡,同时野生玉竹资源的不断减少,破坏了物种的多样性,引发了人们的广泛关注。为了解决玉竹的市场供需危机,其人工驯化抚育工作已经展开,目前部分分布地区也已对玉竹实现了农业化种植养殖生产,逐步成为玉竹原料供应的主体[2]。但目前作为影响玉竹药材安全性的重要因素,植物病害对玉竹的品质和产量存在极大的影响。由锐顶镰孢菌(Fusarium acuminatum)引起的玉竹褐斑病(Cercospora chinensis Tai)主要危害玉竹的叶片部分,出苗之后即发病,一般5 月中旬至6 月下旬为病情流行期,7 月上旬以后基本趋于稳定。病原菌产生的分生孢子可多次侵染植物叶片,造成早期叶枯而导致规模性减产[3]。
现阶段防治玉竹真菌性病害多从农业防治和化学防治角度出发,周阳阳等[4]在研究玉竹病害发生规律的过程中发现,有机硫类和唑类杀菌剂防治玉竹褐斑病效果最优;贾秀梅[5]认为合理运用50%多菌灵500 倍稀释液并结合常规的农业防治办法可以有效防治玉竹褐斑病;也有研究者认为,防治玉竹褐斑病预防尤为主要,在发病前喷洒波尔多液或代森铵药剂对于防治病害的发生具有关键性作用[6]。长期施加化学农药对土壤的微生态环境存在不利影响[7],并且加重环境污染,也使有毒物质在植物体内积累[8],降低玉竹的使用安全性和商品价值。目前对于药用植物病害的防治,国内外研究者已经将目光转向生物防治,由于其具备绿色、安全、有效的特点,因此也是当前的研究热点之一[9, 10]。为此,本研究以锐顶镰孢菌作为靶标菌,从玉竹根际土壤中分离筛选防治效果较好的细菌,旨在为开发利用土壤微生物资源和综合防治玉竹褐斑病提供参考。
1 材料与方法 1.1 材料 1.1.1 菌种锐顶镰孢菌(Fusarium acuminatum)由吉林农业科技学院药植实验室提供;13 种植物病原菌由吉林省农业科学院提供。
1.1.2 培养基[11]马铃薯葡萄糖(PDA)培养基:去皮马铃薯200 g、葡萄糖20 g、琼脂22 g,pH7.0。牛肉膏蛋白胨(NB)固体培养基:牛肉膏3.0 g、蛋白胨10.0 g、NaCl 5.0 g,琼脂20 g,pH7.0-7.2 ;NB 培养液:配方同上但不添加琼脂。BPY[Beefextract-Prptone-Yeast extract(Medium)]发酵液:牛肉膏5 g,蛋白胨10 g,酵母浸膏5 g,葡萄糖5 g,NaCl 5 g,蒸馏水1 000 mL,pH6.8。
1.1.3 主要试剂和仪器50% 多菌灵(吉林市绿盛农药化工有限公司),DNA Marker 和PCR 扩增试剂盒(TaKaRa 公司),PCR 产物纯化试剂盒(上海生工),细菌通用引物(长春联星生物技术有限公司合成),其他常规分析纯试剂购自北京化工厂等。UV-1700 型紫外/ 可见分光光度计(SHIMADZU),GAPS-9700 型PCR 仪(AB Applied Biosystems),HPG-320H 型人工气候箱(哈尔滨东联电子科技有限公司),DYCP-31DN 水平电泳仪(北京市六一仪器厂),GIS-2010 型凝胶成相系统(上海天能科技有限公司)。
1.2 方法 1.2.1 土壤细菌菌株的分离、纯化、保存运用五点采样法,从吉林农业科技学院药植园采集玉竹根际土样若干,土壤经风干后过20 目筛备用。称取样品10 g,将其装入含有90 mL 去离子无菌水的三角瓶中,充分振荡30 min,混匀后静置5 min。无菌条件下取1 mL 上清液,加入9 mL 0.05% 十二烷基苯磺酸钠液,于恒温箱30℃保温10 min 后取液1 mL,加入9 mL 无菌水,按10-3、10-4 和10-5 梯度制成稀释液。分别吸取100 μL 各稀释液,涂布于NB 平板上,每处理3 次重复,置于人工气候箱内32℃培养 24 h。菌株纯化、编号,4℃保藏备用。
1.2.2 发酵液制备将4 块直径为8 mm 的细菌菌饼接入含无菌 NB 培养液的锥形瓶(装液量100mL/250 mL),190 r/min,30℃振荡培养24 h ;取2%NB 种子液接入含有无菌 BPY 发酵液的三角瓶(装液量50 mL/200 mL),185 r/min,30℃振荡培养24 h,所得BPY 菌株发酵液(如下简称BPY)保存备用。如上发酵液均调至含菌量约为108 CFU/mL。
1.2.3 拮抗菌株的活性测定 1.2.3.1 初筛采用滤纸片法[12],每处理3 个重复,以不接供试细菌为对照,30℃培养6-7 d 后待对照组菌落长满平板,测量处理菌落直径。计算抑制率,从中选取抑制率较高的菌株进行复筛。
1.2.3.2 复筛将初筛得到的菌株制备NB 种子液后,以5% 接种量接种到BPY 中(装液量50 mL/200mL),34℃、185 r/min 摇床培养24 h,所得发酵液备用。采用牛津杯法[13],每处理3 次重复,28℃培养7 d 后测量处理菌落直径并计算其抑菌率。
1.2.3.3 抑菌谱测定用生长速率法[14]对活性菌株进行抑菌谱测定。
抑菌率(%)=[(A-B)/(A-8)]×100%
其中,A 为病原菌正常生长直径,B 为被拮抗后病原菌直径,数字为病原菌菌饼直径。
1.2.4 室外盆栽防病试验 1.2.4.1 盆栽方法采用盆钵种植方式,将营养土:蛭石按照3∶1 体积比配制基质填装于15 cm×20 cm育苗盆钵中。取当年生粗壮玉竹分支,将其表面消毒洗净(50℃水中浸泡5 min)后浸泡于预先配置好的菌株发酵液(菌量约为108 CFU/mL)中,25-30min 后取出移栽于装有育苗土的花盆中,每盆4 株,5 盆1 组,每组3 次重复。定苗后进行灌根接种。
1.2.4.2 防病测定保护作用测定:在玉竹苗根茎部分别灌浇10 mL BPY 发酵液,24 h 后接种10 mL锐顶镰孢菌孢子悬浮液(5×104 孢子/mL);治疗作用测定:先接种锐顶镰孢菌孢子悬浮液10 mL,24h 后再灌注等量BPY 菌株发酵液。药剂对照为50%多菌灵500 倍液,空白对照为清水,每处理重复3次。接种病菌 25-30 d 后调查发病情况,计算病情指数和防治效果。
玉竹褐斑病发病程度参考郭巧生[15]的方法分为5 级。0 级:未发病;1 级:病斑面积占总叶面积10% 以下;2 级:病斑面积占总叶面积11%-20% ;3 级:病斑面积占总叶面积21%-40% ;4 级:病斑面积占总叶面积41%-60% ;5 级:病斑面积占总叶面积60% 以上。病情参数和防效分别按照下列公式计算[16]:
病情参数=[Σ(病级植株数× 代表值)/(总植株数× 最高病级代表值)]×100
防效(%)=(对照病情参数- 处理病情参数)/ 对照病情参数×100%。
1.2.5 菌株鉴定 1.2.5.1 菌落形态与生理生化试验实验方法参阅《常见细菌系统鉴定手册》[17]。对划线于固体培养基的菌株进行表态观察,并通过革兰氏染色观察菌株个体形态特征。生理生化实验包括:硝酸盐还原实验、耐盐性培养(2 %、5%、7% 和10%)、运动性、接触酶反应、明胶液化、淀粉水解、柠檬酸钠盐利用、乙酰甲基甲醇实验(V-P 反应)、碳水化合物利用(D-葡萄糖、L-阿拉伯糖、D-木糖、D-甘露醇)。
1.2.5.2 16S rDNA 基因序列分析PCR 扩增菌株的16S rDNA 序列[18, 19],通用引物[20]为16S1F 和16S1R。PCR 扩增反应体系(50 μL)为:基因组DNA 2 μL、dNTP(10 mmol/L)2 μL、10×Buffer 5μL、16S1F 2 μL、16S1R 2 μL、Taq 酶(2.5 U/μL)2 μL、双蒸水35 μL。PCR 扩增条件:94℃预变性5 min ;94℃ 1 min,58℃ 30 s,70℃ 90 s,35 个循环;72℃延伸10 min。纯化后的 PCR 产物送交上海生工生物工程技术服务有限公司测序。序列登陆GenBank 获得登录号并且进行同源性比较,应用Clustal X[21]进行多重比对后,利用MEGA5.1 软件以邻位法构建系统发育树,进行系统进化分析。
1.2.6 数据分析应用 DPS 9.50 标准版统计处理原始数据,Duncan 氏新复极差法分析差异显著性。
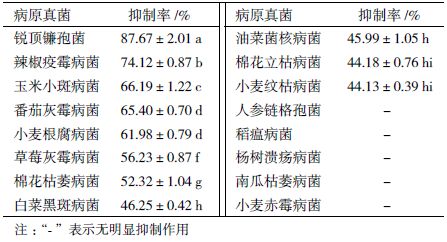
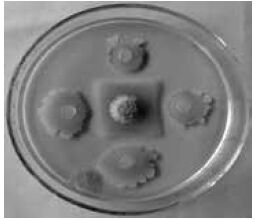
2 结果 2.1 细菌分离及拮抗菌株的筛选从玉竹的根际土壤中共分离得到细菌90 株。运用平板对峙法,以锐顶镰孢菌为标靶菌株,测定供试细菌对病原真菌的拮抗能力。其中8 株细菌对锐顶镰孢菌的抑制率在50% 以上,菌株G-27 和G-36抑制率均在70% 以上,G-27 的抑菌能力最强,抑菌率高达87.67%(图 1),经过多次验证后其抑菌效果仍然较为稳定(表 1)。
|
| 图 1 G-27 对锐顶镰孢菌拮抗抑制效果 |
菌株G-27 对16 种致病菌的拮抗结果表明,G-27对南瓜枯萎病菌、稻瘟病菌、杨树溃疡病菌等5 种病原菌无明显抑制作用,对油菜菌核病菌等4 种供试真菌的抑制作用小于50%,对锐顶镰孢菌、辣椒疫霉病菌、玉米小斑病菌等7 种病原菌的抑制作用为 52%-87%,其中对锐顶镰孢菌的抑制作用为87.67%,说明菌株G-27 的抑菌谱较宽(表 2)。
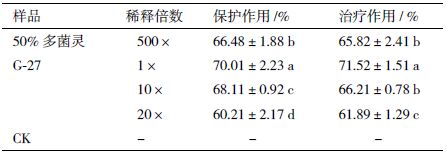
结果显示,G-27 菌株 BPY 发酵液对玉竹褐斑病的保护及治疗作用分别为 70.01% 和71.52%,10倍和20 倍菌株发酵稀释液的保护和治疗作用分别可达66% 和60% 以上,显著性差异结果(表 3)显示,菌株G-27 发酵液处理对玉竹褐斑病的防治优于农药组(P<0.05)。
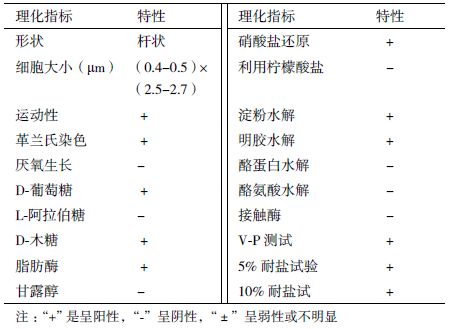
形态观察结果显示,G-27 菌落不规则,边缘不整齐、乳黄色、中心隆起、表面较湿润、半透明。镜检呈杆状,大小为(0.4-0.5)×(2.5-2.7)μm,具鞭毛,G+,有芽孢,具有典型的芽孢杆菌特征(表 4)。
菌株G-27 可在20-35℃的温度下生长,其最适生长温度为30℃。其生长pH 范围为6.5-7.5,最适生长pH 为7.0。菌株G-27 属需氧生长;硝酸盐还原反应生成红色化合物;接触酶测定为阴性;脂肪酶反应为阳性;酪蛋白、酪氨酸反应呈阴性;能利用D-葡萄糖、D-木糖;淀粉水解实验镜检有糊精生成;明胶液化呈阳性;柠檬酸盐利用培养基呈酸性(绿色);VP(pH7.0)测定生成红色化合物;L-阿拉伯糖、甘露醇呈阴性;在加入5%-10% 的NaCl 的牛肉膏蛋白胨培养基上均能生长。由此说明菌株G-27 的生理生化特性与芽孢杆属菌较为接近(表 5)。
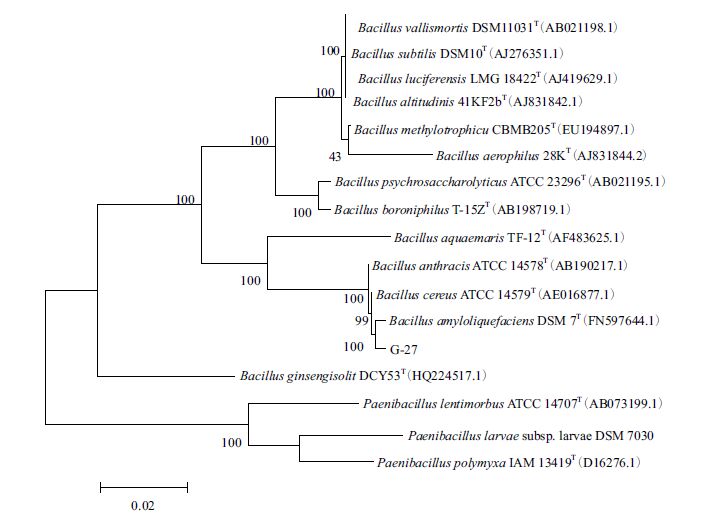
2.5 16S rDNA序列分析经16S rDNA 测序分析,扩增后菌株G-27 的序列长度为1 475 bp,将这一序列提交至GenBank 后,获得注册号KC511118。将G-27 的16S rDNA 序列进行BLAST 比对后结果显示,与报道菌种解淀粉酶芽孢杆菌Bacillus amyloliquefaciens strain BCRC 11601(登录号NR_116022.1)的相似性为99% ;以邻位法构建系统发育树,结果(图 2)显示,G-27 菌株与B. amyloliquefaciens(登录号FN597644.1)处于同一分支,相似性达100%。结合形态学、生理生化特征结果,菌株G-27 可鉴定为解淀粉芽孢杆菌B.amyloliquefaciens。
|
| 图 2 菌株G-27 的系统发育树 |
植物的体内、体表及根茎叶等部位都存在病原菌和对植物有益的腐生微生物系统,它们之间存在着拮抗、寄生和竞争等各种各样的关系[8]。而目前国内外对于植物病害生物防治的相关研究工作,均是基于植物腐生微生物与病原菌之间的相互关系这一原理展开的,其中通过人工分离筛选的办法从自然生境获取生防菌源是实现生物防治的重要一环。普遍认为用作防治植物病害的理想生防菌源应具备如下特点[22]:(1)可强烈抑制或破坏病原菌生长和繁殖;(2)具备多种防病机制;(3)特异性明显,对包括动植物及有益微生物的非标靶生物不存在伤害;(4)规定浓度下可以将病害控制在允许范围内;(5)具备实际市场应用性。
细菌作为生防菌防治植物病害主要是利用其强力的竞争机制,其中芽孢杆属(Bacillus spp.)细菌由于具有抗逆性强、繁殖速度快、易于培养等优点而被广泛用作生防菌源。李德全等[23]应用枯草芽孢杆菌Bacillus subtilis 916 菌株防治大田水稻纹枯病效果显著;秦娟娟等[24]利用枯草芽孢杆菌(B.subtilis)研制的固态菌剂对辣椒疫病的防治效果显著;国外利用短小芽孢杆菌(B. pumilis)防治植物病害也起到了较好的效果[10]。本研究首次发现并证实了解淀粉酶芽孢杆菌B. amyloliquefaciens G-27对锐顶镰孢菌(Fusarium acuminatum)具有明显的抑菌效果,抑菌率高达87.67%,抗菌谱实验证明其对多种植物病害具有一定拮抗抑制作用,拮抗广谱性强;对玉竹褐斑病的盆栽实验显示,施加B.amyloliquefaciens G-27 菌株发酵液对玉竹褐斑病的防病效果优于农药对照组(P<0.05),保护和治疗作用效果分别为70.01% 和71.52%,以拮抗细菌发酵液代替常用化学农药,显著降低了植株的病情指数,取得了良好效果。Bacon 等[25]认为,芽孢杆属菌株分泌的抗生素、生物素等次生代谢产物也是体现其防病作用的重要机制,有关B. amyloliquefaciens G-27产生的抗菌物质分离纯化及其抗菌物质的分子机制需进一步研究,其实际应用价值也仍需进行大田试验后方能验证。
4 结论通过对玉竹根际土壤中细菌进行分离、初筛和复筛,获得1 株对锐顶镰孢菌的菌丝生长具有较强抑制活性的细菌菌株G-27,其抑制率为87.67% ;其对辣椒疫霉病菌、玉米小斑病菌等11 株植物病原菌同样具有拮抗抑制作用,具备广谱抑菌能力。菌株G-27 发酵液对玉竹褐斑病的防病效果优于农药对照组(P<0.05),保护和治疗作用效果分别为70.01%和71.52%。利用传统分类方法和16S rDNA 序列测定对菌株进行了鉴定,将菌株G-27 鉴定为解淀粉芽孢杆菌B. amyloliquefaciens。
| [1] | 国家药典委员会. 中国药典: 一部[M]. 北京: 化学工业出版社,2005 : 57-58. |
| [2] | 彭秧锡, 刘士军, 郭军, 等. 玉竹的研究开发现状与展望[J].食品研究与开发, 2005, 26(6): 120-122. |
| [3] | 吴社高, 吴明志. 玉竹病害种类及药剂防治技术[J]. 中国植保导刊, 2005, 25(2): 27-28. |
| [4] | 周阳阳, 杨洪一. 玉竹锐顶镰孢菌的生物学特性及药剂防治[J].中国农学通报, 2010, 26(9): 315-318. |
| [5] | 贾秀梅. 玉竹常见病害的发生及综合防治[J]. 特种经济动植物,2011(10): 51-52. |
| [6] | 常纪良. 玉竹主要病虫害及综合防治措施[J]. 特种经济动植物,2008(5): 52. |
| [7] | Kalia A, Gosal SK. Effect of pesticide application on soilmicroorganisms[J]. Archives of Agronomy and Soil Science,2011, 57(6): 569-596. |
| [8] | 吴敏. 农药污染对土壤的影响及防治措施[J]. 耕作与栽培,2003(6): 49-50. |
| [9] | Matar SM, El-Kazzaz SA, Wagih EE, et al. Antagonistic andinhibitory effect of Bacillus subtilis against certain plant pathogenicfungi, I[J]. Biotechnology, 2009, 8(1): 53-61. |
| [10] | Akhtar MS, Shakeel U, Siddiqui ZA. Biocontrol of Fusarium wilt byBacillus pumilus, Pseudomonas alcaligenes, and Rhizobium sp. onlentil[J]. Turk J Biol, 2010, 34(1): 1-7. |
| [11] | 方中达. 植病研究方法[M]. 北京: 中国农业出版社, 1998. |
| [12] | 单文荣, 李俊霞, 刘花粉. 滤纸片法筛选不同活性物对棉花黄萎病菌抑制效果研究[J]. 中国农学通报, 2010, 26(19): 285-289. |
| [13] | 贾凤安, 陈亮, 陈立, 等. 大棚甜瓜三种主要真菌病害拮抗细菌的筛选与鉴定[J]. 植物保护学报, 2010(6): 505-510. |
| [14] | 王彩霞, 张清明, 李桂舫, 等. 苹果树腐烂病拮抗细菌菌株BJ1 的鉴定及其抑菌作用[J]. 植物保护学报, 2012, 39(5): 431-437. |
| [15] | 郭巧生. 药用植物栽培学[D]. 北京: 高等教育出版社,2009. |
| [16] | 杨信东, 高洁, 马贵龙, 等. 植物病害疫情控制效果计算公式的改进[J]. 吉林农业大学学报, 1999, 21(3): 46-48. |
| [17] | 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[D]. 北京: 科学出版社, 2001. |
| [18] | Marshall SM, Melito PL, Woodward DL, et al. Rapid identificationof Campylobacter, Arcobacter, and Helicobacter isolates by PCRrestrictionfragment length polymorphism analysis of the 16S rRNAgene[J]. J Clin Microbiol, 1999, 37(12): 4158-4160. |
| [19] | Lim CY, Lee KH, Cho MJ, et al. Detection of Helicobacter pylori ingastric mucosa of patients with gastroduodenal diseases by PCRrestrictionanalysis using the RNA polymerase gene(rpoB)[J].Journal of Clinical Microbiology, 2003, 41 : 3387-3391. |
| [20] | 刘玮琦, 茆振川, 杨宇红, 等. 应用16S rRNA 基因文库技术分析土壤细菌群落的多样性[J]. 微生物学报, 2008, 48(10): 1344-1350. |
| [21] | Thompson JD, Gibson TJ, Plewniak F, et al. The CLUSTAL_X windows interface : flexible strategies for multiple sequencealignment aided by quality analysis tools[J]. Nucleic AcidsResearch, 1997, 25 : 4876-4882. |
| [22] | Wood RKS, Tveit M. Control of plant diseases by use of antagonisticorganisms[J]. Tveit Botanical Review, 1955, 21(8): 441-492. |
| [23] | 李德全, 陈志谊, 刘永锋, 等. 生防菌Bs-916 离子注入突变高效菌株筛选及抑菌防病效果[J]. 植物保护学报, 2006, 33(2): 141-145. |
| [24] | 秦娟娟, 闫淑珍, 刘佳. 植物内生细菌固体菌剂对辣椒的促生和防病作用[J]. 植物保护学报, 2010, 37(4): 325-330. |
| [25] | Bacon CW, Yates IE, Hinton DM, et al. Biological control ofFusarium moniliform in maize[J]. Environ, Health Perspect,2001, 109(suppl. 2): 325-332. |