山羊产羔率是一个低遗传力的数量性状,其遗传力只有0.1 左右[1],所以用常规育种技术难以改良产羔数性状,而产羔率主要取决于每个发情周期中母羊的排卵数。山羊在出生前,卵巢上便形成了大量原始卵泡。初情期前,卵泡虽能发育,但不能成熟排卵,当发育到一定程度时,便闭锁(atresia)退化[2]。初情期后,在每个发情周期中可发育的卵泡多达几十个,但单胎品种最终能发育到成熟排卵的卵泡一般只有1-2 个,其余卵泡中途闭锁死亡,而多胎品种则有多个卵泡能发育到成熟排卵[3]。藏山羊发育较慢,性成熟较晚,一年1 胎[4, 5],金堂黑山羊一年2-3 胎[6],在分子水平上对这两种山羊繁殖性能进行比较研究具有重要意义。
Apaf-1(Apoptotic protease activating factor-1)即凋亡蛋白酶活化因子-1 和Apaf-2 是体内重要的凋亡激活剂。细胞凋亡(Apoptosis)是程序性细胞死亡(Programmed cell death,PCD)的一种表现形态。1996 年在细胞凋亡研究中,首次揭示出两个与凋亡密切相关的蛋白Apaf-1 和Apaf-2。而Apaf-1的cDNA 是Zou 等[7]在1997 年克隆出来的,并证实是线虫CED-4 的人类同源物,它在哺乳动物线粒体依赖性凋亡通路和胚胎发育中至关重要,电子显微镜确认的Apaf-1 分散于细胞质中,而不是在线粒体或其他的细胞器[8]。Apaf-1 在细胞凋亡中处于核心地位,其功能涉及有细胞增殖、分化和凋亡等各个方面[9, 10]。人体内一系列信号转导级联反应均以Apaf-1 为靶而调节凋亡体。Apaf-2 是细胞色素C(CytC),是一个线粒体起源的细胞凋亡信号,进行线粒体CytC 信号转导途径[11],参与Apaf-1 和Casp-9 等因子结合构成凋亡体。正常状态下CytC 不能通过外膜,而在NO、过氧化物酶等因子的诱导下线粒体发生聚集,CytC 便释放到胞质中[12]。排卵前卵泡发育过程中涉及一系列的细胞增殖和凋亡事件,目前对卵泡细胞增殖机制的研究比较深入。有研究结果显示不同绵羊、山羊品种FSH 和LH 的血清浓度及其受体在卵巢中的表达量与其排卵率之间无显著相关性[13, 14],而对卵泡发育过程中的细胞凋亡机制的研究则未见报道。因此,本研究对单胎山羊和多胎山羊Apaf-1 和Apaf-2 基因进行序列分析和组织表达分析,以期为研究山羊多胎机制提供理论依据。
1 材料与方法 1.1 材料 1.1.1 实验动物及样品采集本实验选取健康藏山羊、金堂黑山羊各5 只,金堂黑山羊选自四川金堂,连续3 胎产3 羔山羊品种;藏山羊选自四川省理县,连续3 胎单羔的单胎山羊品种。由于藏山羊一般在秋季发情,且较晚,所以本实验在10 月份对选取的10 只羊同期发情处理:将孕酮阴道栓(CIDR)放入山羊阴道内,11 d 后取出,取出前一天肌肉注射氯前列醇纳2 mL,在取出CIDR 后40 h 左右进行屠宰山羊,屠宰后采取垂体、子宫、卵巢、输卵管和肝脏组织样于已经标记的冻存管中,迅速投入液氮中带回实验室,-80℃保存备用。
1.1.2 主要酶及试剂孕酮阴道栓(CIDR) 产自新西兰,前列腺素产自加拿大;2×Taq PCRMasterMix、动物组织总RNA 提取试剂盒、DNAMarker DL2000 均购自上海天根生物科技有限公司;反转录试剂盒购自Fermentas(MBI)公司;X-Gal、IPTG、氨苄青霉素、克隆载体pMD19-T Vector 购自大连宝TaKaRa 生物工程有限公司;DNA 凝胶回收试剂盒购自爱思进生物技术(杭州)有限公司;E.coli DH5α 感受态细胞购自康迪生物技术有限公司,八连管、盖子及SsoAdvancedTM SYBRÒGreenSupermix购自百乐公司。
1.2 方法 1.2.1 样品总RNA 提取及反转录同一时间将10 只羊(金堂黑山羊和藏山羊各5 只)的5 种组织:子宫、卵巢、输卵管、垂体和肝,采用Trizol法提取RNA[15];cDNA 使用反转录试剂盒ThermoScientific RevertAid First Strand Cdna Synthesis Kit 进行合成。
1.2.2 引物设计与合成目前羊中暂无Apafs 基因序列的公布,所以参照牛的Apafs 基因,根据GenBank中已公布的牛Apaf-1 和Apaf-2(CYCS) 基因序列(登录号NM001191507 和NM001046061),利用引物设计软件Primer Premier5 设计克隆引物和荧光定量引物,定量引物参照牛的基因和克隆出的山羊的全基因序列跨内含子设计,见表 1。其中,Apaf-1 采用分段克隆的策略设计简并引物,设计3 对引物分段扩增cDNA 片段,引物由上海Invitrogen 公司合成。
以反转录cDNA为模板进行PCR 反应,反应体系为25 μL :上下游引物(20 pmol/L)cDNA 模板各1 μL,2× Taq PCRMaster Mi×12.5 μL,ddH2O 9.5 μL。PCR 反应条件为:95℃预变性3 min ;94℃变性30 s,退火温度Apaf-1三个片段分别是50.6℃、54.4℃ 和54.4℃,Apaf-2是58℃ 40 s,72℃延伸90 s,35 个循环;72℃延伸5 min ;4℃保存。PCR 产物用1% 凝胶电泳后,按照爱思进生物工程有限公司胶回收试剂盒进行回收纯化。
1.2.4 克隆测序及生物信息学分析将胶回收产物与克隆载体pMD19-T Vector 于16℃连接12 h。将连接反应产物转化宿主菌E.coli DH5α 感受态细胞,涂布于含氨苄青霉素(Amp)的LB 固体平板上,于37℃恒温箱培养12 h。挑选白色单克隆菌落于含Amp 的LB 液体培养基37℃振荡培养16 h,并进行菌液PCR 鉴定,产物用1% 琼脂糖凝胶电泳检测后,挑选阳性克隆菌液金堂和藏山羊的各2 mL 送交上海英骏生物技术有限公司测序。
1.2.5 实时荧光定量PCR 检测将提取的山羊5 个组织的总mRNA,运用Real-time PCR 方法检测不同组织mRNA 以及内参β-actin 基因的表达量。反应体系为10 μL :上下游引物各0.8 μL、模板dDNA0.5 μL、SYBR Green Supermix 5 μL、ddH2O 2.9 μL。PCR 反应条件为:95℃ 预变性3 min ;95℃ 变性10 s,61.2℃退火20 s,65℃延伸5 s,40个循环;65℃延伸5 min ;4℃保存。实验结果用SPSS17.0 及Excel2007 进行统计分析,用Pfaffi[16]法分析Apaf-1、Apaf-2 基因在两种山羊不同组织中的相对表达量,计算公式为:
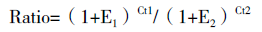
吸取5 μL Apafs 基因胶回收产物与1 μL loadingbuffer 混匀,对其进行电泳检测,用1% 琼脂糖凝胶电泳检测条带。结果(图 1)显示,第1、2 泳道与预期大小1 942 bp 基本一致,第3、4 泳道与预期大小1 369 bp 基本一致,第5、6 泳道与预期大小774bp 基本一致;第7、8 泳道为金堂黑山羊和藏山羊Apaf-2 基因目的条带,与预期大小639 bp 基本一致,且目的条带较明亮,有利于后续实验的进行。

|
| 图 1 Apaf-1 和Apaf-2 基因PCR 产物电泳检测 |
测序结果显示,两种山羊的基因序列无碱基变化。将获得的基因序列提交NCBI,Apaf-1 基因全长CDS 为3 750 bp,登录号KP245916 ;Apaf-2 基因CDS 全长是318 bp,登录号KMB823520。通过DNAman 分析金堂黑山羊和藏山羊与其他物种Apaf-1和Apaf-2 基因CDS 区的核苷酸序列同源性,Lasergene建立同源图,结果(图 2 和图 3)显示,Apaf-1基因CDS 区的核苷酸序列与绵羊(XM_004006637)、牛(NM_001191507.1)、野猪(XM_003481742)、马(XM_005606535)、家猫(XM_003989131)、人(AF-149794.1)、猕猴(XM_001086717.2) 和褐家鼠(AF218388)的同源性分别为99.4%、97.3%、92.3%、91.5%、91.5%、86.9%、86.7% 和84.2% ;Apaf-2 基因CDS 区的核苷酸序列与绵羊(XM_004013157.1)、藏羚羊(NM_005976593.1)、牛(NM_001046061.2)、野猪(NM_001129970.1)、虎鲸(XR_183516.1)、家马(HQ889872.1)、狼(NM_001197045.1) 和黄家鼠(XM_005340301.1)、小家鼠(NM_007868.4)、人类(NM_018947.5) 的同源性分别为99.7%、99.4%、98.4%、94%、93.1%、92.1%、91.2%、91.2%、90.3% 和89.3%。

|
| 图 2 山羊Apaf-1 基因的同源性分析 1 |
|
| 图 3 山羊Apaf-2 基因的同源性分析 |
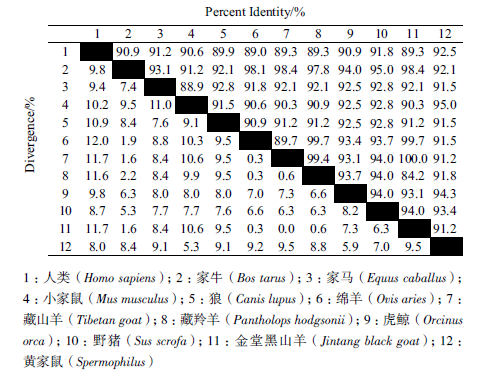
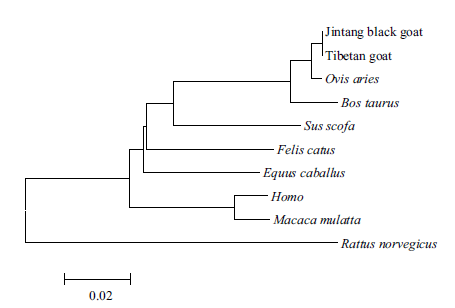
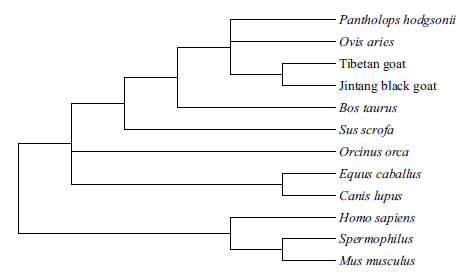
用MEGA6.0 软件的邻接法(Neighbor-Joiningmethod,NJ)构建系统进化树,Apaf-1 基因系统进化树结果(图 4)表明,山羊和绵羊亲缘关系最近,山羊先与绵羊聚为一类,再与牛聚为一类,与野猪聚为一类,然后与马聚成一大类后,最后与人、猴、鼠为一类;Apaf-2 基因系统进化树结果(图 5)表明,山羊和绵羊亲缘关系最近,山羊先与绵羊聚为一类,与牛聚为一类,然后与虎鲸、家马、狼聚为一类,最后与人、黄家鼠和小鼠为一类,这与哺乳动物的进化程度一致。
|
| 图 4 藏山羊和金堂黑山羊Apaf-1 基因的系统进化树 |
|
| 图 5 藏山羊和金堂黑山羊Apaf-2 基因的系统进化树 |
克隆获得的山羊Apaf-1 基因CDS 全长3 747 bp,用ExPASy 在线对其蛋白质组成进行预测发现,该基因编码1 249 个氨基酸,相对分子量为142.0 kD,等电点(pI)为5.94,其氨基酸组成中亮氨酸的含量最高,占11.2%,分子式为C6302H9874N1716O1885S67 ;该基因编码的蛋白质为中性蛋白,既有亲水性也有疏水性,存在于细胞质中。Apaf-2 基因CDS 全长315 bp,编码105 个氨基酸,相对分子量为14.5 kD,pI5.31,丙氨酸含量最高为32.7% ;在第15、第80和第97 位氨基酸附近,该蛋白质为疏水,其余部分为亲水,共价结合于线粒体内膜。
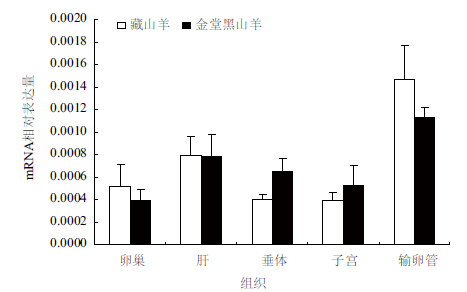
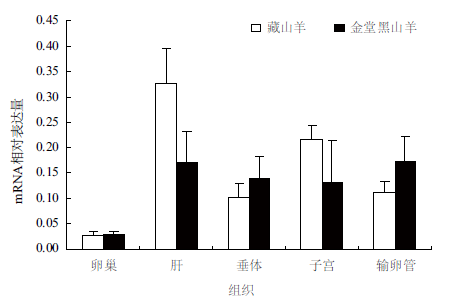
2.4 Apafs基因定量结果的分析采用实时荧光定量(Real-time PCR)的方法,以β-actin 为参照,对Apaf-1 和Apaf-2 基因在藏山羊和金堂黑山羊5 个组织中的mRNA 相对表达量进行实验,结果(图 6,图 7)表明,Apaf-1 和Apaf-2的mRNA 在山羊输卵管、卵巢、子宫、垂体、肝中都有表达;金堂黑山羊的Apaf-1 在卵巢和输卵管中表达量较高,藏山羊的Apaf-2 基因在肝脏和子宫中表达量较高,总体上Apaf-1 相对表达量低于Apaf-2,但两个品种间差异不显著(P>0.05)。
|
| 图 6 Apaf-1 基因在藏山羊和金堂黑山羊不同组织中的相对表达量(x±s) |
|
| 图 7 Apaf-2 基因在藏山羊和金堂黑山羊不同组织中的相对表达量(x±s) |
细胞凋亡(PCD)[17]对于多细胞生物个体发育的正常进行,自稳平衡的保持,抵御外界各种因素的干扰等起着重要的作用。近年来,对细胞凋亡的研究已从聚焦细胞核的改变,转向对于线粒体呼吸链变化的研究。在细胞凋亡的研究[18]中揭示出3个与凋亡密切相关的蛋白细胞凋亡蛋白酶活化因子参与了细胞凋亡的过程,包括Apaf-1、细胞色素c(Cytc/Apaf-2) 和Casp-9(Apaf-3)3 个成员,参与激活caspase,通过与Bcl-2 家族等蛋白因子的相互作用来调控PCD 进程。Apaf-1 与凋亡抑制基因是独立的,如Bcl-2 通过胱天蛋白酶非依赖性机制保护线粒体功能,从而保护细胞,但不依赖于Apaf-1[19]。而Apaf-2(细胞色素C,cytochrome C,Cytc)是呼吸链中的一个基本成分,在氧化还原和能量代谢中起着重要的作用,同时细胞色素C 是线粒体启动凋亡程序的关键物质[20]。Gabriel 等[21]给细胞注射外源性Cytc 后发现线粒体调节的凋亡通路可不依赖Apaf-1/Casp-9,而由线粒体膜释放凋亡诱导因子AIF介导完成。本实验蛋白质分析证实了Apaf-1 蛋白存在于细胞质中,与Kirsten 等[22]的研究结果一致,人的Apaf-1 基因位于染色体12q23,Apaf-2 蛋白为水溶性蛋白,位于线粒体内膜外侧。
与凋亡相关的基因很多,但在哺乳动物上很少通过凋亡因子来研究对繁殖的影响。本实验在两种山羊不同组织中对凋亡蛋白酶活化因子Apaf-1 和Apaf-2 基因进行克隆、定量表达在多胎和单胎上进行对比,两个基因核苷酸序列无差异,表达也没有差异,与绵羊同源性达99.7% 和99.4%。藏山羊和金堂黑山羊Apaf-1 和Apaf-2 基因编码区序列与牛、人、小鼠、褐家鼠均有较高的同源性,说明Apaf-1和Apaf-2 基因在哺乳动物中均具有较高的保守性。根据Apaf-1 和Apaf-2 基因编码区核苷酸序列构建的分子系统进化树和同源图,山羊和绵羊亲缘关系最近,其次为藏羚羊、牛,各个分支置信度高,表明系统进化树的结果可靠。Apaf-1 和Apaf-2 的mRNA在研究的两个山羊品种的卵巢、子宫、输卵管、肝脏和垂体都有表达,但品种间无显著差异(P>0.05),说明这两个基因不是影响单胎和多胎的主要基因。
4 结论本实验采用RT-PCR 技术首次克隆了山羊Apaf-1 基因和Apaf-2 基因,高繁金堂黑山羊与低繁藏山羊的这两种基因CDS 编码区序列无核苷酸差异,山羊和其他物种有着很高的同源性,这两种基因在生物进化上高度保守。Apaf-1 基因包含一个3 750 bp的开放阅读框,编码1 249 个氨基酸;Apaf-2 基因CDS 为318 bp 编码105 个氨基酸。两个基因在两种山羊的表达无显著差异。
| [1] | Notter DR. Genetic improvement of reproductive efficiency of sheepand goats[J]. Anim Reprod Sci, 2012, 130(3-4): 147-151. |
| [2] | Paster LM, Pallares J, Roca J. Histological characterization and insitu localization of apoptosis in the pig follicular atresia[J]. Ital JAnat Embryol, 2001, 106(2Suppl.2): 257-262. |
| [3] | Fabre S, Pierre A, Mulsant P, et al. Regulation of ovulation rate inmammals : contribution of sheep genetic models[J]. Reprod BiolEndocrinol, 2006, 4 : 20. |
| [4] | 赵有璋, 张英杰, 岳文斌, 等. 羊生产学[M]. 第3 版. 北京: 中国农业出版社, 2011. |
| [5] | 王杰, 王永, 欧阳熙, 等. 藏山羊研究[J]. 中国畜牧杂志,1993, 29(1): 10-13. |
| [6] | 许德贵, 张家明, 唐诗军, 等. 金堂黑山羊生产性能研究[J].四川畜牧兽医, 2006, 33(11): 25-26. |
| [7] | Zou H, Henzelw J, Liu X, et al. Apaf-1, a human protein homologousto c, elegans CED-4, participates in cytochrome c dependentactivation of caspase-3[J]. Cell, 1997, 90(3): 405-413. |
| [8] | Hausman G, O’Reilly LAvan Driel-R, Beaumont JG. Pro-apoptoticapoptosis protease-activating factor1(Apaf-1)has a cytoplasmiclocalization Distinct from Bcl-2 or Bcl-x L[J]. J Cell Biol, 2000,149(3): 623-633. |
| [9] | Hoppe J, Kilic M, Hoppe V, et al. Formation of caspase-3 complexesand fragmentation of caspase-12 during an isomycin inducedapoptosis inAKR-2B cells without aggregation of Apaf-1[J]. EurCell Biol, 2002, 81(10): 567-576. |
| [10] | Ferraro E, Corvaro M, Cecconi F. Physiological and pathologicalroles of Apaf1 and the apoptsomel[J]. Cell Mol Med, 2003, 7(1): 21-34. |
| [11] | Wang X. The expanding role of mitochondria in apoptosis[J].Genes and Development, 2001, 15(22): 2922-2933. |
| [12] | Haga N, Fujita N, Tsuruo T. Mitochondrial aggregation precedescytochrome c release from mitochondria during apoptosis[J].Oncogene and Oncogene Reviews, 2003, 22(36): 5579-5585. |
| [13] | Drouilhet L, Taragnat C, Fontaine J, et al. Endocrine characterizationof the reproductive axis in highly prolific Lacaune sheephomozygous for the FecL(L) mutation[J]. Biol Reprod, 2010,82(2): 815-824. |
| [14] | Zi XD, Huang L, Wang Y, et al. Comparative messenger RNAexpression of FSHβ, LHβ, FSHR, LHR, and ERβ in high and lowprolific goat breeds[J]. Anim Biotechnol, 2013, 24(4): 307-311. |
| [15] | 萨姆布鲁克J, 拉塞尔DW. 分子克隆实验指南[M]. 北京: 科学出版社, 2002. |
| [16] | Pfaffl MW. A new mathematical model for relative quantification inreal-time RT-PCR[J]. Nucleic Acids Res, 2001, 29(9): e45. |
| [17] | Kerr JF, Wyllie AH, Currie AR. Apoptosis : a basic biologicalphenomenon with wide ranging implications in tissue kinctics[J].Cancer, 1972, 26 : 239-257. |
| [18] | Li P, Nijhawan D, Budihardjo I, et al. Cytochrome c and dATPdependentformation of Apaf-1/Caspase-9 complex initiates anapoptotic protease cascade[J]. Cell, 2004, 116 : 479-489. |
| [19] | Haraguchia M, Torii S. Apoptotic protease activating factor 1(Apaf-1)-Independent Cell death suppression by Bcl-2[J]. J Exp Med,2000, 191(10): 1709-1720. |
| [20] | 吴兰芳, 杨爱珍, 刘和, 等. 线粒体调控细胞凋亡的研究进展[J]. 中国农学通报, 2010, 26(8): 63-68. |
| [21] | Gabriel B, Sureau F, Casselyn M, et al. Retroactive pathwayinvolving mitochondria in electroloaded cytochrome c-inducedapoptosis : Protective properties of Bcl-2 and Bcl-XL[J]. ExpCell Res, 2003, 289(2): 195-210. |
| [22] | Kirsten L, Helga AE, Stephan FS, et al The adapter proteinapoptotic protease-activating factor-1(Apaf-1)is proteolyticallyprocessed during apoptosis[J]. J Biol Chem, 2001, 276(32): 29772 -29781. |




