2. 东北林业大学 林木遗传育种与生物技术国家重点实验室,哈尔滨 150040
2. State Key Laboratory of Forest Tree Genetic Improvement and Biotechnology,Northeast Forestry University,Harbin 150040
白桦(Betula platyphylla Suk),桦木科桦木属植物,落叶乔木,广泛分布于我国东北黑龙江省内,具有重要的生态价值和工业价值。研究证明,从白桦树皮中提取出的三萜类物质主要成分有白桦酯醇、白桦酯酸及桦叶烯三醇、桦叶烯四醇等,在杀死癌细胞、促进肿瘤细胞凋亡及调节人体免疫机能等方面都具有良好作用[1]。
影响植物次生代谢的因素有许多,如温度、机械损伤、紫外线和化学试剂等,其会对植物生长产生各种胁迫,促进植物次生代谢产物的合成[2]。Zu等[3]发现喜树幼苗在38-40℃胁迫中10- 羟基喜树碱合成显著提高;李波等[4]研究不同条件对苜蓿愈伤组织异黄酮含量的影响,结果表明,在20℃、25℃、30℃和35℃的温度胁迫中,以25℃和30℃下苜蓿愈伤组织中异黄酮积累最高,含量分别为0.497% 和0.570%。以上研究证明,适当的高温胁迫可以显著诱导植物次生代谢产物的合成与积累。
环境胁迫(如高温)促进次生代谢产物积累过程大致为,先激活细胞表面受体,引发信号转导通路,然后调节细胞代谢途径,激活相关抗逆基因的表达,最终引起次生代谢产物的积累[5]。目前发现在植物受到高温胁迫时,多种信号分子如水杨酸(SA)、钙离子(Ca2+)、脱落酸(ABA)、一氧化氮(NO)、过氧化氢(H2O2),在体内含量显著增加[6]。徐茂军等[7]在高温处理金丝桃细胞诱导金丝桃素生物的研究发现,40℃处理10 min 可诱发金丝桃细胞中金丝桃素的生物合成,并促进细胞产生NO 和H2O2,表明在高温胁迫下通过信号分子NO 和H2O2 协同作用,共同促进金丝桃素的合成。此外,高温胁迫还会引起细胞内活性氧的积累过高,破坏细胞结构,从而诱导相关关键防御酶启动,如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和苯丙氨酸解氨酶(PAL),共同抵御因高温胁迫对细胞造成的伤害[8, 9, 10, 11]。
关于利用温度胁迫诱导白桦细胞次生代谢产物合成的相关研究报道不多,本课题组赵微等[12]已发现50℃ 1 h 处理白桦悬浮细胞2 d 后白桦总三萜合成较对照提高了36.4%,防御酶(SOD、CAT、PAL)活性也有不同程度增加。郝征等[13]用高温胁迫对白桦幼苗生理生化指标影响的研究中发现,37℃处理和42℃处理可显著提高SOD 活性和超氧阴离子的积累,且42℃较37℃处理更为显著,表明适度的高温胁迫能激活SOD 活性。本研究在赵微等[12]研究的基础上,进一步优化设计胁迫温度处理,通过研究白桦细胞的细胞活力,防御酶(CAT、SOD、PAL)活性和总三萜的含量变化,初步探索高温胁迫与白桦茎段悬浮细胞次生代谢产物三萜的合成的关系,期望获得最适的高温处理条件,以提高利用白桦茎段悬浮细胞合成三萜类物质的产量,为白桦悬浮细胞在生物反应器中的大规模培养及高效获得白桦三萜提供技术支持。
1 材料与方法1.1 材料以长势良好的白桦茎段悬浮细胞为材料。采用100 mL 的锥形瓶,每个锥形瓶中倒入50 mL NT液体培养基,加入3 g 白桦悬浮细胞,摇床中悬浮培养。
1.2 方法1.2.1 培养条件液体培养基:NT 培养基并在每升培养基中加入0.1 mg/L 的6-BA 100 μL,0.01 mg/L的TDZ 10 μL,蔗糖20 g 和酸水解酪蛋白2 g,最后将pH 值调至6.5 左右。将配制好的NT 培养基倒入100 mL 的锥形瓶中,每个锥形瓶倒入50 mL NT培养基,封口膜封好,在121℃高压蒸汽锅灭菌20min。每瓶培养基接种3 g 白桦悬浮细胞,在培养温度为24-26℃,光强为2 000 lx,光照时间24 h/d,湿度为40%-50%,摇床转速116 r/min 的条件下培养。
1.2.2 高度胁迫处理处理温度设置为5 个水平:35℃、40℃、45℃、50℃和55℃。处理时间设置为3 个水平:1、2 和4 h,分别在处理后的0、6、12、24、48 和72 h 取样。在定量分装好的白桦悬浮细胞培养的第7 天时进行温度处理,并每组重复3 次。在处理后各取样点时间(0、6、12、24、48 和72 h)收获细胞,每组细胞分为两份,一份测量其细胞活力,防御酶(超氧化物歧化酶SOD、过氧化氢酶CAT、苯丙氨酸裂解酶PAL)的活性,一部分放入65℃烘箱烘干至恒重后,研磨成粉状,测量细胞总三萜的含量。
1.2.3 测定方法1.2.3.1 SOD、PAL 及CAT 酶活性测定采用李和生[14]的方法。 1.2.3.2 细胞活力采用TTC 法测定
参考黄纯农[15]的方法。
1.2.3.3 白桦总三萜测定参考赵微等[12]的方法。
2 结果2.1 高温胁迫对白桦细胞活力的影响细胞活力是生长状态和受胁迫程度的指标。高温胁迫下白桦细胞中细胞活力大小如图 1 所示,在35-55℃ 5 个梯度、0-72 h 6 个取样时间点的处理条件下,发现白桦细胞随取样时间延长和处理温度的提高,白桦细胞的细胞活力呈逐渐降低趋势。40-55℃处理1、2 和4 h 后0-72 h 间细胞活力下降较显著,其中50℃处理1 h、2 h 和4 h 后72 h 取样时细胞活力下降最为显著,细胞活力值分别为0.154、0.10 和0.003,是对照的0.69 倍、0.05 倍和0.01 倍,比50℃处理1、2 和4 h 后0 h 取样时分别下降了63.9%、85.6% 和95.3% ;35℃处理1、2 和4 h 后在0-48 h 间细胞活力下降不显著,在处理72 h 后细胞活力明显降低,其中35℃处理1、2 和4 h 后细胞活力值为0.288、0.378 和0.383,分别为对照的1.29 倍、1.70 倍和1.72 倍,较35℃处理1、2 和4 h 后0 h 取样分别下降了82.2%、77.4% 和77.0%(图 1)。40-55℃胁迫下,细胞活力下降显著,初步推测此温度胁迫下可能有利于诱导植物次生代谢转化增强。

|
| 图 1 高温胁迫对细胞活力的影响 |
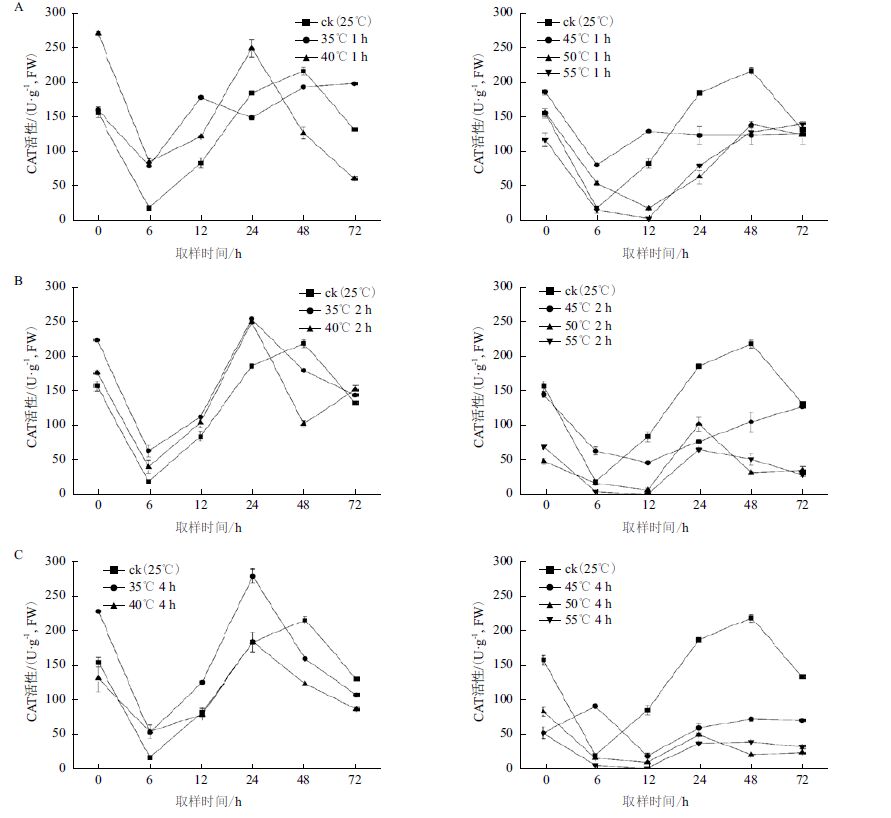
高温胁迫下,细胞H2O2 含量上升会破坏膜稳定性,CAT 可以有效分解 H2O2 从而降低H2O2 对膜系统的损害,是植物抗逆性的重要指标。高温胁迫下白桦细胞中CAT 活性(图 2)显示,在35-55℃共5 个梯度、0-72 h 共6 个取样时间点的处理条件下,发现白桦细胞CAT 活性在35℃和40℃处理1、2 和4 h 后CAT 活性呈现先下降后增加,最后逐渐降低的趋势。其中,在0-24 h 取样CAT 活性较对照显著增加,以35℃和40℃处理1 h 后在6h 取样,CAT 活性提升最为明显,分别较对照提高338.9% 和372.2% ;48 h 后CAT 活性普遍低于对照,以40℃ 1 h 处理72 h 后取样CAT 活性最低,较对照下降54.2%(图 2-A)。45-55 ℃ 1、2 和4 h 处理后CAT 活性呈先降低后逐渐增加趋势,且显著低于对照;在相同温度下随着处理时间的增加,CAT 活性下降显著,以55℃ 2 h 和4 h 处理在12 h 后取样最低,CAT 活性为0(图 2-B 和图 2-C)。结果表明,35-40℃胁迫后CAT 变化趋势与对照基本一致,且在0-24h 内能显著诱导CAT 活性增加;在45-55℃胁迫下CAT 活性则被显著抑制。
|
| 图 2 高温胁迫对CAT 活性的影响 |
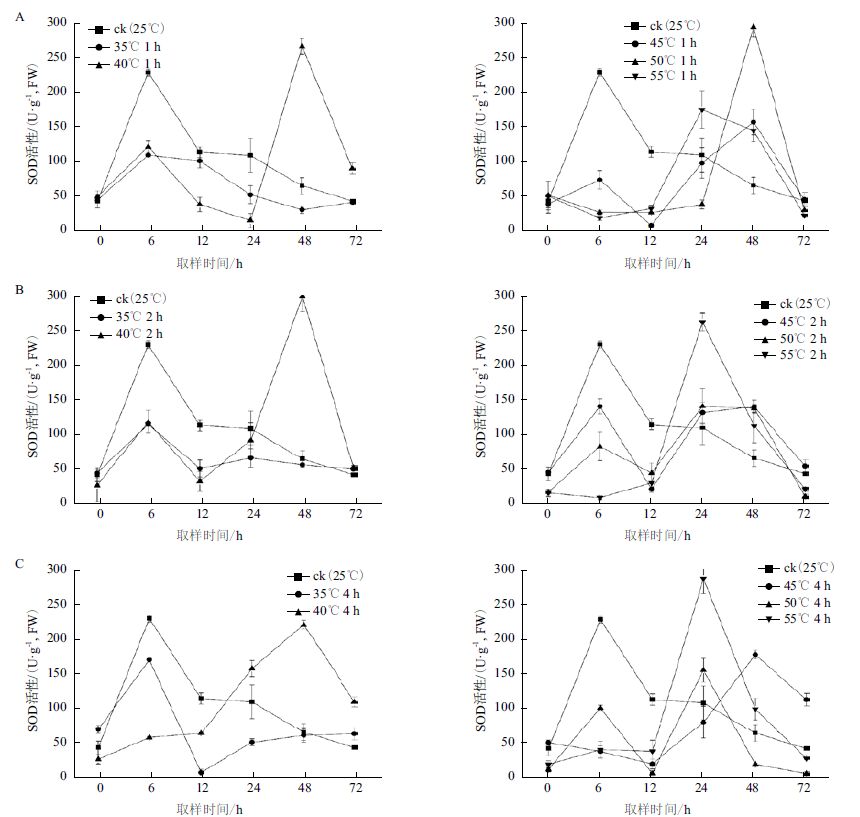
SOD 主要将超氧阴离子歧化后生成H2O2,可有效地清除因高温引起细胞内活性氧的积累。高温胁迫后白桦细胞中SOD 活性如图 3 所示,在35-55℃的5 个梯度、0-72 h 的6 个取样时间点的处理条件下,发现白桦细胞SOD 活性在35℃处理1、2 和4 h 后呈先增加后逐渐降低的趋势,且较对照无显著增加;40-55℃处理1、2 和4 h 后均在24-48 h 间达到峰值,且较对照显著增加,以55℃处理1 h 和2 h 后24 h 取样时SOD 活性最高,分别较对照提高60.4%和140.3% ;50℃处理1 h 和45℃ 2 h 在48 h 取样时SOD 活性最高,分别较对照提高357.7% 和116.3%。结果表明,35℃处理后SOD 活性变化趋势与对照基本一致,且SOD 活性无显著提高;较高的温度胁迫(40-55℃)后在24-48 h 内可以显著诱导SOD 活性的提高。
|
| 图 3 高温胁迫对SOD 活性的影响 |
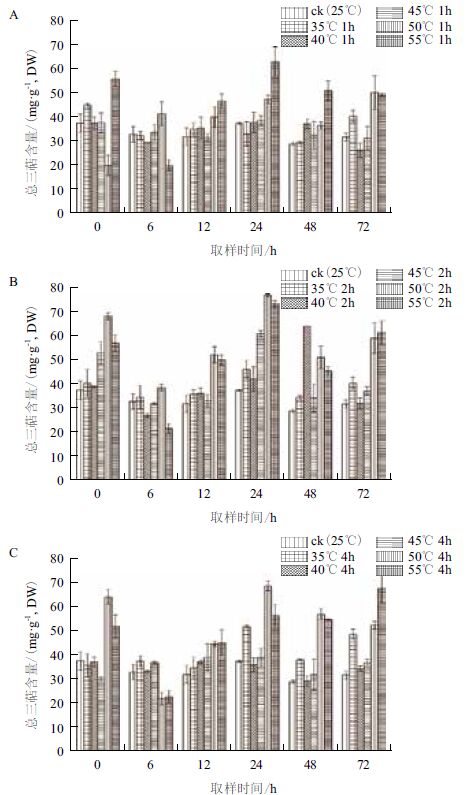
PAL 是苯丙烷代谢途径关键酶和限速酶,此途径可产生许多具有天然药物活性的次生代谢产物。高温胁迫后白桦细胞中PAL 活性(图 4)显示,在35-55℃的5 个梯度、0-72 h 的6 个取样时间点的处理条件下,发现40-55℃处理1、2 和4 h 后白桦细胞细胞PAL 活性呈先下降后增加,最后逐渐降低的趋势,以50℃处理1 h、2 h 与55℃处理4 h 在24h 取样时PAL 活性最高,分别较对照提高246.2%、246.2% 和259.6% ;35℃ 较40-55 ℃ 处理下PAL 活性增加不显著,以35℃处理4 h 后0 h 取样下活性较对照提升最高,但仅提高13.3%(图 4-C)。结果表明,50℃和55℃胁迫后24 h 能显著诱导PAL 活性增加,而35℃对PAL 活性的提高无显著影响。2.3 高温胁迫对白桦细胞总三萜含量的影响白桦细胞中总三萜含量如图 5 所示,50℃和55℃处理下白桦细胞的总三萜含量相比对照提高最为显著,45℃处理次之,35-40℃的温度处理中,总三萜含量较对照无显著增加。50℃处理2 h、4 h 与55℃处理2 h 后的24 h 取样时细胞总三萜含量较高,含量分别为76.66、68.63 和73.24 mg/g,分别较对照提高105.6%、84.03% 和96.4%(图 5-B 和图 5-C)。

|
| 图 4 高温胁迫对PAL 活性的影响 |
|
| 图 5 高温胁迫对总三萜含量的影响 |
高温胁迫会对植物正常代谢产生一系列损伤,主要会引起细胞膜系统的破坏,细胞膜流动性增大,导致细胞液外渗,从而对细胞正常代谢产生不利影响[16]。细胞活力是衡量植物细胞新陈代谢活力的重要指标,本研究中在温度35℃和对照(25℃)中,细胞活力在24 h 短暂上升,并随取样时间的延长,呈逐渐降低趋势,这一点与刘华[17]在红豆杉细胞活力与生长周期关系的研究结果基本一致;而本研究中40-55℃处理下白桦细胞活力均显著低于对照。
高温胁迫还会诱导细胞内活性氧含量增加,从而启动防御酶SOD,CAT,清除氧自由基,维持细胞内的活性氧平衡,抵御高温对细胞造成的损伤[18, 19, 20]。本研究发现在45-55℃ 1、2 和4 h 处理后CAT 活性先在0-12 h 呈下降趋势,之后再呈缓慢上升趋势,在35-40℃胁迫下的0-12 h,细胞CAT 活性显著高于对照;35-40℃胁迫下能诱导白桦细胞CAT 活性不同程度的增加,而在45-55℃胁迫下则显著抑制CAT 活性,且抑制程度随高温处理时间的延长而增加,与李忠光等[21]对CAT 活性研究结果类似。在40-55℃处理下白桦细胞SOD 活性在24-48 h 均逐渐达到峰值,然后下降,且比对照显著增加,而35℃处理下,SOD 活性无显著提升,表明在40-55℃胁迫条件下SOD 活性显著增加,与赵微等[12]和马宝鹏等[22]对SOD 酶活性的研究结果类似。
PAL 是合成许多具有天然药用活性成分次生代谢产物的关键酶,其活性的增加也能提高植物细胞对高温胁迫的适应性[23, 24]。本研究在50℃和55℃处理下PAL 活性较对照提升最为显著,且此时白桦细胞总三萜含量也较高,表明在50℃和55℃高温胁迫诱导PAL 活性增加,且PAL 可能在白桦三萜合成中起到关键作用。张长平等[25]在南方红豆杉细胞悬浮培养过程中,加入真菌诱导子,从而引起PAL活性提高,萜类物质合成得到加强,紫杉醇的产量得到显著提高,与本研究结果相似。
在赵微等[12]的研究中已发现在50℃处理1 h能够显著诱导白桦悬浮细胞三萜类物质的合成与积累,本研究在此基础上通过对高温胁迫条件的优化,发现50℃和55℃处理2 h 后24 h 取样时白桦细胞总三萜含量有较高积累;细胞活力显著下降;PAL和SOD 活性增加,可能在50-55℃高温胁迫下,由于温度过高对白桦细胞膜系统破坏加剧,且在细胞内积累了大量活性氧,激活植物防御酶反应,引起PAL 和SOD 活性显著增加,CAT 活性可能由于SOD产物H2O2 浓度过高而被抑制,对细胞正常的生长代谢造成不利影响,促进细胞初生代谢向次生代谢转换,从而诱导白桦悬浮细胞总三萜物质的合成与积累显著增强。
4 结论本研究最终确定50℃胁迫2 h 后24 h 取样为利用高温胁迫诱导白桦悬浮细胞合成三萜类物质的最适温度胁迫条件,同时此温度胁迫下不同程度地刺激了CAT、SOD、PAL 活性变化及细胞活力大小,表明在高温胁迫下,细胞内的防御酶协同作用,共同抵御高温胁迫对白桦细胞造成的伤害,并诱导白桦次生代谢产物三萜的合成。
| [1] | 李娇妹, 郑纺, 翟丽娟, 薛照辉. 三萜类化合物抗肿瘤活性研究进展[J]. 中草药, 2014, 15 :2265-2271. |
| [2] | 郭艳玲, 张鹏英, 郭默然, 等. 次生代谢产物与植物抗病防御反应[J]. 植物生理学报, 2012, 48(5):429-434. |
| [3] | Zu YG, Tang ZH, Yu JH, et al. Different responses of camptothecin and 10-hydroxycamptothecin to heat shock in Camptothecaacuminata seedlings[J]. Acta Botanica Sinica, 2003, 45(7):809-814. |
| [4] | 李波, 肖静, 李铁, 等. 不同条件对苜蓿愈伤组织异黄酮含量的影响(简报)[J]. 草地学报, 2007, 15(5):500-502. |
| [5] | 陈思婷, 郭房庆. 植物耐热性及热激信号转导机制研究进展[J].中国科学:生命科学, 2013, 43(12):1072-1081. |
| [6] | Sudha G, Ravishankar GA. Involvement and interaction of varioussignaling compounds on the plant metabolic eventsduring defenseresponse, resistance to stress factors formation of secondarymetabolites and their molecular aspects[J]. Plant Cell TissueOrgan Cult, 2002, 71 :181-212. |
| [7] | 徐茂军, 董菊芳, 张新波. NO 和H2O2 在介导热激诱发金丝桃细胞合成金丝桃素中的信号互作[J]. 中国科学:C 辑, 2008,38(7):643-653. |
| [8] | 阮孟斌, 彭明. 植物响应非生物胁迫相关基因的研究进展[J].热带生物学报, 2012, 2(4):364-372. |
| [9] | 李秀, 巩彪, 徐坤. 外源NO 对高温胁迫下姜叶片活性氧代谢的影响[J]. 园艺学报, 2014, 41(2):277-284. |
| [10] | 王成坤. 侵染大豆的主要病毒种类及高温对大豆对 SMV 抗性的影响研究[D]. 南京:南京农业大学, 2013. |
| [11] | Bartwal A, Mall R, Lohani P, et al. Role of secondary metabolitesand brassinosteroids in plant defense against environmentalstresses[J]. Journal of Plant Growth Regulation, 2013, 32(1):216-232. |
| [12] | 赵微, 尹静, 詹亚光, 等. 温度胁迫对白桦悬浮细胞中三萜积累及防御酶活性的影响[J]. 中国生物工程杂志, 2013, 33(2):34-40 |
| [13] | 郝征, 张钢, 李亚. 不同高温胁迫对白桦幼苗几个生理生化指标和电阻抗图谱参数的影响[J]. 西北植物学报, 2010(9):1844-1851. |
| [14] | 李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社, 2000 :164-165. |
| [15] | 黄纯农. 用FDA-PI 双色荧光法鉴定大麦原生质体活性[J].细胞生物学杂志, 1988, 10(3):133-135. |
| [16] | Horváth I, Glatz A, Nakamotoh H, et al. Heat shock response inphotosynthetic organisms :Membrane and lipid connections[J].Progress in Lipid Research, 2012, 51(3):208-220. |
| [17] | 刘华. 悬浮培养红豆杉细胞活力及存活率与生长周期的关系[J]. 生物学杂志, 2002, 19(1):19-20. |
| [18] | Zhao X, Nishimura Y, Fukumoto Y, et al. Effect of high temperatureon active oxygen species, senescence and photosynthetic propertiesin cucumber leaves[J]. Environmental and Experimental Botany,2011, 70(2):212-216. |
| [19] | Lidon FC, Teixeira MG. Oxy radicals’production and control inthe chloroplast of Mn-treated rice[J]. Plant Sci, 2000, 152:7-15. |
| [20] | Baxter A, Mittler R, Suzuki N. ROS as key players in plant stresssignaling[J]. Journal of Experimental Botany, 2014, 65(5):1229-1240. |
| [21] | 李忠光, 龚明. 抗氧化系统在热激诱导的玉米幼苗耐热性形成中的作用[J]. 云南植物研究, 2007, 29(2):231-236. |
| [22] | 马宝鹏, 逯明辉, 巩振辉. 辣椒幼苗对高温胁迫的生长生理响应[J]. 西北农林科技大学学报:自然科学版, 2013, 41(10):112-118. |
| [23] | 张宽朝, 金青, 蔡永萍, 等. 苯丙氨酸解氨酶与其在重要次生代谢产物调控中的作用研究进展[J]. 中国农学通报, 2008,12 :59-62. |
| [24] | Rivero RM, Ruiz JM, Garc¹a PC, et al. Resistance to cold andheat stress :Accumulation of phenolic compounds in tomato andwatermelon plants[J]. Plant Science, 2001, 160(2):315-321. |
| [25] | 张长平, 李春, 元英进, 等. 真菌诱导子对悬浮培养南方红豆杉细胞态势及紫杉醇合成的影响[J]. 生物工程学报, 2001,17(4):436-440. |




