2. 中国农业科学院甘蔗研究中心 广西农业科学院甘蔗研究所 农业部广西甘蔗生物技术与遗传改良重点实验室 广西甘蔗遗传改良重点实验室,南宁 530007
2. Sugarcane Research Center,Chinese Academy of Agricultural Sciences Sugarcane Research Center,Guangxi Academy of Agricultural Sciences Key Laboratory of Sugarcane Biotechnology and Genetic Improvement(Guangxi),Ministry of Agriculture Guangxi Key Laboratory of Sugarcane Genetic Improvement,Nanning 530007
甘蔗是重要的糖料和能源作物,我国甘蔗糖产 量占全国食糖总产量的比例高达90% 以上,在国民 经济中占有重要地位[1]。甘蔗成熟茎以积累高浓度 蔗糖为主,涉及到蔗糖的合成、分解和运输等生理 过程,而调控蔗茎中蔗糖积累的关键性因素是存在 于快速发育的茎细胞中蔗糖的跨膜运输能力和蔗糖 糖代谢相关酶的活性[2]。植物中与蔗糖代谢密切相 关的酶主要有3 类:蔗糖合成酶(Sucrose synthase, SS)、蔗糖磷酸合成酶(Sucrose phosphate synthase, SPS)和转化酶(Invertase,INV)。其中合成蔗糖酶 类主要是SS 合成方向和SPS,而分解蔗糖酶类主要 是可溶性酸性转化酶(Soluble acid invertase,SAI)、 细胞壁结合转化酶(Cell wall invertase,CIN)、中性/ 碱性转化酶(Neutral/alkaline invertase,NI)和SS 分 解方向[3]。葡萄糖、果糖和蔗糖是糖积累的主要产 物,而蔗糖代谢相关酶活力水平高低不仅影响含糖 量,而且还决定“库”器官中积累糖的成分。
SS 是促使蔗糖进入各种代谢途径的关键酶之 一。它是一种可逆酶,既能催化蔗糖合成,又可以 催化蔗糖分解,其催化的反应是:蔗糖+UDP ←→ 果糖+UDPG。在植物体中SS 有3 种存在方式,即 存在于细胞质中的可溶性SS、结合与细胞膜上的不 溶性SS 和结合于肌动蛋白细胞骨架上的不溶性SS。 其中胞质中的SS 是蔗糖代谢途径中的一个重要控制 点,它的活性反映了植物体内蔗糖积累的能力[4]。 此外,SS 还参与细胞分化与纤维细胞壁合成、调节 淀粉合成以及提高植物抗逆性等各种生理活动[5]。
SPS 是一个多基因家族,可以分为5 大类,共4 个家族:SPS Ⅰ(C 家族)、SPS Ⅱ(A 家族)、SPS Ⅲ(D 家族)、SPS Ⅳ(D 家族) 和 SPS Ⅴ(B 家 族),由于SPS Ⅲ和SPS Ⅳ进化关系较近,而归为 同一家族[6]。SPS 是植物体内光合产物向蔗糖和淀 粉分配的关键调控点,与蔗糖的积累呈正相关[7]。 它与植物的株高和产量等农艺性状密切相关[8],并 在植物抗逆,如抗寒、抗旱和耐盐过程中起重要 作用[9]。
目前对SPS 和SS 与甘蔗蔗糖积累的相关性研 究的比较多,但大部分对SS 酶活性研究仅限于合成 方向,而对分解方面的酶活性研究的相对较少。本 研究在前期分析SAI、CIN、NI 和转化酶抑制子与节 间蔗糖积累相关性的基础上,继续以工艺成熟期甘 蔗品种ROC22 和GT28 的+1 叶和不同节间为材料, 分析SPS、SS 合成和SS 分解方向酶活性与蔗糖积累 相关性。本研究旨在探明工艺成熟期甘蔗糖代谢的 关键酶SS 和SPS 活性,以及主要产物的变化规律, 为进一步了解甘蔗SPS 和SS 酶活性变化与蔗茎中蔗 糖积累之间的关系奠定理论基础。
1 材料与方法 1.1 材料 1.1.1 材料以甘蔗早熟高产高糖品种桂糖28 (GT28)和早中熟高产高糖品种ROC22 为材料。取 材于2012 年春种植于广西大学农学院甘蔗资源圃 的新植蔗,取材时间为2012 年12 月22 日。采样时 以顶端第一片完全展开叶为+1 叶,+1 叶包裹的节 为+1 节,由+1 节向下节间数逐渐增加[10],分别取 +1 叶(L1)、+1 节(I1)、+6 节(I2)、+11 节(I3)、 +16 节(I4)、+21 节(I5)、+26 节(I6)和+31 节(I7)。 每个小区取12 株,把节间数相同节去皮,切碎混匀 后取样。重复3 次。
1.1.2 仪器和试剂节间锤度测定采用日本爱拓迷 你数显折射计PAL-1 ;酶活性和还原糖含量的测定 采用美国伯腾Synergy H1 全功能酶标仪;蔗糖含量 的测定采用美国Water 公司Alliance2695 高效液相 色谱仪。乙腈、蔗糖均为色谱纯,实验用水为超纯水。
1.2 方法 1.2.1 甘蔗糖分的测定 1.2.1.1 节间锤度去掉甘蔗节间叶片和叶鞘,取 节间少许茎汁滴于PAL-1 数显手持糖度计上,测定 蔗汁锤度。测定时温度为16-17.5℃。
1.2.1.2 蔗糖含量测定将甘蔗节间去皮并切成小 块,用液氮研磨成均匀的粉末状。称取2.5 g 粉末 置于50 mL 离心管,加入10 mL 80% 乙醇。80℃水 浴提取30 min,每隔5 min 摇匀一次。12 000 r/min 离心15 min,取上清。沉淀用10 mL 80% 乙醇重复 抽提2 次。合并上清液于50 mL 离心管中。将其置 于90℃水浴锅中水浴3 h(大约),挥发上清液至大 约2 mL。吸取上清液定容到10 mL。用0.22 μm 过 滤除去杂质,得到糖分提取液。采用HPLC 法测定 样品中的蔗糖含量。色谱分析条件为:分析柱为YMC-Pack NH2 carbohydrate column(250×4.6 mm,5 μm)、株温40℃和流速1 mL/min,进样量为20 μL。 乙腈∶水为80∶20,时间20 min。 将上述糖分提取液进行适度稀释后,采用硫酸 蒽酮法测定样品中的可溶性总糖含量。
1.2.2 酶的提取和测定准确称取用液氮研磨的2 g 粉末放入10 mL 离心管中,加8 mL 酶提取液,在 冰上震荡提取30 min。于4℃,15 000 r/min 离心10 min,取上清液4 mL 放入2 mL 离心管中。SPS 酶活 性测定参照Gutiérrez-Miceli[11],而SS 分解方向和 合成方向酶活性测定参照Schäfer 等[12]的方法,并 略做改动。
1.2.3 统计分析采用Excel 2007 进行数据处理, 用SPSS 15.0 进行显著性和相关性分析。
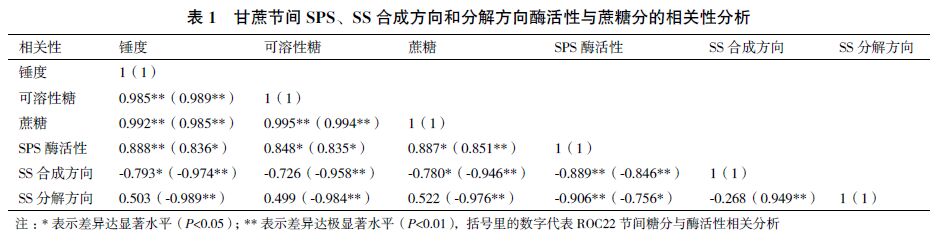
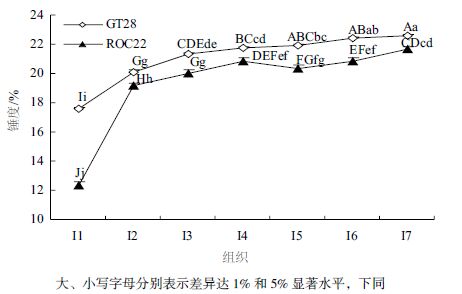
2 结果 2.1 甘蔗节间锤度分析随着节间数的增加,GT28 和ROC22 的节间锤 度整体上都呈逐渐增加的趋势(图 1)。在相同节间, GT28 节间锤度都高于ROC22 中,且达到显著差异 水平。GT28 和ROC22 上部节间(+6-+16)平均锤 度/ 下部节间(+21-+31)平均锤度比值分别为0.94 和0.95,说明两个品种都已达到工艺成熟期。 溶性总糖含量均达到极显著差异水平(图 2-A)。在 GT28 中,从+1 叶到+31 节间蔗糖含量逐渐增加趋 势,蔗糖含量在+31 节达到最大。而在ROC22 中节 间蔗糖含量整体上也呈现出逐渐增加的趋势,但在 +21 节和+31 节蔗糖含量有所降低(图 2-B)。在2 个品种的相同节间,GT28 中可溶性总糖和蔗糖含量 都显著大于ROC22 中的蔗糖含量,这可能与GT28 比ROC22 品种早熟有关,而在+1 叶中可溶性总糖 和蔗糖含量在两个品种间均无明显差异。
|
| 图 1 甘蔗不同节间锤度分析 |
|
| 图 2 工艺成熟期甘蔗+1 叶和不同节间可溶性糖(A)及蔗糖(B)含量变化 |

|
| 图 3 工艺成熟期甘蔗+1 叶和不同节间SS 合成方向酶活性分析 |
在甘蔗工艺成熟期,GT28 和ROC22 从+1 叶 到+31 节可溶性总糖含量整体上呈现出逐渐增加的 趋势,其中+1 叶、+1 节间和+6-+31 节间之间,可溶性总糖含量均达到极显著差异水平(图 2-A)。在 GT28 中,从+1 叶到+31 节间蔗糖含量逐渐增加趋 势,蔗糖含量在+31 节达到最大。而在ROC22 中节 间蔗糖含量整体上也呈现出逐渐增加的趋势,但在 +21 节和+31 节蔗糖含量有所降低(图 2-B)。在2 个品种的相同节间,GT28 中可溶性总糖和蔗糖含量 都显著大于ROC22 中的蔗糖含量,这可能与GT28 比ROC22 品种早熟有关,而在+1 叶中可溶性总糖 和蔗糖含量在两个品种间均无明显差异。
2.3 SS合成方向酶活性变化分析在甘蔗工艺成熟期,ROC22 中+1 叶和节间SS 合成方向酶活性都显著高于GT28 相同部位酶活性 (图 3)。2 个品种+1 叶中SS 合成方向酶活性都极显 著大于节间SS 合成方向酶活性。从+1 叶到+31 节间, 节间SS 合成方向酶活性在两个品种间整体上都呈现 出逐渐降低的趋势。
2.4 SS分解方向酶活性变化分析在甘蔗工艺成熟期,2 个品种中SS 分解方向酶 活性在+1 叶中的酶活性都极显著差异于节间中的酶活性(图 4)。在ROC22 中,+1 叶中SS 分解方向酶 活性显著大于GT28 中的酶活性。从+1 节间到+31 节间,ROC22 中SS 分解方向酶活性表现为逐渐降 低的趋势,除了+1 节间SS 分解方向酶活性显著高 于GT28 中的酶活性外,其余节间SS 分解方向酶活 性均低于GT28 中的酶活性。

|
| 图 4 工艺成熟期甘蔗+1 叶和不同节间SS 分解方向酶活性分析 |
在甘蔗工艺成熟期,GT28 的+1 叶和不同节间 中SPS 酶活性都高于ROC22 相同部位的SPS 酶活性, 其中除了+11 节间外,酶活性均达到显著水平(图 5)。 2 个品种+1 叶中SPS 酶活性都高于节间中的酶活性。 2 个品种节间SPS 酶活性整体上呈逐渐升高的趋势。 在GT28 中,SPS 酶活性逐渐升高,在+31 节间达到 最大,其中+1 节间、+6-+11 节间、+16-+21 节间和+26-+31 节间之间,SPS 酶活性差异都达到极显 著水平,而在ROC22 不同节间酶活性也表现出相同 趋势。这说明蔗茎从上部到下部节间SPS 酶活性呈 现梯度差异,而成熟节间SPS 酶活性提高,有利于 高浓度的蔗糖积累。

|
| 图 5 工艺成熟期甘蔗+1 叶和不同节间SPS 酶活性分析 |
在蔗茎中,GT28 和ROC22 节间锤度、可溶性 总糖和蔗糖含量之间都呈极显著正相关(表 1)。2 个品种SPS 酶活性与节间锤度、可溶性总糖和蔗糖 含量也呈显著正相关。ROC22 中SS 合成方向酶活 与节间锤度、可溶性总糖和蔗糖含量呈极显著负相 关,而在GT28 中除节间可溶性总糖没有达到显著 负相关外,节间锤度和蔗糖含量均达到显著负相关。 SS 分解方向酶活性,在GT28 中与节间锤度、可溶 性总糖和蔗糖含量呈正向关,但未达到显著水平, 而在ROC22 中,SS 分解方向酶活性与节间锤度、 可溶性总糖和蔗糖含量均达到极显著负相关。而节 间SS 合成方向和分解方向酶活性均与SPS 酶活性呈 显著负相关。
在甘蔗工艺成熟期,GT28 和ROC22 +1 功能叶 中SPS、SS 合成和分解方向酶活性都高于茎中,且 维持较高水平,说明此时+1 叶片代谢仍然活跃,为 蔗茎糖分不断积累提供物质基础。甘蔗+1 叶中可 溶性总糖和蔗糖含量,都极显著低于节间中的含量。 而蔗糖由“源”叶中运输到甘蔗茎中,主要是受蔗 茎细胞中蔗糖代谢相关酶的活性和蔗糖的跨膜运输 能力调节,而不是作为源叶中输出光合产物的能力和韧皮部运输蔗糖的效率调节[2, 13]。 糖信号不仅能维持库器官的生长,也是调节源 库代谢的信号分子。通过对库器官蔗糖代谢相关酶 活性的调节,进而影响库器官中糖分的积累[14]。在 甘蔗早熟品种GT28 节间中SS 合成方向酶活性都显 著低于早中熟ROC22 中的酶活性,而其节间蔗糖含 量高于ROC22 中的蔗糖含量,说明早熟品种随着蔗 茎的成熟,节间蔗糖含量增加,从而抑制SS 合成方 向酶活性。而晚熟品种由于蔗糖含量低,SS 合成方 向酶活性仍然保持较高水平。相关性分析表明,2 个甘蔗品种节间锤度、可溶性总糖和蔗糖含量都与 SS 合成方向酶活性呈显著的负相关。这与Botha 和 Black[15]研究结果是一致的。
在甘蔗不同发育时期,4 个甘蔗品种未成熟 茎中SS 合成方向酶活性都高于成熟茎中的酶活 性,蔗糖含量是调节SS 合成方向酶活性的重要因 子[16]。在GT28 中,+6-+31 节间SS 分解方向酶活 性高于ROC22 中的酶活性,说明随着节间成熟蔗 糖含量到达一定程度,可能会抑制SS 合成方向酶 活性,而SS 分解方向酶活性被激活。相关性分析 表明,ROC22 中SS 分解方向的酶活性与节间锤度、 可溶性总糖和蔗糖含量都达到极显著的负相关,而 在GT28 中呈正相关(未达到显著水平),进一步说 明节间SS 分解方向酶活性可能受节间蔗糖含量的调 节。目前已经从甘蔗叶中分离到A、B 和C 三种SS 酶类[17],Schäfer[12]研究表明甘蔗未成熟节间和成 熟节间可能存在两种不同的SS 酶类,但它们如何在 蔗茎蔗糖积累中发挥作用尚不清楚。
甘蔗茎中SPS 酶活性与蔗糖的积累呈正相 关[11, 18]。在工艺成熟期,2 个甘蔗品种SPS 酶活性 与节间锤度、可溶性总糖和蔗糖含量都呈正相关, 且早熟高糖品种GT28 中节间蔗糖含量和节间SPS 酶活性都显著高于ROC22 相同节间蔗含量和SPS 酶 活性,这说明SPS 酶活性不仅与节间蔗糖积累密切 相关,而且与甘蔗的成熟度有关。陈兰平等[19]的 研究也表明,随着蔗茎的成熟,SPS 家族基因(Ⅰ、 Ⅱ、Ⅲ、Ⅳ和Ⅴ)在高糖品种中的优势表达基因减少, 而低糖品种中的优势表达基因增加,可能与低糖品 种后期大量积累蔗糖有关。
转化酶活性的降低、SPS 酶活性的增加以及蔗 糖合成酶分解活性的下降和合成活性的增加,是引 起甜瓜果实蔗糖积累的主要内在因子[20]。大豆籽粒 中的蔗糖含量并非受某一种酶绝对调控,SPS 活性 与SS+AI+NI 活性总和之差与籽粒中蔗糖的积累显著 正相关[21],说明库器官中糖分的积累过程是蔗糖合 成和分解酶类共同协作进行调节的,而不是某类酶 在单独发挥作用[22]。本课题组前期研究结果表明, 在甘蔗工艺成熟期节间蔗糖含量与节间SAI 酶活性 呈显著负相关,与CIN 酶活性呈显著正相关,转化 酶抑制子基因在调节转化酶活性中发挥重要作用。 这也说明甘蔗节间蔗糖积累,可能是蔗糖代谢相关 酶共同调节而进行蔗糖积累的。因此研究甘蔗茎中 锤度、可溶性糖含量和蔗糖含量及其与相关酶活性 的变化,可为进一步研究甘蔗SS、SPS 表达调控机 理,提高甘蔗茎的含糖量,培育品质优异的甘蔗新 品种提供参考。
4 结论甘蔗节间SPS 酶活性与锤度、可溶性总糖和蔗 糖含量呈显著正相关,且早熟高糖品种GT28 中SPS 的酶活性高于早中熟品种ROC22。节间SS 合成方 向酶活性与节间锤度和蔗糖含量都呈显著负相关,GT28 节间酶活性比ROC22 中的低。而节间锤度、 可溶性糖和蔗糖含量与ROC22 中SS 分解方向酶活 性呈显著的负相关,而与GT28 中SS 分解方向酶活 性呈正相关,未达到显著水平。这说明节间SPS 和 SS 合成方向酶活性提高有利于蔗糖积累,而随着节 间成熟,蔗糖含量可能是促使SS 合成酶由合成活性 向分解活性转化的一个重要调节因子。
| [1] | 李杨瑞, 杨丽涛. 20 世纪90 年代以来我国甘蔗产业和科技的新发展[J]. 西南农业报, 2009, 22(5):1469-1475. |
| [2] | 赵丽宏, 王俊刚, 杨本鹏, 等. 甘蔗体内的蔗糖积累[J]. 基因组学与应用生物学, 2009, 28(2):385-390. |
| [3] | Sturm A. Invertases :Primary structures, functions and roles in plantdevelopment and sucrose partitioning[J]. Plant Physiol, 1999, l21(1):l-8. |
| [4] | Winter H, Huber SC. Regulation of sucrose metabolism in higherplants :localization and regulation of activity of key enzymes[J].Critical Reviews in Biochemistry and Molecular Biology, 2000, 35(4):253-289. |
| [5] | 卢合全, 沈法富, 刘凌霄, 等. 植物蔗糖合成酶功能与分子生物学研究进展[J]. 农业生物技术科学, 2005, 21(7):34-37. |
| [6] | Castleden K, Naohiro A, Gillespie VJ, et al. Evolution and functionof the sucrose-phosphate synthase gene families in wheat and othergrasses[J]. Plant Physiol, 2004, 135(3):1753-1764. |
| [7] | Grof CPL, Albertson PL, Bursle J, et al. Sucrose-phosphatesynthase, a biochemical marker of high sucrose accumulation insugarcane[J]. Crop Science, 2007, 47(4):1530-1539. |
| [8] | Ishimaru K, Ono J, Kashiwagi T. Identification of a new genecontrolling plant height in rice using the candidate-genestrategy[J]. Planta, 2004, 218 :388-395. |
| [9] | 刘洪博, 陆鑫, 毛钧, 等. 甘蔗蔗糖磷酸合成酶研究进展[J].湖南农业大学学报, 2013, 39(1):31-36. |
| [10] | Rae AL, Perroux JM, Grof CP. Sucrose partitioning betweenvascular bundles and storage parenchyma in the sugarcane stem :a potential role for the ShSUT1 sucrose transporter[J]. Planta,2005, 6 :817-825. |
| [11] | Gutiérrez-Miceli FA, Rodriguez-Mendiola MA, Alejo NO, et al.Relationship between sucrose accumulation and activities ofsucrose-phosphatase, sucrose synthase, neutral invertase andsoluble acid invertase in micropropagated sugarcane plants[J].Acta Physiologiae Plantarum, 2002, 24(4):441-446. |
| [12] | Schäfer WE, Rohwer JM, Botha FC. Protein-level expression andlocalization of sucrose synthase in the sugarcane culm[J].Physiologia Plantarum, 2004, 121 :187-195. |
| [13] | Uys L, Botha FC, Hofmeyr JH, et al. Kinetic model of sucroseaccumulation in maturing sugarcane culm tissue[J]. Phytochemistry,2007, 68(16-18):2375-2392. |
| [14] | McCormick AJ, Watt DA, Cramer MD. Supply and demand :sinkregulation of sugar accumulation in sugarcane[J]. Journal ofExperimental Botany, 2009, 60(2):357-364. |
| [15] | Botha FC, Black KG. Sucrose phosphate synthase and sucrosesynthase activity during maturation of intenodal tissue insugarcane[J]. Aust J Plant Physiol, 2000, 27 :81-85. |
| [16] | Verma AK, Upadhyay SK, Verma PC, et al. Functional analysis ofsucrose phosphate synthase(SPS)and sucrose synthase(SS)insugarcane(Saccharum)cultivars[J]. Plant Biology, 2011, 13 :325-332. |
| [17] | Schäfer WE, Rohwer JM, Botha FC. Partial purification andcharacterisation of sucrose synthase in sugarcane[J]. Journal ofPlant Physiology, 2005, 162 :11-20. |
| [18] | Pan YQ, Luo HL, Li YR. Soluble acid invertase and sucrosephosphate synthase :key enzymes in regulationg sucroseaccumulation in sugarcane stalk[J]. Sugar Tech, 2009, 11(1):28-33. |
| [19] | 陈兰平, 陈由强, 方静平, 等. 甘蔗SPS 基因家族成员表达与糖分积累关系解析[J]. 热带作物学报, 2014, 35(7):1354-1361. |
| [20] | 张明方, 李志凌, 陈昆松, 等. 网纹甜瓜发育果实糖分积累与蔗糖代谢参与酶的关系[J]. 植物生理与分子生物学学报,2003, 29(5):455-462. |
| [21] | 李彦生, 南海洋, 杜明, 等. 菜用大豆籽粒不同部位蔗糖积累及关键酶活性[J]. 作物学报, 2013, 39(11):2099-2105. |
| [22] | 李丹, 王晔, 赫磊, 等. 甜菜蔗糖代谢相关酶活性与糖积累关系的研究[J]. 作物杂志, 2009, 3 :27-31. |