糖类是生物能量的主要来源,糖代谢是生物新陈代谢物质代谢中的核心问题之一,它的合成与分解代谢关系到植物的形态建成、逆境胁迫应答等生命过程。磷酸甘油酸变位酶(Phosphoglyceratemutase,PGAM)是糖酵解和糖异生过程中的关键酶之一,它能够催化3-磷酸甘油酸(3-phosphoglycerate,3-PGA)和2-磷酸甘油酸(2-phosphoglycerate,2-PGA)之间的相互转化。1982 年Fothergill 等[1]首先在酵母中发现了PGAM,随着其氨基酸序列和晶体结构被揭示,人们在多种生物体中均发现了该蛋白,并根据其在催化反应中与辅因子2,3-二磷酸甘油酸(2,3-bisphosphoglycerate,2,3-BPG)的依赖关系,分为两种类型:辅因子依赖型PGAM(Cofactor-dependent PGAM,dPGAM)和辅因子非依赖型PGAM(Cofactor-independent PGAM,iPGAM)。前一种酶存在于所有的脊椎动物、大部分无脊椎动物、某些真菌和细菌,尤其是革兰氏阴性菌中,其在酶催化反应时需要2,3-BPG 作为辅因子;后一种酶存在于所有植物、一些无脊椎动物、某些真菌和细菌,尤其是革兰氏阳性菌中[2],其在酶催化反应时不需要2,3-BPG 作为辅因子[3]。根据其氨基酸的序列分析显示,dPGAM 属于酸性磷酸酶家族,而iPGAMs 属于碱性磷酸酶超家族。尽管iPGAMs 属于碱性磷酸酶超家族,但它和碱性磷酸酶(Alkalinephosphatase,AP)的活性有着实质性的差异。碱性磷酸酶在蛋白保守区AP 上包含有典型的磷酸转移残基,具有磷酸转移活性;iPGAM 在蛋白保守区具有磷酸酶的活性残基,具有磷酸酶活性[4, 5, 6]。
在过去的几十年中,人们对于动物、真菌、细菌中的dPGAMs 研究较多,尤其对哺乳动物和人类dPGAMs 的蛋白结构、生化机理及其功能特性等已有比较深入的了解[7];与dPGAM 所不同的是,植物中广泛分布的iPGAMs,而在脊椎动物中没有发现。自从第一次从玉米中分离纯化到PGAM-i 后[8],人们开始关注植物中的iPGAMs。由于植物来源的iPGAMs 不稳定性导致其分离纯化困难,对其研究报道亦相对较少,目前对其功能研究尚处于初级阶段。结合近年对植物来源的iPGAMs 的相关报道,对其结构特点、作用机制和生物学功能(重点介绍了拟南芥、玉米及水稻)进行阐述。
1 iPGAM 蛋白的生化特性 1.1 结构特征蛋白晶体结构的分析结果显示iPGAM 具有典型的保守域。首个报道的iPGAM 结构是嗜热脂肪芽孢杆菌(Bacillus stearothermophilus)中的[3],它含有两个显著分离的结构域,分别具有磷酸酶和磷酸转移酶的活性。随后,在细菌、真菌及动物中都陆续有iPGAM 晶体结构解析,并证实了结构域的典型特征,但在植物来源的iPGAM 中,其成员的晶体结构未见研究报道。植物iPGAMs 相对于dPGAM,分子稍大,一般由约500 个氨基酸残基组成,以60 kD的单体形式存在,其一级结构较为保守。在iPGAMs的1-76 位和311-511 位的氨基酸残基形成磷酸酶的活性中心,该结构与碱性磷酸酶和硫酯酶结构相近,包含多个活性位点和两个金属离子结合位点(Pfam domain PF01676)[9],其中的金属离子结合位点是区别于dPGAM 的特有的结构域[10],且和碱性磷酸酶的金属离子结合位点序列一致性很低。102-332位是属于2,3-BPG 不依赖区域(Pfam domain,PF0-6415),包含一个保守的磷酸化位点丝氨酸残基[9](图 1)。77-310 位氨基酸残基区域形成磷酸转移酶区,但与细菌iPGAMs 蛋白一级结构中氨基酸序列存在差异,这也体现了生物进化过程中蛋白分子的进化过程。
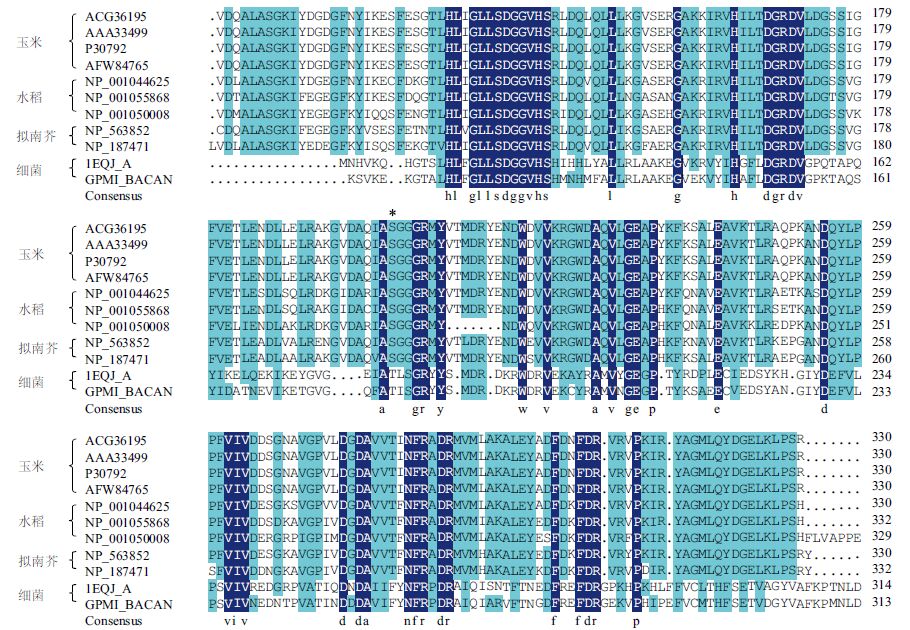
|
| 阴影表示氨基酸的相似度,颜色越深相似度越高;“*”表示植物中较为保守的磷酸化丝氨酸残基位点;在拟南芥、水稻和玉米的iPGAMs 100-330 氨基酸残基位点之间具有保守的2,3-BPGA 不依赖的区域(Pfam domain PF06415) 图 1 iPGAMs 中的2,3-BPGA 不依赖的区域(Pfam domain PF06415) |
磷酸甘油酸变位酶iPGAMs 的活性受金属离子的影响。较早的研究结果显示,细菌中的iPGAMs是金属离子依赖的酶,可以结合Mg2+[11]、Mn2+[12],Ni2+ 或Co2+ 等二价阳离子[13],且每个酶分子可以结合两个金属离子[14]。而植物中的iPGAMs 是否需要金属离子来保持活性,这在当时一直存在争议。起初报道的小麦胚芽中的iPGAM 受EGTA 抑制[15, 16],其活性的恢复需要Mn2+ 和Co2+[17]。与这一结果相反,蓖麻种子中的iPGAM 活性不受金属离子影响[18]。迄今为止,还未有报道在反应体系中把金属离子完全去除来检测酶活性。鉴于植物和细菌中iPGAM 序列的高度相似性,推测植物中的iPGAMs 也属于金属离子依赖的酶[11]。现今的研究报道中,直接称植物中的iPGAMs 为金属酶。
1.3 催化机理iPGAM 催化反应不需要2,3-BPG 作为辅因子,其酶的活性位点是丝氨酸。底物直接与丝氨酸结合并使该位点磷酸化形成酶-底物中间体,然后通过这个磷酸丝氨酸中间体来催化磷酸基团在磷酸甘油酸分子内的转移[19]。其中2-磷酸甘油酸第2个碳所结合的磷酸根来自变位酶iPGAM,而后第3 个碳的磷酸根再结合到iPGAM 上。可见,磷酸基团并非从3 号碳原子直接转移到2 号碳原子上(图 2)。

|
| 图 2iPGAM 催化反应机理 |
在高等植物的研究报道中,对拟南芥的iPGAMs研究较多。早在2003 年,TAIR(http ://www.arabidopsis.org/)网站将At1g09780、At1g22170 和At3g08-590 定名为PGAMs,KEGG(http ://www.genome.jp/kegg/)网站公布了4 个PGAMs :At1g09780、At3g-50520、At3g08590 和At5g04120。同年,Mazarei 等[20]研究发现拟南芥中存在5 个PGAMs :At1g58280、At2g17280、At3g50520、At5g04120 和At5g64460[21],较早报道的这些成员中既包含iPGAM 也包含dPGAM。后续的研究中,拟南芥PGAM 家族成员逐渐增多,同时也将发现的蛋白进行了细致的鉴别[10, 22]。截至目前,文献信息报道及网站信息显示拟南芥中的iPGAMs 成员共计21 个,其中两个被正式命名为iPGAM1(At1g09780)和iPGAM2(At3g08590),并证实二者具有磷酸甘油酸变位酶活性;另外,人们推测还有两个成员At4g09520 和At3g30841 具有磷酸甘油酸变位酶活性[23]。其余一些成员是否具有磷酸甘油酸变位酶的活性,尚待进一步检测验证。玉米和水稻的iPGAMs 家族成员报道相对较少。玉米中的一些家族成员已经被克隆,第一个报道的玉米iPGAM 成员是PGAM-i,通过筛选cDNA 表达文库获得了该成员的cDNA 序列,经序列比对发现PGAM-i 与小麦胚芽、蘑菇、蜘蛛中的iPGAMs 成员序列相似性很低[24]。两年之后,又成功克隆了玉米PGAM-i 的基因组序列[25]。目前通过NCBI(http ://www.ncbi.nlm.nih.gov/)信息查询,注释为玉米iPGAM 的蛋白共9 个。而Gramene(http ://ensembl.gramene.org/genome_browser/index.html)信息显示,编码玉米iPGAM 的基因存在多个转录本,同时发现多个基因可能转录生成一种蛋白产物。由于真核生物中基因发生可变剪切的比例较高,至于玉米的iPGAMs 基因在何种情况下转录翻译成有功能的iPGAMs 蛋白,我们不得而知。除去NCBI 中注释的9 个蛋白成员,与AtiPGAM1 蛋白序列相似性较高的成员(>70%)有7 个,关于这些成员的深入研究还未见报道。水稻数据库中标注为iPGAM 的蛋白共3 个,这些蛋白的功能还未知,活性也未曾被验证。与AtiPGAM1、AtiPGAM2 蛋白序列相似性较高(>70%)的成员共6 个,经结构域分析,这些蛋白都具有BPG-非依赖的结构域,推测这些蛋白成员可能属于水稻的iPGAM 家族。
其他植物如巴旦杏[9]、烟草、蓖麻[26]及橡胶树[27]中都克隆了iPGAMs 的cDNA 序列,在草菇[28]、欧洲油菜[29]、大青杨[30]等植物中也发现了iPGAMs。
2.2 iPGAMs家族的进化蛋白质演变是生物进化的体现之一,其中iPGAMs 家族在真核生物中衍化出很多成员,或许各个成员之间功能已有了精细差异。Stechmann 等[31]对真核生物、真菌和古细菌的iPGAMs 蛋白序列中的394 个氨基酸位点进行比对获得了系统进化树,结果表明iPGAMs 与很多生物的侧向基团转移有关。为了分析不同植物物种中iPGAMs 家族成员的进化关系,将已知的水稻、玉米、拟南芥的iPGAMs 成员与最早报道的嗜热脂肪芽孢杆菌中的iPGAMs 一起进行系统发育树构建,结果印证了上述观点,同种来源的iPGAMs 未必包括在同一个亚群中,如拟南芥的At3g30841(NP_850651)和At4g09520(NP_192690)与细菌的蛋白序列相似性较高,而已报道的在保卫细胞中发挥功能的At3g08590(NP_187471)和At1g09780(NP_563852)与细菌的序列相似性较低,它们分别位于不同的亚群。玉米和水稻的iPGAMs 蛋白表现出与拟南芥已知功能iPGAMs :At3g08590(NP_187471)和At1g09780(NP_563852)的序列相似性较高,位于一个亚群(图 3),推测这些成员的功能可能较为相近。
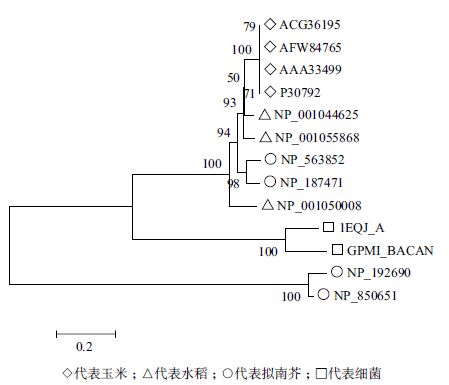
|
| 图 3 不同物种iPGAMs 系统进化树 |
iPGAMs 分布于多种器官组织。在正常情况 下,拟南芥AtPGAM 特异性分布于茎尖和根尖分生 组织;囊包线虫侵染后,在入侵部位的合胞体中磷 酸甘油酸变位酶活性显著增强,并且根部组织也有 明显AtPGAM 表达活性。另外,分布在分生组织的 AtPGM 受多种刺激调控,表明AtPGM 与分生组织功能及细胞周期活动有关[20]。免疫金标结果显示麝香百合中的iPGAM(与玉米中的iPGAM 同源性较高)在根尖和花柱传递细胞中表达量很高,推测这可能 与这部分细胞的代谢活动旺盛相关[32]。
研究发现iPGAMs 定位于多种细胞器。糖酵解 的发生部位是细胞质,因此通常认为参与糖酵解途 径的酶定位于细胞质,而检测结果与这一观点存在 差异。通过对拟南芥线粒体蛋白质组学分析发现, 糖酵解途径中的10 个酶中有7 个也在线粒体中存在, AtiPGAM1(At1g09780)便是其中之一,该酶定位 于线粒体外膜和膜间隙[33]。糖酵解代谢的产物——丙酮酸的重要去路就是进入线粒体基质,参与三羧 酸循环为机体产生能量。糖酵解过程中的酶定位在 线粒体,推测这将有助于丙酮酸用于线粒体中的进一步代谢。除线粒体之外,也有定位于其他细胞器 的iPGAMs,Wang 等[32]通过免疫金标技术观察到麝香百合iPGAMs 在根的顶端分生组织中定位于细 胞质、质体及细胞核中。iPGAM 定位于多个细胞器 预示着iPGAMs 可能在细胞中发挥多种功能。
4 iPGAMs 的生物学功能植物iPGAMs 参与多种生长发育过程,如气孔 运动、花粉形成及营养生长等。在拟南芥气孔中 表达的两个基因iPGAM1(At1g09780)和iPGAM2 (At3g08590)[34],具有90% 的蛋白序列相似性,其双突变体在黑暗条件下低浓度CO2 诱导的气孔开放和蓝光促使的气孔开放过程中表现出极为敏感的表型,这一实验结果首次提供了遗传学方面的实验证 据,表明糖酵解过程中的酶(iPGAMs)在气孔响应 环境信号过程中发挥重要作用。另外,两个单突变 体在酶活性上没有差异,表型与野生型也没有差别。 而双突变体没有检测到iPGAM 的酶活性,其营养生 长和生殖生长都受到严重影响,表明糖酵解代谢过 程中的两个酶iPGAM1 和iPGAM2 是能量代谢或者 代谢物提供途径的重要组分[23],且两个成员之间存 在着功能冗余。拟南芥非磷酸化的3-磷酸甘油醛脱 氢酶(NP-GAPDH)在植物生长和发育过程中发挥 重要作用,其缺失后表现为第三、四个花蕾不能自 花授粉,经检测编号为At3g30841 的iPGAM 基因表 达量明显下降,预示着糖酵解过程受到了抑制[35], 使开花受精所需的能量供应不足,表明At3g30841 基因在花粉授粉过程中的能量代谢方面发挥着重要 功能。
在非生物胁迫响应过程中iPGAMs 发挥着重要 功能。如拟南芥中的AtiPGAM1(At1g09780),不仅 在生长发育过程中起作用,而且参与了响应非生物 胁迫的过程。在拟南芥受低温胁迫时,AtiPGAM1 表 达量明显增高[36],预示AtiPGAM1 在植物响应冷胁迫过程中起正调节因子的作用。但也有一些iPGAM 起负调节作用,如耐冷性较强的水稻赤霉素不敏感 突变体gid1(Gibberellin-insensitive dwarf1),其悬浮细胞中iPGAM(Accession No. BAB64833)的表达量 降低[37];在水稻花药三核期响应冷胁迫时iPGAM 呈现部分降解[37, 38],暗示水稻的iPGAM(Accession No. BAB64833)是水稻响应冷胁迫的负调节因子。
生物胁迫过程中也有iPGAM 成员的参与。在卷 心菜曲叶病毒(Cabbage leaf curl virus,CaLCuV)侵 染拟南芥12 d 时,上位叶片表现出小、狭窄和卷曲 等症状;芯片结果显示iPGAM 成员At5g64460 表达 量下降[21],推测这一基因可能在病毒侵染过程参与了叶片的形态建成。
5 展望从最初对iPGAMs 的酶活性检测,到现阶段对 家族成员的挖掘以及功能的分析验证,经过几十年 的不断研究,人们对于植物中的iPGAMs 有了一定 的认识,但仍有很多问题需要去探究。植物中各物 种iPGAM 家族成员鉴定还不完全;与已知iPGAM 成员氨基酸序列相似性较高的成员是否属于iPGAM 家族;对于已报道的多数拟南芥的家族成员,还不 清楚它们是否具有磷酸甘油酸变位酶活性;如果没 有变位酶的活性,是否作为另外一种酶发挥其功 能;至今对于植物中磷酸甘油酸变位酶的功能知之 甚少,作为催化基础代谢过程中不可或缺的一类酶, iPGAMs 参与了植物生命中的哪些生理过程,以及 iPGAMs 参与生理过程的分子机制是什么。随着各种 生物技术的日臻成熟与完善,后续研究中更多植物 的iPGAMs 将会被关注,相信以上科学问题会被科 研工作者逐一揭示。
| [1] | Fothergill LA, Harkins RN. The amino acid sequence of yeast phosphoglycerate mutase[J]. Proc R Soc Lond B Biol Sci, 1982, 215(1198): 19-44. |
| [2] | Jedrzejas MJ. Structure, function, and evolution of phosphoglycerate mutases : comparison with fructose-2, 6-bisphosphatase, acid phosphatase, and alkaline phosphatase[J]. Prog Biophys Mol Biol, 2000, 73(2-4): 263-287. |
| [3] | Fothergill-Gilmore LA, Watson HC. The phosphoglycerate mutases[J]. Adv Enzymol Relat Areas Mol Biol, 1989, 62 : 227- 313. |
| [4] | Breathnach R, Knowles JR. Phosphoglycerate mutase from wheat germ : studies with 18O-labeled substrate, investigations of thephosphatase and phosphoryl transfer activities, and evidence for a phosphoryl-enzyme intermediate[J]. Biochemistry, 1977, 16(14): 3054-3060. |
| [5] | Bond CS, Clements PR, Ashby SJ, et al. Structure of a human lysosomal sulfatase[J]. Structure, 1997, 5(2): 277-289. |
| [6] | Lukatela G, Krauss N, Theis K, et al. Crystal structure of human arylsulfatase A : the aldehyde function and the metal ion at the active site suggest a novel mechanism for sulfate ester hydrolysis[J]. Biochemistry, 1998, 37(11): 3654-3664. |
| [7] | Wang Y, Wei Z, Bian Q, et al. Crystal structure of human bisphosphoglycerate mutase[J]. J Biol Chem, 2004, 279(37): 39132-39138. |
| [8] | Gra?a X, Ure?a J, Ludevid D, et al. Purification, characterization and immunological properties of 2, 3-bisphosphoglycerate-independent phosphoglycerate mutase from maize(Zea mays)seeds[J]. Eur J Biochem, 1989, 186(1-2): 149-153. |
| [9] | Gra?a X, Pérez de la Ossa P, Broce?o C, et al. 2, 3-Bisphosphoglycerate- independent phosphoglycerate mutase is conserved among different phylogenic kingdoms[J]. Comp Biochem Physiol B Biochem Mol Biol, 1995, 112(2): 287-293. |
| [10] | Andriotis VM, Kruger NJ, Pike MJ, et al. Plastidial glycolysis in developing Arabidopsis embryos[J]. New Phytol, 2010, 185(3): 649-662. |
| [11] | Galperin MY, Bairoch A, Koonin EV. A superfamily of metalloenzymes unifies phosphopentomutase and cofactorindependent phosphoglycerate mutase with alkaline phosphatases and sulfatases[J]. Protein Sci, 1998, 7(8): 1829-1835. |
| [12] | Singh RP, Setlow P. Purification and properties of phosphoglycerate phosphomutase from spores and cells of Bacillus megaterium[J]. J Bacteriol, 1979, 137(2): 1024-1027. |
| [13] | Hammer-Jespersen K, Munch-Petersen A. Phosphodeoxyribomutase from Escherichia coli. purification and some properties[J]. Eur J Biochem, 1970, 17(3): 397-407. |
| [14] | Kuhn NJ, Setlow B, Setlow P, et al. Cooperative manganese(II) activation of 3-phosphoglycerate mutase of Bacillus megaterium : a biological pH-sensing mechanism in bacterial spore formation and germination[J]. Arch Biochem Biophys, 1995, 320(1): 35- 42. |
| [15] | Leadlay PF, Breathnach R, Gatehouse JA, et al. Phosphoglycerate mutase from wheat germ : studies with isotopically labeled 3-phospho-D-glycerates showing that the catalyzed reaction is intramolecular. Appendix : phosphoglycerate mutase from wheat germ : isolation, crystallization, and properties[J]. Biochemistry, 1977, 16(14): 3045-3053. |
| [16] | Smith GC, Hass LF. Wheat germ phosphoglycerate mutase : purification, polymorphism, and inhibition[J]. Biochem Biophys Res Commun, 1985, 131(2): 743-749. |
| [17] | Smith GC, McWilliams AD, Hass LF. Wheat germ phosphoglycerate mutase : evidence for a metalloenzyme[J]. Biochem Biophys Res Commun, 1986, 136(1): 336-340. |
| [18] | Botha FC, Dennis DT. Isozymes of phosphoglyceromutase from the developing endosperm of Ricinus communis : isolation and kinetic properties[J]. Arch Biochem Biophys, 1986, 245(1): 96-103. |
| [19] | Jedrzejas MJ, Chander M, Setlow P, et al. Mechanism of catalysis of the cofactor-independent phosphoglycerate mutase from Bacillus stearothermophilus. Crystal structure of the complex with 2-phosphoglycerate[J]. J Biol Chem, 2000, 275(30): 23146- 23153. |
| [20] | Mazarei M, Lennon KA, Puthoff DP, et al. Expression of an Arabidopsis phosphoglycerate mutase homologue is localized to apical meristems, regulated by hormones, and induced by sedentary plant-parasitic nematodes[J]. Plant Mol Biol, 2003, 53(4): 513-530. |
| [21] | Ascencio-Ibá?ez JT, Sozzani R, Lee TJ, et al. Global analysis of Arabidopsis gene expression uncovers a complex array of changes impacting pathogen response and cell cycle during geminivirus infection[J]. Plant Physiol, 2008, 148(1): 436-454. |
| [22] | Stein M, Gabdoulline RR, Wade RC. Cross-species analysis of the glycolytic pathway by comparison of molecular interaction fields[J]. Mol Biosyst, 2010, 6(1): 152-164. |
| [23] | Zhao Z, Assmann SM. The glycolytic enzyme, phosphoglycerate mutase, has critical roles in stomatal movement, vegetative growth, and pollen production in Arabidopsis thaliana[J]. J Exp Bot, 2011, 62(14): 5179-5189. |
| [24] | Gra?a X, de Lecea L, el-Maghrabi MR, et al. Cloning and sequencing of a cDNA encoding 2, 3-bisphosphoglycerateindependent phosphoglycerate mutase from maize. Possible relationship to the alkaline phosphatase family[J]. J Biol Chem, 1992, 267(18): 12797-12803. |
| [25] | Pérez de la Ossa P, Grana X, Ruiz-Lozano P, et al. Isolation and characterization of cofactor-independent phosphoglycerate mutase gene from maize[J]. Biochem Biophys Res Commun, 1994, 203 (2): 1204-1209. |
| [26] | Huang Y, Blakeley SD, McAleese SM, et al. Higher-plant cofactorindependent phosphoglyceromutase : purification, molecular characterization and expression[J]. Plant Mol Biol, 1993, 23(5): 1039-1053. |
| [27] | 龙翔宇, 董绪浓, 方永军, 等. 橡胶树PGAM 基因的克隆及表 达特性分析[J]. 热带作物学报, 2013, 34(10): 1895-1901. |
| [28] | 刘朋虎, 邓优锦, 江玉姬, 等. 草菇PGAM 基因克隆、结构及 其在同核、异核菌株中的表达量分析[J]. 福建农业学报, 2012, 27(3): 252-256. |
| [29] | Hajduch M, Casteel JE, Hurrelmeyer KE, et al. Proteomic analysis of seed filling in Brassica napus. Developmental characterization of metabolic isozymes using high-resolution two-dimensional gel electrophoresis[J]. Plant Physiol, 2006, 141(1): 32-46. |
| [30] | 李春明, 白卉, 于文喜. 低温驯化过程中大青杨叶片差异蛋白 质分析[J]. 东北林业大学学报, 2011, 39(10): 45-49. |
| [31] | Stechmann A, Baumgartner M, Silberman JD, et al. The glycolytic pathway of trimastix pyriformis is an evolutionary mosaic[J]. BMC Evol Biol, 2006, 6(1): 101. |
| [32] | Wang JL, Walling LL, Jauh GY, et al. Lily cofactor-independent phosphoglycerate mutase : purification, partial sequencing, and immunolocalization[J]. Planta, 1996, 200(3): 343-352. |
| [33] | Giegé P, Heazlewood JL, Roessner-Tunali U, et al. Enzymes of glycolysis are functionally associated with the mitochondrion in Arabidopsis cells[J]. Plant Cell, 2003, 15(9): 2140-2151. |
| [34] | Zhao Z, Zhang W, Stanley BA, et al. Functional proteomics of Arabidopsis thaliana guard cells uncovers new stomatal signaling pathways[J]. Plant Cell, 2008, 20(12): 3210-3226. |
| [35] | Rius SP, Casati P, Iglesias AA, et al. Characterization of an Arabidopsis thaliana mutant lacking a cytosolic non-phosphorylating glyceraldehyde-3-phosphate dehydrogenase[J]. Plant Mol Biol, 2006, 61(6): 945-957. |
| [36] | Amme S, Matros A, Schlesier B, et al. Proteome analysis of cold stress response in Arabidopsis thaliana using DIGEtechnology [J]. J Exp Bot, 2006, 57(7): 1537-1546. |
| [37] | Tanaka N, Matsuoka M, Kitano H, et al. gid1, a gibberellininsensitive dwarf mutant, shows altered regulation of probenazoleinducible protein(PBZ1)in response to cold stress and pathogen attack[J]. Plant Cell Environ, 2006, 29(4): 619-631. |
| [38] | Imin N, Kerim T, Rolfe BG, et al. Effect of early cold stress on the maturation of rice anthers[J]. Proteomics, 2004, 4(7): 1873- 1882. |




