2. 河北省科学院生物研究所河北省主要农作物病害微生物控制工程技术研究中心,石家庄 050081;
3. 河南工业大学化学化工学院,郑州 450001
2. Biology Institute,Hebei Academy of Sciences,Hebei Engineering and Technology Center of Microbiological Control on Main Crop Disease,Shijiazhuang 050081;
3. School of Chemistry and Chemical Engineering,Henan University of Technology,Zhengzhou 450001
群体感应(quorum sensing,QS)信号是细菌自身诱导物,它广泛存在于革兰氏阳性菌和阴性菌中。群体感应信号通过调节特定基因表达进而调控细菌群体行为,这种调控需依赖菌体数量[1]。N-酰基高丝氨酸内酯(N-acyl-homoserine lactones,AHLs)是革兰氏阴性菌分泌的一类自身诱导物,其具有一个保守的高丝氨酸内酯环和一个长度在4-18个碳原子的酰基侧链。侧链含4-8个碳原子的AHLs为短链AHLs;含10-18个碳原子的为长链AHLs。酰基侧链的长度、饱和度及C3位的取代基决定着AHLs在菌群通讯中的特异性[2, 3, 4, 5, 6]。例如,铜绿色假单胞菌(Pseudomonas aeruginosa)中存在两套完整的QS系统,它可产生N-丁酰基高丝氨酸内酯(C4-HSL)和N-3-羰基十二酰基高丝氨酸内酯(3OC12-HSL)[7]。AHLs有两种构型,L型AHLs具有较强的生物学活性,D型AHLs活性较低[8]。对大麦和西印度地薯的研究发现L型AHLs被较多的利用[9]。
AHLs能被真核生物识别,从而影响真核细胞的基因表达、信号转导等[10]。植物可感知根际菌分泌到土壤中的AHLs已经得到广泛研究。共生细菌和腐生细菌产生的AHLs可引起蒺藜苜蓿体内150种蛋白改变,表明植物能感知AHLs[11]。本实验室证实N-3-羰基辛酰基高丝氨酸内酯(3OC8-HSL)能广泛引起拟南芥体内蛋白的变化,发现53个变化明显的蛋白点,其中2/3上调。经质谱分析发现这些蛋白参与多种生理过程,例如,糖代谢、能量代谢、防卫反应、信号转导和细胞骨架重构等[12]。
不同的AHLs可引起植物不同的生理反应。本实验室研究表明,中短链AHLs能显著促进拟南芥(Col-0)主根生长,如C4-HSL、N-己酰基高丝氨酸内酯(C6-HSL)、N-3-羰基己酰基高丝氨酸内酯(3OC6-HSL)和3OC8-HSL,而长链AHLs对主根有明显抑制作用,如N-十二酰基高丝氨酸内酯(C12-HSL)和N-十四酰基高丝氨酸内酯(C14-HSL)[13]。但N-癸酰基高丝氨酸内酯(C10-HSL)、C12-HSL能促进根毛发育,低浓度C10-HSL促进根细胞的分裂与分化,高浓度C10-HSL促进根毛和侧根形成,而且C10-HSL对根系结构的调节作用与生长素相似,但它对主根、侧根的调节作用并不依赖生长素信号途径[14]。长链AHLs可增加植物在逆境胁迫中的抗性,特别是抗病方面。N-3-羰基十四酰基高丝氨酸内酯(3OC14-HSL)预处理拟南芥后,再用flg22侵染拟南芥发现60 min后MPK3和MPK6依然处于活化状态,植物防卫相关基因WRKY22和WRKY29以及PR1表达明显增强[15]。但是,植物如何识别、接受及转导AHLs的分子机制尚不清楚。
G蛋白偶联受体(GPCRs)在细胞信号转导过程中发挥重要作用。本实验室证实拟南芥中GCR1和G蛋白α亚基(GPA1)参与植物感应3OC6-HSL和3OC8-HSL的过程[13]。此外,Cand2(At3g05010)和Cand7(At5g18520)是拟南芥中待定的GPCRs,经酵母双杂交证实二者可与GPA1结合[16]。本实验室证实二者也参与植物感应3OC6-HSL和3OC8-HSL的过程,表明GPCRs可能在植物感应AHLs过程中发挥重要作用[17]。GCR2(At1g52920)是近年来深入研究的GPCRs。研究表明GCR2是拟南芥细胞膜上脱落酸(ABA)的受体,当GCR2结合ABA后,GPA1可解离。gcr2种子不能进入休眠状态,并对ABA抑制种子萌发和幼苗生长的作用不敏感,表明GCR2调控ABA介导的信号通路[18]。然而,Johnston等[19]认为GCR2不是跨膜蛋白,也不是GPCRs。Ca2+是信号转导过程中细胞内重要的第二信使,本实验室证实C4-HSL和3OC8-HSL能升高拟南芥根细胞质中Ca2+离子浓度,而且增加的Ca2+来自胞外,表明这两种AHLs可能激活了细胞膜上的钙离子通道[20, 21]。依据之前的研究,本研究通过qRT-PCR和ELISA方法研究C4-HSL对GCR2基因转录和蛋白表达的影响;并利用微量热泳动(MST)技术[22, 23, 24]研究体外纯化的GCR2蛋白与C4-HSL的结合特征,旨为GCR2参与植物感应细菌QS信号——C4-HSL提供证据。 1 材料与方法 1.1 材料 1.1.1 拟南芥
野生型拟南芥(Col-0)由本实验室保存。 1.1.2 菌株与质粒
大肠杆菌DH5α和BL21及含pET28a质粒的BL21由本实验室保存,其感受态由本实验室制备。pMD18-T载体试剂盒购自TaKaRa公司。 1.1.3 主要试剂和材料
Ex Taq和rTaq DNA聚合酶、dNTP、T4 DNA连接酶、BamHⅠ和XhoⅠ限制性内切酶、RNAiso Plus、质粒提取、胶回收、反转录试剂盒购自TaKaRa公司;NTA-Ni2+-琼脂糖购自QIAGEN公司;自装填料柱购自Bio-Rad公司;咪唑购自MP Biomedicals公司;兔源His-tag一抗,偶联辣根过氧化物酶(HRP)山羊抗兔二抗购自Bioworld公司;兔源GCR2一抗由河北省科学院生物研究所细胞工程室制备;超滤离心管购自Millipore公司;N-丁酰基高丝氨酸内酯(N-Butyryl-DL-homoserine lactone)购自Sigma公司;Kit RED NHS染料试剂盒购自Nano Temper公司。引物由生工生物工程(上海)股份有限公司合成。克隆的GCR2片段送Life Technologies公司测序。 1.2 方法 1.2.1 qPCR分析C4-HSL调控拟南芥GCR2基因表达情况
选用Hoagland培养液培养3周龄的拟南芥幼苗,用10 μmol/L C4-HSL处理并取0、1、3、6、12和24 h样品。使用RNAiso Plus提取每份样品的总RNA并反转录成cDNA。qPCR反应体系为20 μL,包括5 μL稀释的cDNA、每条引物加0.4 μL,10 μL SYBR Premix Ex Taq。用Applied Biosystems公司7500 Real-Time PCR System进行检测。所用引物GCR2(F)5'-TGTATGTGCTCTTGGT GCTGT-3',GCR2(R)5'-TATTCCCGAGTTGTCTTCCTG-3';ACTIN(F)5'-CCAGAAGGATGCA TATGTTGGTGA-3',ACTIN(R)5'-GAGGAGCCTCGGTAAGAAGA-3'。两对引物Tm值为61℃。 1.2.2 C4-HSL调控拟南芥GCR2表达情况
样品处理与1.2.1相同。液氮研磨后每份样品加入1 mL含有pH7.5 40 mmol/L Tris/HCl、150 mmol/L NaCl、1 mmol/L EGTA、EDTA、PMSF和DTT、10 mmol/L NaF和β-甘油磷酸盐、20 mmol/L Na3VO4、0.5% NP-40和Triton-100、2 mg/mL Leupeptin、Pepstatin和Aprotitin的蛋白提取液,以提取样品总蛋白。待提取液融化后,将其吸入1.5 mL EP管中。4℃,14 000 r/min离心,15 min后取上清。上清经SDSPAGE检测,并用考马斯亮兰G-250法确定浓度。每份样品用包被液稀释至10 μg/mL。酶标板每孔加入100 μL样品,4℃过夜。然后每孔加入200 μL封闭液,37℃孵育1 h。洗板3次,用洗液将GCR2抗体稀释,每孔加入100 μL,37℃孵育45 min。洗板3次,每孔加入100 μL HRP标记二抗,37℃孵育30 min。洗板3次,每孔加入100 μL显色液,37℃孵育10 min,最后每孔加入50 μL终止液。用Thermo Multiskan GO全波长酶标仪在450 nm下检测。 1.2.3 GCR2片段克隆与原核表达载体构建
从拟南芥中克隆GCR2片段,上游引物5'-CGCGGATCCATGGGAGAACGGTTTTTCCG-3'(下划线为BamHⅠ酶切位点),下游引物5'-CCGCTCGAGGAGTTCATAACCTGGAAACAGAGCT-3'(下划线为XhoⅠ酶切位点)。Tm值为62℃,再将PCR产物切胶回收。得到GCR2片段与pMD18-T载体连接,转到DH5α大肠杆菌中并在含氨苄青霉素的LB固体培养基中进行蓝白斑筛选,挑取阳性菌落进行菌落PCR验证,并送测序。提取序列正确的DH5α大肠杆菌中18-T载体,用BamHⅠ和XhoⅠ将18-T载体中的GCR2片段切下,再与切开的pET28a载体连接。进行双酶切及测序鉴定,并将pET28a-GCR2转入BL21大肠杆菌中。 1.2.4 His-GCR2在大肠杆菌BL21中的诱导表达
挑GCR2单菌落,至含有1‰卡那霉素(100 mg/mL)的LB液体培养基,37℃摇床过夜。过夜菌液按2%接种到新培养基中。放入37℃摇床,当OD600至0.6-0.7之间时加入IPTG,其终浓度为0.5 mmol/L。随后放入28℃摇床5 h后收集菌体。8 000 r/min离心20 min,弃上清。以未加入IPTG的菌体为阴性对照,对诱导后的菌体进行SDS-PAGE检测。 1.2.5 His-GCR2的纯化与浓缩
用10 mmol/L咪唑缓冲液重悬菌体并用其平衡镍柱。超声破碎菌体。超声后,4℃ 8 000 r/min,离心20 min,取上清。将上清加入镍柱中,4℃进行柱结合2 h。用80 mmol/L咪唑缓冲液洗杂蛋白,共洗3次。用250 mmol/L咪唑缓冲液洗下目的蛋白,共洗5次。最后分别用250 mmol/L和10 mmol/L咪唑缓冲液清洗镍柱。用SDS-PAGE和Western blot对纯化出的His-GCR2进行检测。将第3-5次洗脱下来的GCR2,加到预冷的超滤离心管里。用3 500×g,4℃离心约40 min,用考马斯G-250法确定GCR2浓度达到0.6 mg/mL左右,将其吸出。用SDS-PAGE对浓缩后的GCR2进行检测。 1.2.6 体外结合试验
用Monolith.NT115微量热泳动生物分子互作分析仪对GCR2和C4-HSL的相互作用进行分析。反应体系为0.01 mol/L pH7.0 PBS。用Kit RED标记GCR2,在不同毛细管中其浓度一致。而C4-HSL经倍比稀释后与GCR2混合并用毛细管吸取反应体系。MST分析仪通过检测GCR2与不同浓度C4-HSL互作时荧光分子的热泳动变化来分析二者互作情况,并计算出解离常数(Kd)。以BSA作为阴性对照。 2 结果 2.1 C4-HSL调控拟南芥GCR2的表达情况
为研究GCR2是否参与拟南芥感应C4-HSL过程,先通过qRT-PCR检测GCR2响应C4-HSL表达情况(图 1)。C4-HSL处理1 h后GCR2出现明显上调,并在6 h达到最大值,随后在24 h降至与未处理时相近的水平,表明C4-HSL能增强GCR2的表达。
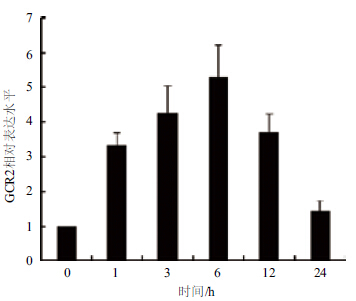 |
| 图 1 C4-HSL调控GCR2表达情况 |
为进一步确定GCR2是否紧密参与拟南芥感应C4-HSL过程,利用GCR2抗体检测其在拟南芥中的表达情况。经ELISA检测(图 2)发现GCR2的表达情况与GCR2的表达情况近似。C4-HSL处理后GCR2的表达量从0-6 h逐渐增加,6 h后GCR2的表达量是未处理时的3倍,且此时表达量最大。证明GCR2受C4-HSL调控。
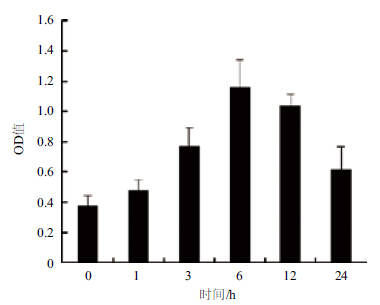 |
| 图 2 C4-HSL调控GCR2表达情况 |
利用GCR2特异引物从野生型拟南芥中扩增其片段,并对目的片段进行胶回收。胶回收产物经1%琼脂糖凝胶电泳检测,在预期位置(1 233 bp)有明显条带(图 3-A)。将GCR2片段连到pMD18-T载体并转入DH5α。用BamHⅠ和XhoⅠ从pMD18-T载体上切下GCR2,再用T4连接酶与pET28a连接。对DH5α中提取的pET28a-GCR2质粒进行双酶切及测序验证,出现与目的片段大小一致且序列一致的条带(图 3-B),表明GCR2片段已插入pET28a载体,然后将该质粒转入BL21。
 |
| 图 3 GCR2的PCR产物胶回收琼脂糖凝胶电泳结果(A)和双酶切验证重组质粒pET28a-GCR2(B) |
GCR2相对分子量为46.45 kD。His-GCR2融合蛋白经ExPASy分析其相对分子量为51.06 kD。28℃下0.5 mmol/L IPTG诱导后,经SDS-PAGE验证发现,在40-55 kD之间出现明显蛋白条带(图 4第1、2泳道),证明融合蛋白His-GCR2在大肠杆菌中表达。超声破碎菌体后,分别取上清和沉淀进行SDSPAGE检测。发现沉淀中His-GCR2多于上清(图 4第3、4泳道)。但沉淀中的包涵体失去蛋白自身的活性结构,所以取上清进行纯化。
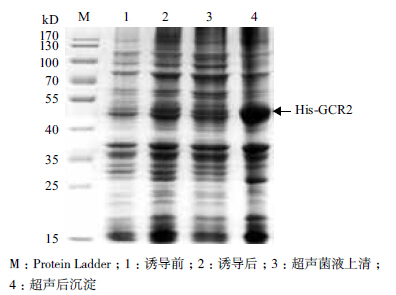 |
| 图 4 融合蛋白His-GCR2诱导表达及可溶性分析SDSPAGE检测 |
将超声后菌液上清(上清)、结合镍柱后流出液(流)、杂蛋白洗脱液(W1、W3)及目的蛋白洗脱液(E1-E5)分别进行SDS-PAGE (图 5-A)。并对上清液、流出液及目的蛋白洗脱液(E1-E5)进行Western blot检测,其中Western blot分别用Histag一抗和GCR2一抗进行检测(图 5-B,C)。检测发现E3-E5蛋白洗脱液纯度高,利用超虑离心管浓缩洗脱下的His-GCR2,浓缩后经考马斯亮兰G-250检测浓度为0.635 mg/mL,并进行SDS-PAGE检测(图 5-D)。结果表明,GCR2没有在浓缩过程中降解,可用于MST检测。
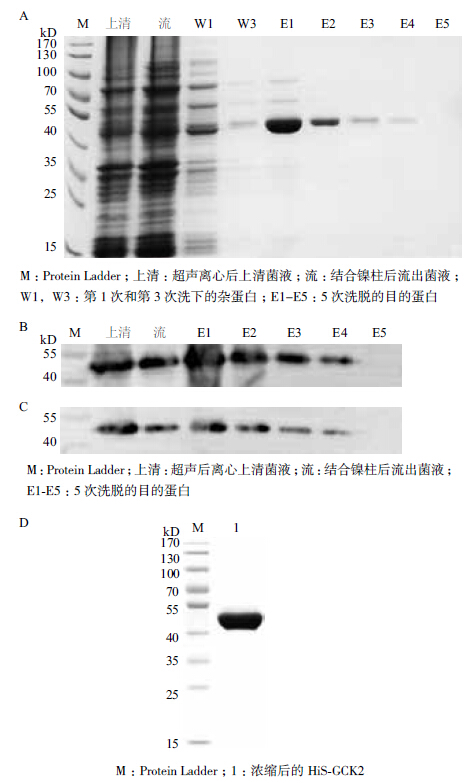 |
| 图 5 融合蛋白His-GCR2纯化的SDS-PAGE和Western blot检测及浓缩后的SDS-PAGE检测 |
通过MST技术检测GCR2与C4-HSL,以及BSA与C4-HSL结合情况。测得GCR2与C4-HSL的Kd值为166 nmol/L,显示出较强的结合能力。BSA与100 μmol/L C4-HSL反应时仍不能达到饱和状态,根据这条可能的结合曲线估算其Kd值约为18 600 nmol/L,远远大于GCR2与C4-HSL的Kd值(图 6-A,B)。通过两组实验对比,表明C4-HSL与GCR2的结合能力较强,且具有一定的特异性。
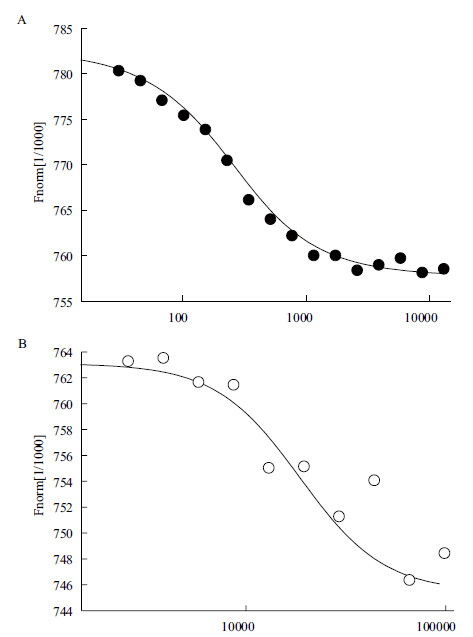 |
| 图 6 GCR2与C4-HSL结合特征分析(A)和BSA与C4-HSL结合特征分析(B) |
植物是生物界中的重要成员,它可将地上和地下部分的生物群体联系起来。植物需要调节、分配自身的各种资源以完成生长发育和抵抗外部不利因素。然而土壤中非致病的根瘤菌、根际真菌和细菌有助于植物的生长发育[25]。大量研究表明AHLs能促进植物的生长发育,还可提高植物的抗病能力[26]。但是植物如何识别、接受AHLs信号是目前研究的重点。2013年,Thomanek[27]合成了生物素标记的3OC14-HSL (biotin-3OC14-HSL),其能被在大肠杆菌中表达的AHLs受体识别。使用biotin-3OC14-HSL与包被有链霉亲和素的磁珠进行pull-down实验,证实其能够与包被有链霉亲和素的磁珠结合,这为寻找拟南芥中与3OC14-HSL相互作用的蛋白,乃至寻找3OC14-HSL的受体都至关重要[27]。
AHLs对哺乳动物细胞生理生化的调控机制已有较为深入的研究。LuxR蛋白家族中大部分成员是革兰氏阴性细菌中与AHLs相互作用的转录因子[28]。AHLs与LuxR结合后使其构象发生改变,从而使LuxR中的HTH (螺旋-转角-螺旋)结构域与DNA上游的启动子结合。LasR和RhlR是LuxR家族成员,C4-HSL和3OC12-HSL能够进入猴子肾脏细胞,并激活在猴子肾脏COS-1细胞系中表达的LasR和RhIR转录因子[29]。3OC12-HSL在较高浓度下可显著降低骨髓源巨噬细胞的活性,C4-HSL不能抑制其活性。通过细胞核断裂及染色质凝聚情况的形态学分析,认为3OC12-HSL引起骨髓源巨噬细胞活性降低是由于其引起了细胞凋亡[30]。Rumbaugh对3OC12-HSL和C4-HSL处理后的小鼠成纤维细胞进行转录组表达芯片分析,发现其分别引起10%和8% mRNAs的改变。3OC12-HSL可增加小鼠成纤维细胞中胞质Ca2+水平[31],这与本实验室用C4-HSL和3OC8-HSL处理拟南芥根细胞的结果一致[20, 21]。Shiner[31]证实3OC12-HSL使胞内钙库内质网中的Ca2+释放到胞质中。认为3OC12-HSL激活了磷脂酶C(PLC),随后IP3与内质网上IP3的受体结合,从而促进内质网中的Ca2+释放出来。
GPCRs可结合多种激素及药物,并通过PLC调节下游的信号通路。Rumbaugh[32]推测GPCRs很可能作为哺乳动物细胞膜上AHLs的受体。本研究qRT-PCR结果显示拟南芥GCR2对C4-HSL应答迅速,6 h后上调至最大值,这与GCR1、Cand2和Cand7响应3OC6-HSL及3OC8-HSL的情况相似[13, 17]。ELISA结果显示C4-HSL处理后GCR2蛋白的表达情况与转录水平近似,也在6 h后达到最大值,证实拟南芥GCR2能够响应C4-HSL。利用超滤离心管浓缩纯化的GCR2用于MST检测。经MST检测发现GCR2与C4-HSL具有较强的结合能力。根据目前已有的报道,宋水山[10]提出了AHLs在真核细胞中信号转导模型,即AHLs与细胞膜上的GPCRs结合,激活细胞膜表面的Ca2+通道,使胞外Ca2+进入细胞质中。或激活细胞膜上的PLC,使内质网中的Ca2+释放到细胞质中。通过Ca2+信号的变化影响下游代谢途径。另外,MST检测BSA与C4-HSL是否结合时,出现了一条可能的结合曲线。这是因为BSA作为具有亲水和疏水集团的运输蛋白,可与非离子表面活性剂[33]、黄酮类[34]、酯类[35]等小分子结合。C4-HSL作为一种酯类小分子物质,极有可能与BSA发生某种非特异的结合,且经检测发现这种可能的结合极其微弱。由此表明GCR2与C4-HSL的结合具有特异性。由于GCR2作为ABA通路的上游基因[18],GCR2与C4-HSL具有明显的结合特征,表明C4-HSL可能具有增强植物抗性作用。然而,拟南芥GCR2是否作为C4-HSL的受体还需使用多种受体动力学研究方法进一步研究。 4 结论
本研究通过qRT-PCR分析C4-HSL对拟南芥GCR2表达水平的调节情况,发现GCR2受C4-HSL调控,且C4-HSL处理后GCR2响应迅速,且上调时间较长。利用ELISA检测C4-HSL处理后拟南芥中GCR2的含量,进一步证实GCR2受C4-HSL调控。浓缩体外表达的GCR2进行MST检测,发现GCR2与C4-HSL具有较强的结合能力,并且具有一定的特异性。由此证明,拟南芥GCR2可能介导了拟南芥响应C4-HSL的信号转导过程。
| [1] | Gonzalez JE,Keshavan ND.Messing with bacterial quorum sensing[J].Microbiol Mol Biol Rev,2006,70(4):859-875. |
| [2] | Laue BE,Jiang Y,Chhabra SR,et al.The biocontrol strain Pseudomonas fluorescens F113 produces the Rhizobium small bacteriocin,N-(3-hydroxy-7-cis-tetradecenoyl) homoserine lactone,via HdtS,a putative novel N-acylhomoserine lactone synthase[J].Microbiology,2000,146(Pt 10):2469-2480. |
| [3] | Marketon MM,Gronquist MR,Eberhard A,et al.Characterization of the Sinorhizobium meliloti sinR/sinI locus and the production of novel N-acyl homoserine lactones[J].J Bacteriol,2002,184(20):5686-5695. |
| [4] | Mcclean KH,Winson MK,Fish L,et al.Quorum sensing and Chromobacterium violaceum:exploitation of violacein production and inhibition for the detection of N-acylhomoserine lactones[J].Microbiology,1997,143(Pt 12):3703-3711. |
| [5] | Schripsema J,De Rudder KE,Van Vliet TB,et al.Bacteriocin small of Rhizobium leguminosarum belongs to the class of N-acyl-L-homoserine lactone molecules,known as autoinducers and as quorum sensing co-transcription factors[J].J Bacteriol,1996,178(2):366-371. |
| [6] | Shaw PD,Ping G,Daly SL,et al.Detecting and characterizing N-acylhomoserine lactone signal molecules by thin-layer chromatography[J].Proc Natl Acad Sci USA,1997,94(12):6036-6041. |
| [7] | Schuster M,Greenberg EP.A network of networks:quorum-sensing gene regulation in Pseudomonas aeruginosa[J].Int J Med Microbiol,2006,296(2-3):73-81. |
| [8] | Chhabra SR,Harty C,Hooi DS,et al.Synthetic analogues of the bacterial signal (quorum sensing) molecule N-(3-oxododecanoyl)-L-homoserine lactone as immune modulators[J].J Med Chem,2003,46(1):97-104. |
| [9] | Gotz C,Fekete A,Gebefuegi I,et al.Uptake,degradation and chiral discrimination of N-acyl-D/L-homoserine lactones by barley (Hordeum vulgare) and yam bean (Pachyrhizus erosus) plants[J].Anal Bioanal Chem,2007,389(5):1447-1457. |
| [10] | 宋水山.N-酰基高丝氨酸内酯介导的细菌与其真核寄主之间的信息交流[J].中国细胞生物学学报,2010(2):331-335. |
| [11] | Mathesius U,Mulders S,Gao M,et al.Extensive and specific responses of a eukaryote to bacterial quorum-sensing signals[J].Proceedings of the National Academy of Sciences,2003,100(3):1444-1449. |
| [12] | Miao C,Liu F,Zhao Q,et al.A proteomic analysis of Arabidopsis thaliana seedling responses to 3-oxo-octanoyl-homoserine lactone,a bacterial quorum-sensing signal[J].Biochemical and Biophysical Research Communications,2012,427(2):293-298. |
| [13] | Liu F,Bian Z,Jia Z,et al.The GCR1 and GPA1 participate in promotion of Arabidopsis primary root elongation induced by N-acylhomoserine lactones,the bacterial quorum-sensing signals[J].Molecular Plant-Microbe Interactions,2012,25(5):677-683. |
| [14] | Ortiz-Castro R,Martinez-Trujilllo M,Lopez-Bucio J.N-acyl-L-homoserine lactones:a class of bacterial quorum-sensing signals alter post-embryonic root development in Arabidopsis thaliana[J].Plant Cell Environ,2008,31(10):1497-1509. |
| [15] | Schikora A,Schenk ST,Stein E,et al.N-acyl-homoserine lactone confers resistance toward biotrophic and hemibiotrophic pathogens via altered activation of AtMPK6[J].Plant Physiol,2011,157(3):1407-1418. |
| [16] | Gookin TE,Kim J,Assmann SM.Whole proteome identification of plant candidate G-protein coupled receptors in Arabidopsis,rice,and poplar:computational prediction and in-vivo protein coupling[J].Genome Biol,2008,9(7):R120. |
| [17] | Jin G,Liu F,Ma H,et al.Two G-protein-coupled-receptor candidates,Cand2 and Cand7,are involved in Arabidopsis root growth mediated by the bacterial quorum-sensing signals N-acylhomoserine lactones[J].Biochemical and Biophysical Research Communications,2012,417(3):991-995. |
| [18] | Liu X,Yue Y,Li B,et al.A G protein-coupled receptor is a plasma membrane receptor for the plant hormone abscisic acid[J].Science,2007,315(5819):1712-1716. |
| [19] | Liu XA,Yue YL,LI B,et al.A G protein coupled receptor is a plasma membrane receptor for the plant hormone abscisic acid[J].Science,2007,318(5852):914. |
| [20] | Song S,Jia Z,Xu J,et al.N-butyryl-homoserine lactone,a bacterial quorum-sensing signaling molecule,induces intracellular calcium elevation in Arabidopsis root cells[J].Biochemical and Biophysical Research Communications,2011,414(2):355-360. |
| [21] | 张哲,张霞,边子睿,等.3-羰基辛酰基高丝氨酸内酯诱导拟南芥根细胞Ca2+内流[J].植物生理学报,2011(9):872-878. |
| [22] | Jerabek-Willemsen M,Andr T,Wanner R,et al.MicroScale Thermophoresis:Interaction analysis and beyond[J].Journal of Molecular Structure,2014,doi:10.1016/j.molstruc.2014.03.009. |
| [23] | Immekus F,Barandun LJ,Betz M,et al.Launching spiking ligands into a protein-protein interface:a promising strategy to destabilize and break interface formation in a tRNA modifying enzyme[J].ACS Chem Biol,2013,8(6):1163-1178. |
| [24] | Shang X,Marchioni F,Evelyn CR,et al.Small-molecule inhibitors targeting G-protein-coupled Rho guanine nucleotide exchange factors[J].Proc Natl Acad Sci USA,2013,110(8):3155-3160. |
| [25] | Pangesti N,Pineda A,Pieterse CM,et al.Two-way plant mediated interactions between root-associated microbes and insects:from ecology to mechanisms[J].Frontiers in Plant Science,2013,4. |
| [26] | 赵芊,贾振华,宋水山.细菌信号分子N-酰基高丝氨酸内酯调控植物抗性的研究进展[J].植物生理学报,2014(2):143-149. |
| [27] | Thomanek H,Schenk ST,Stein E,et al.Modified N-acyl-homoserine lactones as chemical probes for the elucidation of plant-microbe interactions[J].Org Biomol Chem,2013,11(40):6994-7003. |
| [28] | Fuqua C,Parsek MR,Greenberg EP.Regulation of gene expression by cell-to-cell communication:acyl-homoserine lactone quorum sensing[J].Annu Rev Genet,2001,35:439-468. |
| [29] | Williams SC,Patterson EK,Carty NL,et al.Pseudomonas aeruginosa autoinducer enters and functions in mammalian cells[J].J Bacteriol,2004,186(8):2281-2287. |
| [30] | Tateda K,Ishii Y,Horikawa M,et al.The Pseudomonas aeruginosa autoinducer N-3-oxododecanoyl homoserine lactone accelerates apoptosis in macrophages and neutrophils[J].Infect Immun,2003,71(10):5785-5793. |
| [31] | Shiner EK,Terentyev D,Bryan A,et al.Pseudomonas aeruginosa autoinducer modulates host cell responses through calcium signalling[J].Cell Microbiol,2006,8(10):1601-1610. |
| [32] | Rumbaugh KP.Convergence of hormones and autoinducers at the host/pathogen interface[J].Anal Bioanal Chem,2007,387(2):425-435. |
| [33] | Delgado-Magnero KH,Valiente PA,Ruiz-Pena M,et al.Unraveling the binding mechanism of polyoxyethylene sorbitan esters with bovine serum albumin:a novel theoretical model based on molecular dynamic simulations[J].Colloids Surf B Biointerfaces,2014,116:720-726. |
| [34] | Liu S,Guo C,Guo Y,et al.Comparative binding affinities of flavonoid phytochemicals with bovine serum albumin[J].Iran J Pharm Res,2014,13(3):1019-1028. |
| [35] | Tan Y,Siebert KJ.Modeling bovine serum albumin binding of flavor compounds (alcohols,aldehydes,esters,and ketones) as a function of molecular properties[J].J Food Sci,2008,73(1):S56-63. |




