2. 北京农学院生物科学与工程学院,北京 102206;
3. 农业部都市农业(北方)重点开放实验室,北京 102206
2. College of Biological Science and Engineering,Beijing University of Agriculture,Beijing 102206;
3. Key Laboratory of Urban Agriculture (North) of Ministry of Agriculture China,Beijing 102206
产量一直是大豆育种最重要的性状之一。大豆产量是一个综合性状,其遗传基础复杂,研究与产量密切相关的性状或产量因素,是揭示产量性状遗传基础的有效途径。大豆产量主要影响因素可归为三类:(1)光合生理有关性状:生物量累积与分配、叶部性状等;(2)产量因子:收获指数、百粒重、荚数、节数及分枝性状等;(3)倒伏性[1];前二者是产量决定因素,后者是高产限制因素。目前对这三类产量主要影响因素的分子遗传基础研究尚需加强。
有研究报道,水稻中的GW2基因负责编码一个环形E3泛素连接酶,是调控水稻粒宽和粒重的主效基因[2]。GW2功能的缺失使得泛素不能被转移到靶蛋白上,因而导致本应降解的底物不能被特异识别,进而激活颖花外壳细胞的分裂,增加颖花外壳的宽度,另一方面,灌浆速率也间接地得到了提高,胚乳大小随之得到了增加,最终谷壳的宽度、粒重以及产量都得到了增加[3, 4]。
目前,除了在水稻中对GW2基因进行了较深入的研究外,在大麦[12]、小麦[13, 14]、玉米[15]中也有少量的研究,但至今未见在大豆中的研究报道。本实验针对大豆中的GW2基因开展了初步的研究,期望能够发现GmGW2是否与大豆产量相关,为将来利用基因工程技术手段培育出高产的新型大豆品种进行有益的尝试。 1 材料与方法 1.1 材料
本研究所用的大豆品种为中黄10,由中国农业科学院作物科学研究所提供,并在北京农学院试验地进行繁育。克隆载体pMD18-T购自TaKaRa公司。农杆菌菌株EHA105,表达载体pCAMBIA1300∷ EYFP由本实验室留存。 1.2 方法 1.2.1 目的基因克隆与转化载体构建
根据之前文献中报道的水稻基因GW2的序列,在GenBank中与大豆基因组进行序列比对,找到同源基因GmGW2(1 287 bp),其位于大豆基因组15号染色体上。根据GmGW2的mRNA序列设计引物。提取大豆品种中黄10的总RNA,反转录为cDNA,利用设计引物进行PCR扩增,得到目的片段。将目的片段亚克隆到pMD18-T载体进行测序,然后用KpnⅠ与EcoRⅠ双酶切T载体,将切下的目的片段连入载体骨架pCAMBIA1300∷EYFP中,构建出重组载体pCAMBIA1300∷GmGW2∷EYFP。 1.2.2 利用农杆菌介导法侵染大豆幼胚
将含有目的片段的重组质粒热激转化到农杆菌EHA105感受态细胞中,并做PCR鉴定,挑取阳性菌落进行扩大培养至OD600为0.8左右。
挑选数粒表面光滑无菌斑的成熟的大豆中黄10种子,置于干净的培养皿中,喷洒75%酒精进行表面消毒,置于通风橱中吹干,再用1%次氯酸钠溶液喷洒种皮,再次置于通风橱中吹干。将消毒后的种子放在干燥器中,使用氯气灭菌法(100 mL次氯酸钠溶液加入4 mL浓盐酸)[5]灭菌24 h。将灭菌后的大豆种子用无菌水冲洗,去除表面离子,放入盛有湿润滤纸的培养皿中,暗培养24 h,培养温度25-28℃,光照强度为150 μmol×m-2×s-1[6]。将萌发的大豆种子除去种皮,并分开两片子叶,去掉其中的一片,剩下的子叶要保留完整的胚。轻轻地去掉一片真叶,并在胚轴,子叶节处划几道伤口,以备侵染[7]。将外植体浸泡在之前制备的农杆菌菌液中,15 min之后将外植体置于共培养基上,于培养室中暗培养3 d。培养结束后将外植体上的农杆菌洗净,栽植到花盆中,前期用保鲜膜覆盖表面。后期定时浇水,每2周浇灌一次营养液[8]。 1.2.3 转基因植株的PCR检测
使用CTAB法提取转基因植株幼嫩叶片的DNA进行PCR检测。反应体系(20 mL):ddH2O 13.5 mL,10×buffer 2 mL,2.5 mmol/L dNTPs 2 mL,10 mm引物各0.5 mL,模板DNA 1 mL (50-100 ng),Taq酶0.5 mL (5 u/mL)。反应程序:95℃预变性5 min;94℃变性30 s,58℃退火30 s,72℃延伸1 min,30个循环;72℃延伸10 min;4℃保温。反应产物用1%的琼脂糖凝胶电泳检测。用于检测EYFP (增强型黄色荧光蛋白)基因的引物为:EYFP-F:5'-GTGAGCAAGGGCGAGGAGCT-3';EYFP-R:5'-TTACTTGTACAGCTCGTCCA-3',扩增片段为717 bp。 1.2.4 激光共聚焦显微观察
激光共聚焦显微镜是以激光为光源,对观察的样品进行断层扫描和成像[9],可以用于检测荧光标记。选择PCR鉴定阳性的转基因植株,摘取新鲜的叶片,制作徒手切片,在激光共聚焦显微镜(Leica,TCS SP5)下观察EYFP的荧光信号。以野生型大豆中黄10为对照。 1.2.5 生物信息学分析
将克隆基因的测序结果在NCBI上进行核酸序列和蛋白序列比对及CDD (Conserved domain database)分析[10];GENSCAN扫描核酸序列上的编码序列号,翻译成蛋白序列;将蛋白序列与其他物种进行比对,形成系统进化树。 2 结果 2.1 目的基因克隆与载体构建
以大豆中黄10 cDNA为模板进行PCR扩增(图 1),经对亚克隆载体测序,扩增出的GmGW2基因序列相比于GenBank中预测序列的相似度为96.03%。将目的片段回收后,连接至经酶切的pCAMBIA1300∷EYFP载体上。将连接产物热激转化到大肠杆菌DH5α感受态细胞中,37℃倒置培养12 h,挑取单克隆进行PCR鉴定。图 2显示,在8个候选的克隆中有6个扩增出了目标条带,表明重组表达载体pCAMBIA1300∷GmGW2∷EYFP已成功转化大肠杆菌细胞。
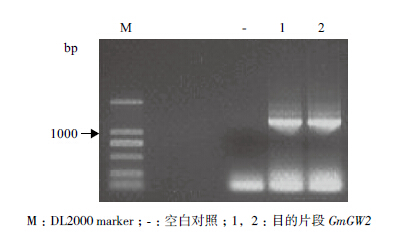 |
| 图 1 以大豆中黄10的cDNA为模板扩增GmGW2 |
 |
| 图 2 重组质粒菌落PCR鉴定 |
将构建好的重组载体pCAMBIA1300∷GmGW-2∷EYFP热激转化到农杆菌EHA105感受态细胞中,挑取PCR检测阳性菌落扩大培养至OD600约为0.8,将上述菌液浸泡外植体,置于共培养基中黑暗培养3 d后转入土培。2-3周后,提取幼嫩叶片基因组DNA,PCR鉴定出阳性植株(图 3),结果表明已将目的基因转到大豆中黄10中。
 |
| 图 3 PCR鉴定转基因大豆植株 |
将PCR鉴定阳性的大豆中黄10转基因植株与野生型一起进行盆栽培养(图 4),每2周浇灌营养液,培养至开花。其间摘取新鲜叶片,制作徒手切片,放至激光共聚焦显微镜下观察(图 5),激发光波长为514 nm[11]。比较野生型和转基因中黄10的叶片组织,可以明显看到在转基因植株叶片上有强烈的YFP荧光信号,而野生型叶片上并未出现荧光信号。由此进一步证实了目的基因已成功转入受体植株中。
 |
| 图 4 转入盆栽培养的转基因植株与野生型中黄10植株 |
 |
| 图 5 激光共聚焦显微镜下切片观察 |
对GmGW2测序结果分析表明,该基因具有完整的CDS区,长度为1 287 bp。利用GENSCAN扫描核酸序列上的编码序列号,翻译成蛋白序列(图 6)。利用推测的蛋白序列检索NCBI的CDD数据库,发现翻译蛋白从第50-100个氨基酸中含有一个RING型结构域(图 7)。进一步证明此基因是一个编码新型E3泛素连接酶的基因。
 |
| 图 6 GW2蛋白序列 |
 |
| 图 7 特异片段蛋白的保守结构域 |
将GmGW2氨基酸序列在NCBI上进行Blastx分析,并利用DNAMAN软件将其氨基酸序列与其他物种中编码GmGW2的氨基酸序列进行多重比对(图 8),构建系统进化树(图 9),进行聚类分析。结果表明GmGW2氨基酸序列与苜蓿(XP_003622248.1)和鹰嘴豆(XP_004488643.1)的GW2分别有62%和84%的相似性。
 |
| 图 8 GmGW2基因多重序列比对结果 |
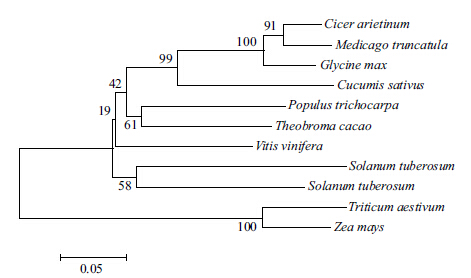 |
| 图 9 GmGW2基因进化树 |
实验过程中我们发现,大豆在无菌水中萌发的时间比较关键,以24 h左右为宜,时间过长将会使胚芽从子叶上脱离;时间太短,胚芽过分幼嫩不利于操作。农杆菌侵染的时间以15 min为宜,时间过长对外植体伤害较大,使种子萌发率明显下降,时间过短则不利于农杆菌侵染,影响转化率。制备侵染菌液时加入了silweet-77,实验中增加了共培养环节,这些有助于农杆菌的生长及进入外植体,以提高转化率。
通过对转基因植株T0代表现型的初步观察发现,植株呈现矮小,生育期提前等特点,分析认为,出现这种情况可能是因为外植体经过了农杆菌侵染后受到一定程度伤害,长势与野生型植株相比较差。为能够比较准确地看到转基因植株的表型变化,需要进一步繁殖转基因后代,获得相对稳定遗传个体,以便判断GmGW2过量表达对受体的影响。
本研究将目的基因与pCAMBIA1300∷EYFP载体连接,利用载体上具有的增强型报告基因YFP,使转基因阳性植株的鉴定更加快捷方便,同时黄色荧光蛋白可以很好地排除植物的绿色背景干扰,使转基因的检测结果更加直观,明显。与此同时,我们还将克隆的目的基因进行了一系列的生物信息学分析,发现该基因编码E3泛素连接酶,且与其他物种(苜蓿,鹰嘴豆)中的GW2基因具有比较高的同源性。有关该基因的相应功能有待进一步验证。 4 结论
本研究利用已发表的水稻GW2基因序列,在GenBank中找到与之同源性较高的大豆基因GmGW2,克隆测序结果表明与GenBank中预测序列相似度达到96.03%。用克隆片段构建出重组表达载体pCAMBIA1300∷GmGW2∷EYFP,并通过萌发种子的方法转化至大豆品种中黄10中。对阳性的植株进行激光共聚焦显微镜观察,可见转基因植株中报告基因YFP的表达量极明显地增加。通过对GmGW2基因进行生物信息学分析,发现其编码E3泛素连接酶,具有保守的环形结构,进化树分析显示其与苜蓿和鹰嘴豆的同源性较高。
| [1] | 黄中文.利用重组自交系群体研究大豆产量与生物量动态特征,茎叶性状间的关系和产量相关性状的QTL分析[D].南京:南京农业大学,2008. |
| [2] | Matsuoka M,Ashikari M.A quantitative trait locus regulating rice grain width[J].Nature Genetics,2007,39(5):583-584. |
| [3] | Song XJ,Huang W,Shi M,et al.A QTL for rice grain width and weight encodes a previously unknown RING-type E3 ubiquitin ligase[J].Nature Genetics,2007,39(5):623-630. |
| [4] | Li Q,Li L,Yang X,et al.Relationship,evolutionary fate and function of two maize co-orthologs of rice GW2 associated with kernel size and weight[J].BMC Plant Biology,2010,10(1):143. |
| [5] | 刘海坤,卫志明.一种大豆成熟种子的消毒方法[J].植物生理学通讯,2002,38(3):260-261. |
| [6] | Liu ZM,Xiong HW,Xie H,et al.A Technique for Agrobacteriummediated transformation via germinating seeds of soybean[J].Advanced Materials Research,2013,749:413-417. |
| [7] | Chee PP,Fober KA,Slightom JL.Transformation of soybean (Glycine max) by infecting germinating seeds with Agrobacterium tumefaciens[J].Plant Physiology,1989,91(3):1212-1218. |
| [8] | 刘志敏,熊鹤雯,谢皓,等.农杆菌介导的大豆萌发种子转化技术[J].生物技术通报,2013(8):83-87. |
| [9] | Plautz JD,Day RN,Dailey GM,et al.Green fluorescent protein and its derivatives as versatile markers for gene expression in living Drosophila melanogaster,plant and mammalian cells[J].Gene,1996,173(1):83-87. |
| [10] | 朱奇朗,李晓波,肖向文,等.不同色彩矮牵牛DFR基因的克隆与生物信息学分析[J].生物技术通报,2013(9):68-76. |
| [11] | Finer KR,Finer JJ.Use of Agrobacterium expressing green fluorescent protein to evaluate colonization of sonicationassisted Agrobacterium-mediated transformation-treated soybean cotyledons[J].Letters in Applied Microbiology,2000,30(5):406-410. |
| [12] | 郭刚刚,董国清,周进,等.大麦BAC文库三维混合池的构建与HvGW2筛选[J].中国农业科学,2013,46(1):9-17. |
| [13] | Zhang K,Wang J,Zhang L,et al.Association analysis of genomic loci important for grain weight control in elite common wheat varieties cultivated with variable water and fertiliser supply[J].PLoS One,2013,8(3):1-17. |
| [14] | Bednarek J,Boulaflous A,Girousse C,et al.Down-regulation of theTaGW2 gene by RNA interference results in decreased grain size and weight in wheat[J].J Exp Bot,2012,63(16):5945-5955. |
| [15] | Li Q,Li L,Yang X,et al.Relationship,evolutionary fate and function of two maize co-orthologs of rice GW2 associated with kernel size and weight[J].BMC Plant Biol,2010,10:143-157. |




