2. 山东农业大学动物科技学院,泰安 271018
2. College of Animal Science & Veterinary Medicine, Shandong Agricultural University, Taian 271018
新型鸭呼肠孤病毒感染是近几年发生的一种对我国养鸭业产生较大危害的新型疾病。该病一年四季均能发生,并且不同品种的鸭均可发病,如樱桃谷鸭、麻鸭、番鸭、半番鸭等。发病日龄一般为3-25日龄,其中以5-10日龄居多,病程5-7 d,发病率5%-32.5%,死亡率2%-20%,一般发病鸭日龄愈小,发病率和死亡率愈高[1, 2]。新型鸭呼肠孤病毒与禽呼肠孤病毒(Avian reovirus,ARV)以及传统的番鸭呼肠孤病毒(Muscovy duck reovirus,MDRV)在基因序列、生物学特性、抗原相关性等方面均存在较大差异[3]。
Notomi等[4]报道了一种新的体外扩增特异性基因的方法,称为环介导等温扩增(Loop-mediatedisothermal amplification,LAMP)技术。该技术针对靶基因的6个区域设计4条特异性引物,利用BstDNA聚合酶,在恒温条件下(65℃)作用60 min,即可完成扩增反应。该技术具有特异性强、灵敏度高、检测快速、仪器要求低、成本低廉等优点,非常适合在基层实验室,甚至现场进行快速诊断[5, 6]。本研究正是根据LAMP技术的原理,建立快速检测新型鸭呼肠孤病毒的一步反转录环介导等温扩增(RTLAMP)方法,并进行初步的临床应用,以期达到临床快速诊断新型鸭呼肠孤病毒的目的。 1 材料与方法 1.1 材料 1.1.1 毒株
新型鸭呼肠孤病毒(NDRV)、A型鸭甲肝病毒(DHAV-A)、C型鸭甲肝病毒(DHAV-C)、番鸭呼肠孤病毒(MDRV)、禽呼肠孤病毒(ARV)、鸭瘟病毒(DPV)和鸭坦布苏病毒(DTMUV)均由山东省家禽疫病诊断与免疫重点实验室分离、保存。 1.1.2 试剂与材料
RNAiso Reagent、AMV反转录酶、RNasin、dNTP购自TaKaRa (大连)公司;Bst DNA聚合酶(大片段)购自NEB公司;甜菜碱(Betaine)购自Sigma公司;SYBR Green I购自Invitrogen公司。其他试剂均为国产或进口分析纯。
SPF鸡胚、SPF鸭胚由山东省农科院家禽研究所昊泰实验动物公司提供。 1.2 方法 1.2.1 病毒增殖与纯化
按照常规方法制备鸡胚成纤维(CEF)细胞,加入含10%新生牛血清的DMEM培养基,于37℃、5% CO2培养箱中进行培养,取长满单层的细胞,倾弃营养液,并用Hanks液洗涤3次后,接种100倍稀释的种毒,1 mL/瓶,37℃孵育1 h,PBS洗涤后加入含3%新生牛血清的维持液,继续培养,每天观察细胞,待细胞病变达80%以上时收集,然后利用蔗糖密度梯度离心的方法进行浓缩纯化,纯化后的病毒于-80℃冰箱中保存备用。 1.2.2 引物设计与合成
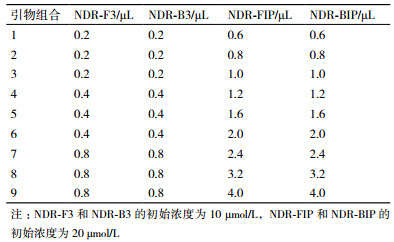
参考GenBank已发表的新型鸭呼肠孤病毒的S3基因序列(登录号:JX478258),利用Primer5.0软件,设计针对6个区域的4条LAMP引物,包括2条外引物(NDR-F3和NDR-B3)、2条内引物(NDR-FIP和NDR-BIP),引物由上海铂尚生物技术有限公司合成。引物序列见表 1。
反应在25 μL,体系中进行。参考已报道的RT-LAMP实验条件[7, 8],首先通过调整甜菜碱(Betaine)浓度、MgSO4浓度、扩增温度和扩增时间对反应体系和条件进行优化,具体梯度如下:Betaine终浓度分别为0.2、0.4、0.8和1.6mol/L;MgSO4终浓度分别为1、3、5和7 mmol/L;反应温度分别为61、62、63、64和65℃;反应时间分别为30、45和60 min。在确立初步反应体系和条件的基础上,对引物浓度进行深度优化,内外引物浓度比例分别按6倍、8倍和10倍的组合进行,具体见表 2。反应结束后,取5 μL产物加入1.5%琼脂糖凝胶中进行电泳观察,出现特征性阶梯状条带可判断为阳性。
利用SeqBuilder软件分析RT-LAMP扩增片段中的酶切位点,筛选出单一的Msp I位点,酶切产物理论值为278 bp和168bp。20 μL反应体系中添加10×buffer 2 μL、0.01% BSA 2 μL、Msp I 10 U和RT-LAMP产物5 μL。在37℃水浴中反应2 h,取10 μL反应产物在1.5%琼脂糖凝胶中电泳分析。 1.2.5 特异性检测试验
分别提取新型鸭呼肠孤病毒、A型鸭甲肝病毒、C型鸭甲肝病毒、番鸭呼肠孤病毒、鸭瘟病毒、鸭坦布苏病毒和禽呼肠孤病毒的RNA,利用上述优化的方法进行RT-LAMP检测,反应结束后,取5 μL产物加入1.5%琼脂糖凝胶中进行电泳观察,出现特征性阶梯状条带判断为阳性。 1.2.6 敏感性检测试验
提取新型鸭呼肠孤病毒的RNA,利用分光光度计测定RNA的含量,并将这些RNA稀释至2 ng/μL、200 pg/μL、20 pg/μL、2pg/μL、0.2 pg/μL、0.02 pg/μL和0.002 pg/μL等7个浓度(即RT-LAMP检测体系中RNA含量分别为10ng、1 ng、100 pg、10 pg、1 pg、0.1 pg和0.01 pg,然后进行RT-LAMP检测,每个样品重复两管。反应结束后,一管取5 μL产物加入1.5%琼脂糖凝胶中进行电泳观察,出现特征性阶梯状条带可判断为阳性,另一管加入1 μL 10倍稀释的SYBR Green Ⅰ,混匀后在紫外线下观察,若有绿色荧光,可判断为阳性。同时以上述不同含量的RNA为模板,以NDR-F3/NDR-B3为引物进行一步法RT-PCR反应,反应体系(25 μL)如下:10×PCR buffer 2.5 μL,引物NDR-F3 0.16 μmol/L,引物NDR-B3 0.16 μmol/L,RNA酶抑制剂20 U,AMV反转录酶10 U,rTaq酶10 U,模板2 μL。反应程序为:42℃ 30 min;95℃ 3 min;94℃ 10 s,60℃ 10 s,72℃ 20 s,30个循环。扩增结束后电泳观察,出现大小约为337 bp的单一条带判为阳性。将这两种方法的敏感性进行比较。 1.2.7 临床应用 从不同鸭场收集疑似病例的脾脏组织50份,应用本实验建立的RT-LAMP方法检测,同时将样品处理后经尿囊腔接种10日龄SPF鸭胚进行分离,盲传3代后,利用阳性血清通过中和试验鉴定分离物,并比较两种方法的符合性。 2 结果 2.1 RT-LAMP反应体系与条件优化
优化后的反应体系(25 μL)为:10×Bst buffer2.5 μL、dNTP混合液1 mmol/L、MgCl2 3 mmol/L、betaine 0.4 mmol/L、TritonX-100 0.1%、外引物(NDR-F3和NDR-B3)各0.16 μmol/L、内引物(NDR-FIP和NDR-BIP)各1.6 μmol/L、RNA酶抑制剂20 U、反转录酶AMV 10 U、Bst DNA聚合酶8 U、RNA模板2 μL。优化后反应条件:63℃ 45 min,85℃ 2 min。 2.2 RT-LAMP产物酶切鉴定
RT-LAMP产物酶切电泳结果(图 1)显示,扩增产物被Msp I完全切开,出现278 bp和168 bp两条条带,与理论值相符,说明RT-LAMP扩增的条带是NDRV的S3基因。
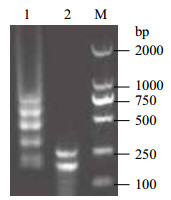 |
| 1 :RT-LAMP 产物 ;2 :酶切产物 ;M :DNA Marker DL2000 图 1 RT-LAMP 产物酶切鉴定 |
利用优化的RT-LAMP方法对新型鸭呼肠孤病毒和其他常见的鸭病病原进行检测,结果(图 2)显示,仅新型鸭呼肠孤病毒检测结果为阳性。
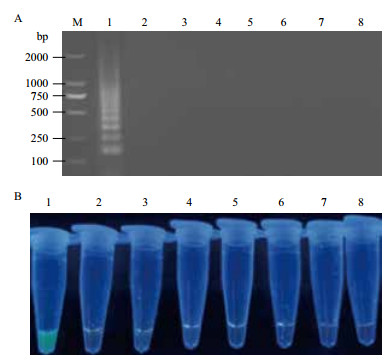 |
| M :DNA Marker DL2000 ;1-8 :NDRV、DHAV-A、DHAV-C、MDRV、ARV、DPV、DTMUV 和空白对照 ;A :凝胶电泳 ;B :SYBR Green Ⅰ染色 图 2 RT-LAMP 的特异性试验 |
提取浓缩纯化的新型鸭呼肠孤病毒的RNA,利用分光光度计测定RNA的含量为276 ng/μL,将RNA稀释成7个不同的浓度,分别利用RT-LAMP方法和常规RT-PCR方法进行检测。凝胶电泳和SYBR Green Ⅰ染色的结果是一致的,两者均显示该RT-LAMP方法对病毒RNA的最低检出量为0.1 pg,其敏感度是常规RT-PCR方法的100倍(图 3)。
 |
| M:DNA Marker DL2000 ;1-7:所对应的病毒 RNA 的含量分别为 104-10-2 pg;8 :空 白 对 照 ,A :RT-LAMP 产 物 凝 胶 电 泳 ;B :RT-LAMP 产 物 SYBR Green Ⅰ染色 ;C :RT-PCR 产物凝胶电泳 图 3 RT-LAMP 的敏感性试验 |
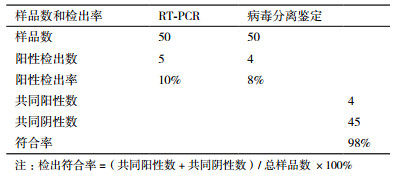
利用RT-LAMP方法从50份临床样品中检出阳性样品5份,阳性检出率为10%,而病毒分离鉴定检出阳性样品4份,阳性检出率为8%,两种方法的符合率为98%(表 3)。
近几年,新型鸭呼肠孤病毒病的流行区域已从南方扩散到北方,发病率也在不断上升,已成为影响我国养鸭业发展的重要疾病之一。目前对于新型鸭呼肠孤病毒的实验室诊断,可以采取传统的血清中和实验,但该方法存在耗时长、不易标准化等缺点。也可以采取快速、灵敏、特异的分子生物学检测技术,如常规RT-PCR、荧光RT-PCR等方法,但这些方法需要PCR仪、电泳系统、凝胶成像系统等较为复杂的仪器设备,不适合在广大基层实验室推广应用。本研究建立的新型鸭呼肠孤病毒一步RT-LAMP具有快速、准确、灵敏等优点,特别是对仪器设备要求低,基因扩增和结果判断只需要1台水浴锅、1台紫外分析仪或电泳系统,因此非常适合在基层实验室,甚至现场进行快速诊断。利用该方法检测时,从收到病料到获得结果最快只需2.9 h:病料处理1h、核酸提取1 h、核酸扩增0.8 h、染色观察0.1 h。而常规RT-PCR检测大约需要5.3 h:病料处理1 h、核酸提取1 h、反转录0.8 h、核酸扩增2 h、电泳0.5h;荧光RT-PCR检测大约需要4.8 h:病料处理1 h、核酸提取1 h、反转录0.8 h、核酸扩增2 h。为了更好地确定RT-LAMP检测方法的灵敏度,我们先对病毒进行了纯化,然后提取其RNA进行检测,结果发现,该方法对病毒RNA的最低检出量为0.1 pg,其敏感度是利用相同的外引物建立的常规RT-PCR方法的100倍。这与Chen等[9]利用RT-LAMP方法检测猪瘟病毒以及王永江等[10]利用RT-LAMP方法检测柑橘衰退病毒的研究结果一致。该检测方法的敏感度是王劭等[11]建立的新型鸭呼肠孤病毒RT-PCR检测方法的20倍。在本研究的预实验时,我们参照本实验室先前建立的禽流感病毒LAMP诊断方法中的反应体系和条件进行了扩增,结果发现病毒RNA的最低检出量为1 pg,仅为常规RT-PCR方法敏感度的10倍。由于LAMP检测方法的灵敏度除了与引物设计有关外,还与反应体系和条件有较大的关系,并且检测引物不同,其最佳的反应体系和条件也不尽相同[12, 13]。为此我们对本实验的反应体系与条件进行了优化。在优化过程中,我们发现,Mg2+浓度、内外引物的浓度与比例以及反应温度与时间对扩增效率影响较大。当Mg2+终浓度为1 mmol/L或7 mmol/L时对扩增效率有明显的抑制作用。通常LAMP的反应温度在60-65℃之间[8],本研究中当温度为65℃时阶梯状条带很淡,而61-64℃条带亮度几乎无差别。反应时间分别设为45 min和60 min时,条带亮度差别不大,而30 min时条带明显减弱。
LAMP扩增结果一般可通过3种方式判断:加入SYBR Green Ⅰ肉眼观察、加入SYBR Green Ⅰ紫外线下观察和电泳观察[14, 15]。肉眼观察简单方便,无需紫外分析仪,但弱阳性和阴性很难区分开;电泳观察需要电泳仪、电泳槽、凝胶成像系统等仪器设备,不适合在基层实验室;而在紫外线下观察结果,仅需要1台简单的紫外分析仪,并且结果判断的准确率大大提高。LAMP检测技术的一个最大缺点是容易出现假阳性,这主要是由于空气中存在阳性核酸气溶胶污染所致。可以通过两种途径解决这个问题:一是将反应液配制区、扩增区和结果观察区严格隔离开;二是每次检测设置空白对照。 4 结论
本研究基于NDRV的S3基因,通过反应体系与条件的反复优化,建立了快速检测NDRV的RTLAMP方法。该方法具有良好的特异性,除NDRV外对其他常见鸭病的检测结果均为阴性。该方法具有很高的灵敏度,对病毒RNA的最低检出量为0.1pg,是常规RT-PCR方法的100倍。临床应用结果表明,本研究建立的RT-LAMP检测方法与经典的病毒分离鉴定方法的符合率为98%,并且具有更高的灵敏度,特别对仪器要求低,可成为基层实验室的一种快速诊断NDRV的有效手段。
| [1] | 陈少莺, 陈仕龙, 林锋强, 等 . 一种新的鸭病(暂名鸭出血性 坏死性肝炎)病原学研究初报[J]. 中国农学通报, 2009, 25 : 28-31. |
| [2] | 黄瑜, 傅光华, 施少华, 等 . 新致病型鸭呼肠孤病毒的分离鉴 定[J]. 中国兽医杂志, 2009, 45(12):29-31. |
| [3] | 陈仕龙, 陈少莺, 程晓霞, 等 . 3 种禽类呼肠孤病毒血清学相关 性及致细胞病变差异分析[J]. 畜牧兽医学报, 2011, 42(4): 533-537. |
| [4] | Notomi T, Okayama H, Masubuchi H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Research, 2000, 28(12):E63. |
| [5] | Nagamine K, Hase T, Notomi T. Accelerated reaction by loopmediated isothermal amplification using loop primers[J]. Molecular and Cellular Probes, 2002, 16(3):223-229. |
| [6] | Hong TC, Mai QL, Cuong DV, et al. Development and evaluation of a novel loop-mediated isothermal amplification method for rapid detection of severe acute respiratory syndrome coronavirus[J]. Journal of Clinical Microbiology, 2004, 42 :1956-1961. |
| [7] | Dukes JP, King DP, Alexandersen S. Novel reverse transcription loop-mediated isothermal amplification for rapid detection of footand-mouth disease virus[J]. Archi Virol, 2006, 151 :1093-1106. |
| [8] | 鑫婷, 侯绍华, 贾红, 等 . 猪呼吸与繁殖综合症病毒 RT-LAMP 检测方法的建立[J]. 中国农业科学, 2010, 43(1):185-191. |
| [9] | Chen L, Fan XZ, Wang Q, et al. A novel RT-LAMP assay for rapid and simple detection of classical swine fever virus[J]. Virology Sinica, 2010, 25(1):59-64. |
| [10] | 王永江, 周彦, 李中安, 等 . 柑橘衰退病毒 RT-LAMP 快速检 测方法的建立[J]. 中国农业科学, 2013, 46(3):517-524. |
| [11] | 王劭, 陈少莺, 陈仕龙, 等 . 新型鸭呼肠孤病毒 RT-PCR 方法 的建立与应用[J]. 农业生物技术学报, 2011, 19 :388-392. |
| [12] | Motoko F, Naoko Y, et al. A simple method for the detection of measles virus genome by loop-mediated isothermal amplification (LAMP)[J]. J Medical Virol, 2005, 76 :406-413. |
| [13] | 张跃伟, 李旭妮, 郭盼盼, 等 . 荧光显色在环介导等温扩增 (LAMP)检测猪繁殖与呼吸综合征病毒的应用[J]. 农业生 物技术学报, 2010, 18(3):508-513. |
| [14] | Wang YL, Yuan XY, Li YF, et al. Rapid detection of newly isolated Tembusurelated Flavivirus by reverse-transcription loop-mediated isothermal amplification assay[J]. Virol J, 2011, 8 :553-559. |
| [15] | Tomita N, Mori Y, Kanda H, et al. Loop-mediated isothermal amplification(LAMP)of gene sequences and simple visual detection of products[J]. Nat Protocols, 2008, 3(5):877-882. |