2. 中国科学院上海高等研究院 生物炼制实验室,上海 201210
2. Lab of Biorefinery,Shanghai Advanced Research Institute,Chinese Academy of Sciences,Shanghai 201210
L-丝氨酸(L-Serine,L-Ser)作为一种组成蛋白的基本氨基酸广泛应用于医药、食品、化妆品等行业。此外,以L-Ser为原料还能合成20余种具有抗癌、抗艾滋、调节人体神经系统等不同效用的药物。目前L-Ser的全球市场需求量为10 000 t/年,市场潜力巨大[1, 2]。
然而,与不断增大的L-Ser市场需求相比,L-Ser的生产技术却较为落后[3, 4, 5]。目前,工业上采用的L-Ser生产方法主要有蛋白水解法[6]、化学合成法[7]和酶转化法[8]等,其中蛋白水解法存在工艺复杂、分离精制困难等缺点;化学合成法存在污染重、D-Ser与L-Ser分离困难等缺点;酶转化法是目前国际上普遍采用的方法,具有反应过程简单、副反应少、生产效率高等优点,但仍存在转化率偏低、前体物(甘氨酸等)昂贵等难题。因此尽快开发污染小、成本低、效率高的微生物直接发酵法生产L-Ser,显得极为重要。值得注意的是,由于微生物合成L-Ser的代谢网络复杂,特别是存在众多的L-Ser向其他氨基酸的转化途径,导致L-Ser在体内很难得到积累。本文系统综述了微生物发酵法生产L-Ser所涉及的代谢工程策略,并探讨了其未来发展的趋势。 1 L-丝氨酸的微生物合成机制 1.1 微生物合成L-丝氨酸的代谢途径
目前用于生产L-Ser的微生物种类主要有大肠杆菌和谷氨酸棒杆菌,两种微生物的L-Ser合成代谢机制基本相同,以大肠杆菌为例,起始物葡萄糖经糖酵解(EMP)途径中的3-磷酸甘油酸(3-Phosphoglycerate,3-PG)进入L-Ser分支途径;在L-Ser分支途径中,3-PG经磷酸甘油酸脱氢酶(SerA)催化合成3-磷酸-羟基丙酮酸(3-phosphonooxypyruvate,3-PHP),再途经中间产物3-磷酸丝氨酸(3-phosphoserine,Ser-P)后合成L-Ser;此外,中间产物Ser-P的合成还需要L-谷氨酸(L-glutamate,L-Glu)作为前体物提供氨基(图 1)。
 |
| 虚线表示反馈抑制;Glc:葡萄糖;PTS:磷酸葡萄糖转移酶系统;G6P:葡萄糖-6-磷酸;F6P:果糖-6-磷酸;GA3P:甘油醛-3-磷酸;1,3-PG:1,3-二磷酸甘油酸;3-PG:3-磷酸甘油酸;3-PHP:3-磷酸-羟基丙酮酸;Ser-P:3-磷酸丝氨酸;L-Ser:L-丝氨酸;L-Gly:L-甘氨酸;L-Trp:L-ser色氨酸;PYR:丙酮酸。图1根据KEGG网站(http://www.genome.jp/kegg/pathway.html)上的大肠杆菌MG1655和谷氨酸棒杆菌ATCC13032的丝氨酸代谢网络信息绘制而成 图 1 微生物产L-丝氨酸的合成途径及相关调控 |
微生物通过各种调控机制控制体内L-Ser的合成代谢。 1.2.1 限速酶的反馈抑制
在L-Ser分支途径中,催化3-磷酸-羟基丙酮酸(3-PHP)合成的磷酸甘油酸脱氢酶(phosphoglycerate dehydrogenase,PGDH)受到L-Ser的严格反馈调控,当胞内的L-Ser浓度达到30 μmol/L时,PGDH的残留酶活仅有不含L-Ser时的15%-17%[9],控制着由EMP途径进入L-Ser分支途径的碳流量。 1.2.2 降解转化途径调控
尽管L-Ser的主要合成途径较为简短,但值得注意的是,微生物体内存在L-Ser降解途径及转化为多种其他氨基酸的途径,如L-Ser经丝氨酸脱水酶(L-serine dehydratase,L-serDH)催化可降解为丙酮酸(Pyruvate,PYR);经丝氨酸羟甲基转移酶(Serine hydroxymethyltransferase,SHMT)催化生成L-甘氨酸(L-glycine,L-Gly),然后L-Gly经酶催化又可以进一步转化为L-苏氨酸(L-threonine,L-Thr)和L-异亮氨酸(L-isoleucine,L-Ile)等氨基酸。此外,在相关酶的催化作用下L-Ser还参与L-半胱氨酸(L-cysteine,L-Cys)和L-色氨酸(L-tryptophan,L-Trp)的合成反应。因此,胞内L-Ser极易转化为其他的氨基酸或化合物,导致其积累困难(图 2)。
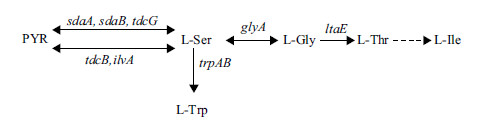 |
| PYR:丙酮酸;L-Ser:L-丝氨酸;L-Gly:L-甘氨酸;L-Thr:L-苏氨酸;L-Val:L-缬氨酸;L-Leu:L-亮氨酸;L-Ile:L-异亮氨酸;L-Trp:L-色氨酸。图2是根据KEGG网站(http://www.genome.jp/kegg/pathway.html)上大肠杆菌MG1655和谷氨酸棒杆菌ATCC13032的丝氨酸代谢网络信息绘制而成 图 2 大肠杆菌/ 谷氨酸棒杆菌L-丝氨酸的降解转化途径示意图 |
在微生物体内,许多氨基酸的分泌与吸收依靠特定的转运系统来完成。目前L-Ser转运系统的研究仍处于初级阶段,仅依靠生理生化特征发现数个与L-Ser转运相关的蛋白,例如大肠杆菌中,转运蛋白CycA属于生物体内负责转运氨基酸、多胺及金属阳离子有机物(Amino acid-polyamine-organocation,APC)超家族的成员,其主要负责丙氨酸由培养液中转运至细胞内,但研究发现CycA同时也参与调控菌体对L-Ser和L-Gly的吸收[10];来源于DAACS[Cation (Na+or H+) Symporter family]家族的SstT同时调控L-Thr和L-Ser的吸收[11];而透酶TdcC主要负责L-Thr的吸收,但竞争实验表明其也参与丝氨酸的吸收转运。另外,蛋白TdcC仅在厌氧条件下参与调控L-Ser的吸收[12, 13]。目前的文献报道中,仅转运蛋白SdaC被认为是专一性调控L-Ser吸收[14, 15]。此外,对于L-Ser的分泌转运系统,目前仅研究发现负责L-Thr分泌的转运蛋白ThrE同时也参与调控L-Ser的分泌[16]。 2 应用代谢工程改造L-丝氨酸合成途径
目前微生物产L-Ser的代谢工程研究策略主要有:抗反馈抑制作用酶的筛选、合成L-Ser关键酶的过量表达,L-Ser降解转化途径的改造和L-Ser转运途径的改造等(图 3)。
 |
| 虚线表示反馈抑制(但此处L.-Ser到serA的反馈抑制的虚线没有画出来);缩写参照图1 图 3 微生物产L-丝氨酸的代谢工程研究策略 |
L-Ser分支途径的改造主要包括关键酶磷酸甘油酸脱氢酶抗反馈抑制突变体的筛选以及系列关键酶基因的克隆表达。抗反馈抑制作用突变体的获得是微生物积累L-Ser的先决条件。随着DNA重组技术的发展,近年来通过解析磷酸甘油酸脱氢酶蛋白SerA的三维晶体结构,定向突变与其效应物L-Ser结合的关键氨基酸残基,从而获得了一系列抗反馈调节的磷酸甘油酸脱氢酶突变体SerAFbr (Feedbackinhibition-resistant,Fbr)[17, 18, 19]。例如,大肠杆菌SerA的调控域位于蛋白的C末端,研究发现完全去除蛋白的调控域(氨基酸残基337-410),可获得抗反馈调节的SerAFbr,但同时酶蛋白由四聚体转变为二聚体[17];而Grant等[18]仅将SerA调控域中与L-Ser结合的关键氨基酸残基H344和N346突变为丙氨酸(L-alanine,L-Ala),同样解除了L-Ser的反馈调控作用。在谷氨酸棒杆菌中,Peters-Wendisch等[20]通过缺失SerA蛋白末端197个氨基酸残基获得了抗反馈调节的突变株SerAFbr。
L-Ser分支途径的改造还涉及抗反馈调节作用酶SerAFbr和其他关键酶编码基因(serC、SerB、pgk)的克隆表达,从而增强该途径的碳源流量。例如,在谷氨酸棒杆菌中过量共表达基因serAfbr serC和serB[21];在大肠杆菌中serAfbr的重组表达及其与催化3-PG合成的酶蛋白基因pgk的共表达[22]。 2.2 L-Ser降解转化途径的改造
与终端氨基酸不同,L-Ser处于微生物合成代谢的中间环节,在细胞内L-Ser瞬间被降解为PYR或转化为L-Gly、L-Thr、L-Trp和L-Cys等其他氨基酸,导致其难以积累;且L-Gly等转化氨基酸作为一碳单元直接参与菌体的生长,直接切断这些途径会严重影响微生物的生长。因此转化途径的改造是L-Ser育种研究的重点和难点。
Peters-Wendisch等[21]单独敲除菌株ATCC 13032基因组上催化L-Ser向PYR转化的丝氨酸脱水酶L-serDH编码基因sdaA,菌株可积累8.4×10-3g/L的L-Ser;在共表达基因serAFbrBC的基础上,敲除基因sdaA,菌株可积累4.6×10-2g/L的L-Ser;而进一步降低催化L-Ser向L-Gly转化的丝氨酸羟甲基转移酶SHMT编码基因glyA的表达强度后,L-Ser的积累量快速提高至9.03 g/L;由于在四氢叶酸的参与下L-Ser才能转化为L-Gly,因此Stolz等[3]进一步敲除了四氢叶酸前体物叶酸的关键酶基因pabABC,L-Ser产量提高至36.3 g/L,这是目前文献报道的直接发酵法产L-Ser的最高产量。国内来书娟等[22]在共表达SerAFbr和pgk的基础上,敲除了菌株ATCC 13032基因组上的sdaA基因和丝氨酸羟甲基转移酶SHMT的调控基因glyR,菌株可积累4.5×10-2g/L的L-Ser。在大肠杆菌方面,Li等[23]在基因组上同时敲除了催化L-Ser向PYR转化的3个相关基因sdaA、sdaB和tdcG,当在此菌株中过量表达SerAFbr时,可积累L-Ser 13.6×10-3g/g细胞干重。 2.3 L-Ser转运途径的改造
转运途径改造是氨基酸育种研究的一个重要手段,通过提高胞内氨基酸的分泌速率或者降低胞外氨基酸的吸收速率,均可以有效促进氨基酸在胞外的积累。尽管目前L-Ser的转运系统研究仍处于生化与分子鉴定的阶段,但相关文献的研究结果仍显示出L-Ser转运系统的重要性。如Ogawa等[13]在大肠杆菌中缺失突变了L-Ser的吸收转运基因sstT,发现该菌株无法在以L-Ser为唯一碳源的培养基中生长,但当在该菌株中过量表达另外一个L-Ser吸收转运基因tdcC时,菌体的生长得以恢复。此外,Simic等[16]发现当在谷氨酸棒杆菌中过量表达分泌转运基因thrE时,L-Ser分泌速度与野生型相比提高了36%;而当在谷氨酸棒杆菌中缺失突变基因thrE时,L-Ser分泌速度与野生型相比降低了57%。 2.4 L-Ser合成代谢的发酵调控
微生物培养基组分以及培养环境条件的变化均会引起微生物合成代谢的变化,从而直接或间接调控着胞内L-Ser的合成代谢,因此针对性地优化发酵条件同样是改善L-Ser合成代谢的重要措施。例如张晓娟等[24]考察了维生素对谷氨酸棒杆菌产L-丝氨酸的影响,结果表明添加450 μg/L的VB1时,菌体L-Ser的积累量提高了28%;而添加0.4 μg/L的VB12时,菌体L-Ser的积累量提高了82%。此外,魏东等[25]对一株诱变改良过的黄色短杆菌进行碳氮源优化,L-Ser产量提高了84%,达到30.1 g/L。 3 展望
综上所述,目前国内外学者已经在代谢工程改造L-Ser合成代谢的研究中进行了大量的工作并取得了一些重要的研究成果。然而,借鉴近年来代谢工程策略在L-缬氨酸(L-valine,L-Val)[26, 27]、L-异亮氨酸(L-isoleucine,L-Ile)[28, 29]和L-色氨酸(L-tryptophan,L-Trp)[30, 31]等氨基酸菌种选育研究中的成功应用,目前L-Ser的代谢工程研究仍存在一些不足之处。
目前国内外学者仅根据已有的信息或经验对L-Ser分支途径及L-Ser降解转化途径进行分子改造,而相关文献表明除合成途径外,目标氨基酸转运途径、EMP及HMP途径,甚至全局调控因子等的定向改造同样有利于目标氨基酸的积累。如Wiriyathanawudhiwong等[32]过量表达L-半胱氨酸(L-cysteine,L-Cys)的分泌蛋白TolC后,培养液中L-Cys的积累量提高1倍以上;Zhao等[31]将色氨酸吸收的转运基因mtr和tnaB敲除后,L-Trp产量提高27%;而Tatarko等[33]通过敲除全局调控因子csrA,明显增加了L-苯丙氨酸分支途径的碳源流量。
此外,微生物合成氨基酸是一个复杂的代谢调控过程,当一个限速因子被消除时,合成代谢中往往就会次生出一些新的限速因子[34],因此在根据已有信息进行分子改造后,对合成代谢进行全局性的分析,加深对L-Ser合成代谢调控机制的理解,以及确定次生出的限速因子等,对进一步有效改造L-Ser合成代谢,选育优良L-Ser生产菌株显得尤为重要。令人鼓舞的是随着系统生物学的发展,人们已经可以从基因转录、蛋白质表达、代谢产物浓度3个层次上对微生物体内目标产物的合成代谢进行全局立体式的分析,且这些技术已经成功应用于其他工业微生物菌种的选育研究中[35, 36, 37]。Lee等[35]对L-Thr生产菌株进行转录组学分析发现,与乙醛酸循环相关的基因aceBA的转录水平异常上调,通过分子手段进一步增强aceBA的表达水平后,L-Thr产量提高30%。赵志军[36]研究3种基因型△ trpR.tnaA、△ trpR.tnaA.pheA和△ trpR.tnaA.pheA.mtr下大肠杆菌L-Trp合成代谢网络中代谢中间产物的浓度变化规律发现,赤藓糖-4-磷酸和L-Ser的浓度远低于相应分支途径中其他代谢中间产物的浓度,推测赤藓糖-4-磷酸和L-Ser为L-Trp合成的潜在限速节点。Yin等[37]对诱变产L-Ile的谷氨酸棒杆JHI3-156进行蛋白质组学分析发现,表达水平变化较大的蛋白:MetX、PrpC2和Sod等均不在L-异亮氨酸的合成途径上,表明L-Ile的高产原因并非通过增强关键酶的表达来实现,可能存在其他的调控机制。
综上所述,为了进一步提高发酵法生产L-Ser的效率,今后L-Ser代谢工程研究的工作重点在于(1)采用分子手段,在保证菌体正常生长代谢的情况下,进一步降低丝氨酸羟甲基转移酶SHMT的酶活,减少L-Ser向L-Gly的转化量,促进L-Ser在胞内的积累;(2) L-Ser转运系统的分子鉴定以及通过缺失L-Ser吸收转运蛋白的编码基因或过量表达L-Ser分泌转运蛋白的编码基因,增加发酵培养液中L-Ser的积累效率;(3)通过组学分析技术探寻L-Ser合成代谢中的潜在限速因子,并采取针对性的分子改造措施加以消除;(4)分子改造磷酸葡萄糖转移酶系统(PTS)和乙酸合成途径,调控菌株对葡萄糖的吸收速率,减少副产物乙酸等的积累,进而提高L-Ser的转化得率;(5)进一步从底物及其他营养因子的流加方式、发酵温度等方面优化L-Ser基因工程菌的发酵条件,实现L-Ser的高密度高效发酵,提高L-Ser的生产强度。
总之,巨大的市场潜力已经为L-Ser育种技术的发展提供了源源不断的动力,而DNA重组技术以及转录组学、代谢组学等代谢分析技术的不断进步,必然会加速推进微生物产L-丝氨酸的代谢工程研究。
| [1] | Becker J, Wittmann C. Systems and synthetic metabolic engineering for amino acid production-the heartbeat of industrial strain development[J]. Curr Opin Biotechnol, 2012, 23(5):718-726. |
| [2] | Mitsuhashi S. Current topics in the biotechnological production of essential amino acids, functional amino acids, and dipeptides[J]. Current Opinion in Biotechnology, 2014, 26 :38-44. |
| [3] | Stolz M, Peters-Wendisch P, Etterich H, et al. Reduced folate supply as a key to enhanced L-serine production by Corynebacterium glutamicum[J]. Appl Environ Microbiol, 2007, 73(3):750-755. |
| [4] | Shen PH, Chao HJ, Jiang CJ, et al. Enhancing production of L-serine by increasing the glyA gene expression in Methylobacterium sp. MB200[J]. Appl Biochem Biotechnol, 2010, 160(3):740-750. |
| [5] | Keda M, Takeno S. Amino acid production by Corynebacterium glutamicum[J]. Corynebacterium Glutamicum Microbiology Monographs, 2013, 23 :107-147. |
| [6] | Zhu GY, Zhu X, Wan XL, et al. Hydrolysis technology and kinetics of poultry waste to produce amino acids in subcritical water[J]. J Anal Appl Pyrolysis, 2010, 88(2):187-191. |
| [7] | Effenberger F, Zoller G. Amino acids ;13 :Investigations on the synthesis of DL-serine from α-haloacrylic acid derivatives[J]. Tetrahedron, 1988, 44(17):5573-5582. |
| [8] | Jiang W, Xia BJ, Huang JJ, et al. Characterization of a serine hydroxymethyltransferase for L-serine enzymatic production from Pseudomonas plecoglossicida[J]. World Journal of Microbiology and Biotechnology, 2013, 29(11):2067-2076. |
| [9] | Grant GA, Xu XL, Hu ZQ. The relationship between effector binding and inhibition of activity in D-3-phosphoglycerate dehydrogenase[J]. Protein Science, 2008, 8(11):2501-2505. |
| [10] | Schneider F, Krämer R, Burkovski A. Identification and characterization of the main β-alanine uptake system in Escherichia coli[J]. Appl Microbiol Biotechnol, 2004, 65(5):576-582. |
| [11] | Kim YM, Ogawa W, Tamai E, et al. Purification, reconstitution, and characterization of Na+/serine symporter, SstT, of Escherichia coli[J]. The Journal of Biochemistry, 2002, 132(1):71-76. |
| [12] | Na D, Park JH, Jang YS, et al. Systems metabolic engineering of Escherichia coli for chemicals, materials, biofuels, and pharmaceuticals[J]. Systems Metabolic Engineering, 2012, 5 :117-149. |
| [13] | Ogawa W, Kayahara T, Tsuda M, et al. Isolation and characterization of an Escherichia coli mutant lacking the major serine transporter, and cloning of a serine transporter gene[J]. The Journal of Biochemistry, 1997, 122(6):1241-1245. |
| [14] | Hsieh JM, Besserer GM, Madej MG, et al. Bridging the gap : A GFP-based strategy for overexpression and purification ofmembrane proteins with intra and extracellular C-termini[J]. Protein Science, 2010, 19(4):868-880. |
| [15] | Shao ZQ, Lin RT, Newman EB. Sequencing and characterization of the sdaC gene and identification of the sdaCB operon in Escherichia coli K12[J]. Eur J Biochem, 1994, 222(3):901-907. |
| [16] | Simic P, Sahm H, Eggeling L. L-threonine export :use of peptides to identify a new translocator from Corynebacterium glutamicum[J]. J Bacteriol, 2001, 183(18):5317-5324. |
| [17] | Bell JK, Pease PJ, Bell JE, et al. De-regulation of D-3- phosphoglycerate dehydrogenase by domain removal[J]. Eur J Biochem, 2002, 269(17):4176-4184. |
| [18] | Grant GA, Hu ZQ, Xu XL. Identification of amino acid residues contributing to the mechanism of cooperativity in Escherichia coli D-3-phosphoglycerate dehydrogenase[J]. Biochemistry, 2005, 44(51):16844-16852. |
| [19] | Grant GA. Transient kinetic analysis of L-serine interaction with Escherichia coli D-3-phosphoglycerate dehydrogenase containing amino acid mutations in the hinge regions[J]. Biochemistry, 2011, 50(14):2900-2906. |
| [20] | Peters-Wendisch P, Netzer R, Eggeling L, et al. 3-Phosphoglycerate dehydrogenase from Corynebacterium glutamicum :the C-terminal domain is not essential for activity but is required for inhibition by L-serine[J]. Appl Microbiol Biotechnol, 2002, 60 :437-441. |
| [21] | Peters-Wendisch P, Stolz M, Etterich H, et al. Metabolic engineering of Corynebacterium glutamicum for L-serine production[J]. Appl Environ Microbiol, 2005, 71 :7139-7144. |
| [22] | 来书娟, 张芸, 刘树文, 等. 产L-丝氨酸谷氨酸棒杆菌的代谢 工程改造和代谢流分析[J]. 中国科学:生命科学, 2012, 42 (4):295-303. |
| [23] | Li Y, Chen GK, Tong XW, et al. Construction of Escherichia coli strains producing L-serine from glucose[J]. Biotechnology Letters, 2012, 34(8):1525-1530. |
| [24] | 张晓娟, 窦文芳, 许泓瑜, 等. 维生素对谷氨酸棒杆菌SYPS- 062 直接发酵合成L-丝氨酸的影响[J]. 中国生物工程杂志, 2007, 27(5):50-55. |
| [25] | 魏东, 谭慧林, 杨海燕, 等. L-丝氨酸高产菌株的选育和摇瓶 发酵条件优化[J]. 氨基酸和生物资源, 2006, 28(1):46- 48. |
| [26] | Park JH, Lee KH, Kim TY, et al. Metabolic engineering of Escherichia coli for the production of L-valine based on transcriptome analysis and in silico gene knockout simulation[J]. Proc Natl Acad Sci USA, 2007, 104(19):7797-7802. |
| [27] | Park JH, Jang YS, Lee JW, et al. Escherichia coli W as a new platform strain for the enhanced production of L-valine by systems metabolic engineering[J]. Biotechnology and Bioengineering, 2011, 108(5):1140-1147. |
| [28] | Yin L, Shi F, Hu F, et al. Increasing L-isoleucine production in Corynebacterium glutamicum by overexpressing global regulator Lrp and two-component export system BrnFE[J]. Journal Applied Microbiology, 2013, 114(5):1369-1377. |
| [29] | Yin LH, Hu XQ, Xu DQ, et al. Co-expression of feedback-resistant threonine dehydratase and acetohydroxy acid synthase increase L-isoleucine production in Corynebacterium glutamicum[J]. Metabolic Engineering, 2012, 14(5):542-550. |
| [30] | Zhao ZJ, Zou C, Zhu YX, et al. Development of L-tryptophan production strains by defined genetic modification in Escherichia coli[J]. J Ind Microbiol Biotechnol, 2011, 38 :1921-1929. |
| [31] | Zhao ZJ, Chen S, et al. Effect of gene knockouts of L-tryptophan uptake system on the production of L-tryptophan in Escherichia coli[J]. Process Biochemistry, 2012, 47(2):340-344. |
| [32] | Wiriyathanawudhiwong N, Iwao O, Li ZD, et al. The outer membrane TolC is involved in cysteine tolerance and overproduction in Escherichia coli[J]. Applied Microbiology and Biotechnology, 2009, 81(5):903-913. |
| [33] | Tatarko M, Romeo T. Disruption of a global regulatory gene to enhance central carbon flux into phenylalanine biosynthesis in Escherichia coli[J]. Curr Microbiol, 2001, 43(1):26-32. |
| [34] | Nakahigashi K, Toya Y, Ishii N, et al. Systematic phenome analysis of Escherichia coli multiple-knockout mutants reveals hidden reactions in central carbon metabolism[J]. Molecular Systems Biology, 2009, 5(1):1-14. |
| [35] | Lee KH, Park JH, Kim TY, et al. Systems metabolic engineering of Escherichia coli for L-threonine production[J]. Molecular Systems Biology, 2007, 3(149):1-8. |
| [36] | 赵志军. L-色氨酸生产菌株的构建及代谢调控研究[D]. 无锡: 江南大学, 2011. |
| [37] | Yin LH, Hu X, Wang X. Proteomic analysis of L-isoleucine production by Corynebacterium glutamicum[J]. Journal of Pure and Applied Microbiology, 2013, 8(2):1-10. |




