毒死蜱是一种世界范围内广泛使用的有机磷杀虫剂,早在1965年毒死蜱就被引入美国市场并且广泛应用于农业生产和家庭害虫的防治[1]。2008年1月,我国政府彻底禁止了对硫磷等5种高毒有机磷农药的生产和使用,毒死蜱作为高毒有机磷农药的替代品应用日益广泛[2]。毒死蜱的大规模应用,也使其逐渐成为人体健康和环境污染研究领域的重点关注对象。尽管毒死蜱属于中等毒性农药,但是其对多数水生生物仍具有较高毒性,一些发达国家已经开始禁用或者限制使用毒死蜱[3]。
农作物病虫害防治过程中,使用的农药大部分会进入农田土壤,并且通过渗透、排水等方式转移至地下水或河流,造成水体污染[4]。有研究指出,在相对集中的玉米种植区,径流水带入河水中的毒死蜱浓度可达0.1 μg/L[5],大豆种植区地表水毒死蜱浓度最高达10.8 μg/L[6],而在肯尼亚的Naivasha湖中毒死蜱的浓度高达26.6 μg/L[7]。由于毒死蜱在水中降解的速度缓慢,且会随着水体的转移而造成二次污染,因此其在水中的残留会对水生生物及其他生物造成潜在的危害。
斑马鱼具有体型小、易于培养、产卵量大、胚胎易于观察和显微操作等特点,并且斑马鱼胚胎和幼鱼对有害物质非常敏感,因此常用于研究环境物质对发育的影响及作用机制[8, 9, 10]。基于这些优势,斑马鱼已经成为一种公认的发育生物学和毒理学研究模式生物。由于毒死蜱在水环境中具有难以降解的特性,因此水生模式生物斑马鱼也成为本研究的理想模型。本研究首先胁迫处理人子宫内膜癌细胞(HEC-1B)进行流式细胞分析,确定低浓度毒死蜱的内分泌干扰物效应,然后分析毒死蜱对斑马鱼的急性毒性和可能的神经发育毒性,旨在探究水环境残留的毒死蜱所具有环境生物学效应。 1 材料与方法 1.1 材料 1.1.1 化学试剂
毒死蜱(O,O-二乙基-O-3,5,6-三氯-2-吡啶基硫代磷酸酯,chlorpyrifos,CPF)购自于中国山东省天成生物科技有限公司,纯度≥ 98%;17β-雌二醇(E2)购自于Sigma公司,纯度≥ 98%。荧光染料碘化丙啶(Propidium Iodide,PI)购自于Sigma公司。MEM细胞培养液、牛血清、胰酶、PBS购自BD公司。本研究中其他化学试剂均属于分析纯级别,各种试剂先配制母液保存,使用前配制相应浓度的工作液。 1.1.2 实验材料
本研究使用的AB型野生斑马鱼购自于国家斑马鱼资源中心(China Zebrafish Resource Center,CZRC),人子宫内膜癌细胞株HEC-1B购自于中国医学科学院肿瘤细胞库。 1.2 方法 1.2.1 癌细胞的培养和处理
HEC-1B在MEM培养液中采用开放式单层贴壁培养,培养条件为37℃,5% CO2,饱和湿度。加受试物前4 d将细胞用PBS洗涤后改为在无酚红MEM培养液中培养,目的是耗尽细胞内储存的雌激素。设置空白对照组,雌激素对照组(E2):终浓度为0.05 ppm;毒死蜱梯度处理组(CPF):终浓度分别为0.05、0.01和0.005 ppm。将HEC-1B细胞接种于5 mL培养瓶,培养24 h待细胞贴壁后,加入受试物处理72 h,用胰酶消化收集细胞,充分吹打,制成单细胞悬液。 1.2.2 细胞周期分析
使用PI(碘化丙啶)染色法检验细胞周期。收集胰酶消化的HEC-1B细胞,使用预冷70%乙醇于4℃固定一晚。离心收集细胞,使用50 μg/L的PI溶液4℃避光染色30 min,PBS洗涤两遍后40 μm筛网过滤,制成单细胞悬液。使用流式细胞仪(BD FACSJazz,USA)在488 nm波长下观察细胞周期分布及亚二倍体细胞所占比例,每个样本检测3次。数据使用流式细胞分析软件FlowJow 7.6.1分析。 1.2.3 斑马鱼养殖
本研究使用的AB型野生斑马鱼,其养殖方法和胚胎收集按照本实验室的传统方法进行。即野生型(AB品系)斑马鱼养殖在封闭的贯流系统(北京爱生公司)中,自来水经过活性炭过滤,控制水温(28±0.5)℃,光照黑暗比例14:10。斑马鱼每天喂食3次,食物为丰年虫幼虫。将产卵用的成鱼按照2:1的比例装入盒中准备收集受精卵。挑选发育正常(无畸形)的0.5-1.0 hpf的胚胎,随机分装于一次性培养皿中(50/个)。 1.2.4 毒死蜱对斑马鱼的毒性测试
以定时更换处理液的方式,使用毒死蜱对斑马鱼胚胎进行毒性处理,设计4个毒死蜱实验浓度,分别为0、1.00、2.00、3.00和4.00 ppm,每个浓度3个平行处理,每个处理的培养皿中分别加入50个发育正常的胚胎和40 mL处理液。由于毒死蜱难溶于水,易溶于有机溶剂这一特征,故选用丙酮作为助溶剂。在处理液中,丙酮的最高浓度为0.1%。我们以前的研究表明,低浓度(<0.1%)的丙酮不会影响实验结果。 1.2.5 斑马鱼胚胎形态学观察
毒死蜱暴露处理后,每12 h对斑马鱼胚胎进行一次镜检(奥林巴斯公司,日本)观察。将斑马鱼胚胎放入加有3%亚甲基纤维素的双凹载玻片中,明场观察并且拍照记录。统计分析胚胎的孵化率、畸形率和死亡率。 1.2.6 神经系统相关基因的表达
毒死蜱暴露处理后,收集胚胎并且加入TRIzol试剂-80℃保存。每种浓度的胚胎分别取30枚保存,一式3份。使用TRIzol试剂提取总RNA,总RNA浓度在260 nm下估算,质量则通过OD260/OD280比率验证。使用0.8%琼脂糖凝胶电泳、溴化乙锭染色进行总RNA的进一步验证。单链cDNA的合成按照试剂盒(PrimeScriptTM RT reagent Kit with gDNA Eraser,TaKaRa,Japan)说明书进行。以β-actin作为内参调整数据,使用Primer Premier 5软件设计引物(表 1),PCR扩增程序为:95℃ 10 min;95℃ 30 s,57℃ 30 s,72℃ 1 min。基因表达的差异倍数通过2-ΔΔCt方法计算。3组平行均进行表达量检测。
使用Levene检验方法检测数据的方差齐性,并且使用SPSS19.0(美国SPSS公司)进行单因素方差分析(one-way ANOVA)和Duncan法多重比较分析。认定P<0.05作为统计显著性的标准,所有值表示方法均为平均值±标准误(x±s)。 2 结果 2.1 低浓度毒死蜱的毒性 2.1.1 毒死蜱对HEC-1B细胞周期的影响
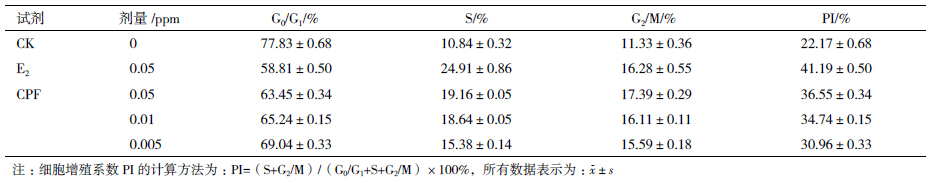
为了进一步研究毒死蜱的内分泌干扰效应,选用人子宫内膜癌细胞(HEC-1B)进行胁迫处理。考虑到癌细胞的耐受性,因此选用相对较低的浓度进行暴露处理。通过碘化丙啶染色和流式细胞仪检测,并且通过FlowJow分析。对照组的细胞增殖系数PI(proliferous index,PI)为22.17,雌二醇E2对照组PI为41.19,毒死蜱0.05、0.01和0.005 ppm处理组的增殖系数PI分别为36.55、34.74和30.96(表 2)。对比各组增值系数,E2 > CPF0.05 > CPF0.01 > CPF0.005 > CK。
考虑到毒死蜱在水环境中的溶解度仅为1.2 ppm,因此使用较低的实验浓度。使用梯度浓度CPF (0、0.10、0.25、0.50、0.75和1.00 ppm)暴露处理斑马鱼胚胎48 h后,出现了一个有趣的现象,即处理组胚胎比对照组快,并且胚胎的孵化率与暴露浓度成正比(未发表),同时低浓度处理组很少出现胚胎发育畸形。 2.2 高浓度毒死蜱的毒性 2.2.1 毒死蜱对斑马鱼的致死作用
采用梯度浓度的毒死蜱(0、1.00、2.00、3.00和4.00 ppm)对斑马鱼胚胎进行处理,每12 h进行一次处理液更换和胚胎观察,记录各时段胚胎及幼鱼的存活情况,对正常幼鱼和死亡幼鱼进行拍照记录(图 1-A和图 1-B)。处理60 h后,毒死蜱0、1.00、2.00、3.00和4.00 ppm处理组存活率分别为98.9%、91.1%、48.4%、37.8%和23.3%(图 1-C)。
 |
| 图 1 毒死蜱的致死作用 |
梯度浓度的毒死蜱处理胚胎时,处理48 h后孵化的幼鱼就会出现体轴弯曲、心包囊肿等畸形现象(图 2-A和图 2-B),统计该时段的幼鱼出现各畸形的数目并计算平均畸形率。处理48 h后,毒死蜱0、1.00、2.00、3.00和4.00 ppm处理组体轴弯曲的比例分别为3.3%、14.6%、23.9%、37.1%和36.8%(图 2-C),即随着浓度的提高,斑马鱼幼鱼出现畸形的比例也随之提高。而心包囊肿的畸形现象出现的比例相对较低,并且该现象出现的时间相对较晚。
 |
| 图 2 毒死蜱的致畸作用 |
考虑到毒死蜱具有神经毒性,因此选取斑马鱼的5种神经发育标志基因作为参考,从基因的转录水平探究其神经发育毒性。使用60 h半致死浓度的毒死蜱(2.00 ppm)处理斑马鱼胚胎48 h后,收集胚胎,提取总RNA进行荧光定量PCR分析,得到各组基因表达量变化。本研究选取的神经标志基因包括neurog1、elavl3、nkx2.2a、nestin和gfap,相对于空白对照组分别上调1.30、0.58、1.46、1.58和0.42倍(图 3)。
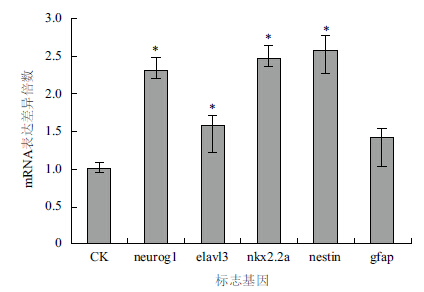 |
| 图 3 神经标志基因mRNA表达量的变化 |
随着毒死蜱的广泛应用,对其毒理的研究也越来越多样化。2007年美国环保署(US EPA)公布首批73种化学物质进行内分泌干扰物检测(Endocrine Disruptor Screening Program,EDSP),其中就包括毒死蜱[11]。内分泌干扰物(endocrine disrupting chemicals,EDCs)是指干扰生物体内维持内稳态及调节生殖、发育过程的天然激素的正常体内代谢过程的外源性物质[12],包括农药、洗涤剂、杀菌剂、化妆品、合成雌激素等一系列化合物[13]。一些研究表明,毒死蜱对雄性小鼠具有内分泌干扰效应,导致精子异常或死亡[14]。同时,毒死蜱也会对雌性小鼠生殖器官造成永久伤害[15]。而在我们之前的研究中,低浓度的毒死蜱能加快斑马鱼胚胎的孵化,可能是毒死蜱的一种内分泌干扰效应。为了验证毒死蜱的这种作用,本研究选用人子宫内膜癌细胞HEC-1B进行低浓度毒死蜱胁迫处理,结果发现毒死蜱处理组的细胞增殖系数高于空白对照组,并且同等浓度下其增殖效应不及雌二醇,即毒死蜱具有类雌激素的作用,因此证明毒死蜱具有内分泌干扰物效应。
动物实验是有毒物质毒性测试、新药开发等过程中的一个重要环节[16]。本研究选用的模式生物斑马鱼,其胚胎发育早期对环境毒性物质具有相当强的敏感性,并且产生不同的形态学病变[17, 18, 19]。在本研究中,梯度浓度的毒死蜱处理斑马鱼胚胎后,其存活率随着处理浓度的上升而降低,并且60 h的半致死浓度约为2 ppm。毒死蜱不仅会导致斑马鱼胚胎的死亡,还会造成存活胚胎发育的畸形,并且这种畸形的比例与处理浓度正相关。斑马鱼毒性测试结果表明,高浓度的毒死蜱对斑马鱼具有较强的毒性,并且会导致斑马鱼胚胎的死亡和发育畸形。
研究表明,毒死蜱及其代谢产物能够抑制乙酰胆碱酶,从而阻止乙酰胆碱的降解,造成神经递质在突触的累积,导致持久的受体刺激和神经相关信号通路的异常[20, 21],这也是毒死蜱毒杀害虫的主要方式。研究发现,毒死蜱能够影响小鼠脑部的发育、造成小鼠中枢神经系统损伤[22, 23]。同时,应用基因芯片技术对处理前后的大鼠脑干和前脑进行转录谱分析,发现差异基因主要参与神经细胞的生长、分化,神经递质合成等过程[24]。因此,为了判断毒死蜱对斑马鱼的神经系统的发育毒性,本研究选取了5种斑马鱼神经系统发育相关的标志基因,试图从转录水平进行探究。neurog1(ngn1)是神经前体细胞的标志基因,在斑马鱼胚胎受精24 h后主要分布于前脑、中脑、后脑、脊髓、耳部和鳃背基板处[25]。elavl3是最早期的神经元标志物之一,在神经系统广泛表达,是神经元决定的标志[26]。nkx2.2a在哺乳动物和斑马鱼的背腹侧神经系统的形成与功能中起重要作用[27]。nestin是一种中等纤维蛋白,它在哺乳动物神经前体细胞中高表达,已被广泛用作神经前体细胞的标志分子[28]。gfap为神经胶质细胞的标志基因,于胚胎受精12 h后在脑中表达,15 h至成鱼在神经胶质细胞中持续表达[29]。而本研究中,2 ppm毒死蜱处理斑马鱼胚胎48 h后,5种标志基因的mRNA表达量基本都出现明显上调,造成神经系统发育相关基因的表达紊乱,从而影响神经系统正常发育,也可能是造成斑马鱼胚胎出现畸形的原因。 4 结论
低浓度的毒死蜱具有内分泌干扰效应,能够加速胚胎的孵化脱膜,同时也能提高癌细胞的增殖系数,促进细胞的生长和分裂。通过斑马鱼的急性毒理研究,证明水环境中高浓度的毒死蜱主要表现为神经毒性,能够造成胚胎的畸形和死亡,并且显著影响神经系统相关基因的表达量。
| [1] | Juberg DR,Gehen SC,Coady KK,et al.Chlorpyrifos:weight of evidence evaluation of potential interaction with the estrogen,androgen,or thyroid pathways[J].Regul Toxicol Pharmacol,2013,66(3):249-263. |
| [2] | 王川,周巧红,吴振斌.有机磷农药毒死蜱研究进展[J].环境科学与技术,2011,34(7):123-127. |
| [3] | Smith JN,Hinderliter PM,Timchalk C,et al.A human life-stage physiologically based pharmacokinetic and pharmacodynamic model for chlorpyrifos:development and validation[J].Regul Toxicol Pharmacol,2014,69(3):580-597. |
| [4] | 吴长兴,赵学平,吴声敢,等.丘陵地区水稻田使用毒死蜱对水体的污染及其生态风险[J].生态与农村环境学报,2011,27(3):108-112. |
| [5] | Ferenczi J,Ambrus A,Wauchope RD,et al.Persistence and runoff losses of 3 herbicides and chlorpyrifos from a corn field in the Lake Balaton watershed of Hungary[J].J Environ Sci Health B,2002,37(3):211-224. |
| [6] | Marino D,Ronco A.Cypermethrin and chlorpyrifos concentrationl e v e l s i n s u r f a c e w a t e r b o d i e s o f t h e P a m p a O n d u l a d a,Argentina[J].Bull Environ Contam Toxicol,2005,75:820-826. |
| [7] | Otieno PO,Schramm KW,Pfister G,et al.Spatial distribution and temporal trend in concentration of carbofuran,diazinon and chlorpyrifos ethyl residues in sediment and water in Lake Naivasha,Kenya[J].Bull Environ Contam Toxicol,2012,88:526-532. |
| [8] | Engeszer RE,Patterson LB,Rao AA,et al.Zebrafish in the wild:a review of natural history and new notes from the field[J].Zebrafish,2007,4(1):21-40. |
| [9] | Segner H.Zebrafish (Danio rerio) as a model organism for investigating endocrine disruption[J].Comp Biochem Physiol C Toxicol Pharmacol,2009,149(2):187-195. |
| [10] | Parng C.In vivo zebrafish assays for toxicity testing[J].Curr Opin Drug Discov Devel,2005,8(1):100-106. |
| [11] | US EPA 2007a.United States Environmental Protection Agency.Draft list of initial pesticide active ingredients and pesticide inerts to be considered for screening under the Federal Food,Drug,and Cosmetic Act Federal Register,2007,72(116):33486-33503. |
| [12] | Diamanti-Kandarakis E,Bourguignon JP,Giudice LC,et al.Endocrine-disrupting chemicals:an Endocrine Society scientific statement[J].Endocr Rev,2009,30(4):293-342. |
| [13] | Mills LJ,Chichester C.Review of evidence:are endocrinedisrupting chemicals in the aquatic environment impacting fish populations?[J].Sci Total Environ,2005,343(1-3):1-34. |
| [14] | Farag AT,Radwan AH,Sorour F,et al.Chlorpyrifos induced reproductive toxicity in male mice[J].Reprod Toxicol,2010,29(1):80-85. |
| [15] | Nishi K,Hundal SS.Chlorpyrifos induced toxicity in reproductive organs of female Wistar rats[J].Food Chem Toxicol,2013,62:732-738. |
| [16] | Mangipudy R,Burkhardt J,Kadambi VJ.Use of animals for toxicology testing is necessary to ensure patient safety in pharmaceutical development[J].Regul Toxicol Pharmacol,2014,70(2):439-441. |
| [17] | Parker T,Libourel PA,Hetheridge MJ,et al.A multi-endpoint in vivo larval zebrafish (Danio rerio) model for the assessment of integrated cardiovascular function[J].J Pharmacol Toxicol Methods,2014,69(1):30-38. |
| [18] | Beasley A,Elrod-Erickson M,Otter RR.Consistency of morphological endpoints used to assess developmental timing in zebrafish (Danio rerio) across a temperature gradient[J].Reprod Toxicol,2012,34(4):561-567. |
| [19] | Scholz S.Zebrafish embryos as an alternative model for screening of drug-induced organ toxicity[J].Arch Toxicol,2013,87(5):767-769. |
| [20] | Pope C,Karanth S,Liu J.Pharmacology and toxicology of cholinesterase inhibitors:uses and misuses of a common mechanism of action[J].Environ Toxicol Pharmacol,2005,19(3):433-446. |
| [21] | Eaton DL,Daroff RB,Autrup H,et al.Review of the toxicology of chlorpyrifos with an emphasis on human exposure and neurodevelopment[J].Crit Rev Toxicol,2008,38(Suppl 2):1-125. |
| [22] | Venerosi A,Calamandrei G,Ricceri L.A social recognition test for female mice reveals behavioral effects of developmental chlorpyrifos exposure[J].Neurotoxicol Teratol,2006,28(4):466-471. |
| [23] | Canadas F,Cardona D,Davila E,et al.Long-term neurotoxicity of chlorpyrifos:spatial learning impairment on repeated acquisition in a water maze[J].Toxicol Sci,2005,85(2):944-951. |
| [24] | Slotkin TA,Seidler FJ.Comparative developmental neurotoxicity of organophosphates in vivo:transcriptional responses of pathways for brain cell development,cell siavgnaling,cytotoxicity and neurotransmitter systems[J].Brain Res Bull,2007,72(4-6):232-274. |
| [25] | Quinones HI,Savage TK,Battiste J,et al.Neurogenin 1(Neurog1) expression in the ventral neural tube is mediated by a distinct enhancer and preferentially marks ventral interneuron lineages[J].Dev Biol,2010,340(2):283-292. |
| [26] | Fan CY,Cowden J,Simmons SO,et al.Gene expression changes in developing zebrafish as potential markers for rapid developmental neurotoxicity screening[J].Neurotoxicol Teratol,2010,32(1):91-98. |
| [27] | Pauls S,Zecchin E,Tiso N,et al.Function and regulation of zebrafish nkx2.2a during development of pancreatic islet and ducts[J].Dev Biol,2007,304(2):875-890. |
| [28] | Xue XJ,Yuan XB.Nestin is essential for mitogen-stimulated proliferation of neural progenitor cells[J].Mol Cell Neurosci,2010,45(1):26-36. |
| [29] | Bernardos RL,Raymond PA.GFAP transgenic zebrafish[J].Gene Expr Patterns,2006,6(8):1007-1013. |