绿脓杆菌(Pseudomonas aeruginosa),又名铜绿假单胞菌,自然界分布广泛,常存在于人与动物的皮肤和肠道上,是一种人兽共患病原菌。当动物体重大疾病创伤、免疫缺陷,以及身体烧伤后,易诱发该病的感染[1, 2]。目前,由于抗生素的大量使用,绿脓杆菌耐药性不断提高,对该菌感染的治疗产生一定的影响[3, 4]。研究发现免疫原性较强的绿脓杆菌外膜蛋白有OprF (Outer membrane lipoprotein)、OprI和OprH[5]。其中,OprF为细胞外膜孔道蛋白,具有两种不同大小的孔径结构,在抗生素耐药性和维持细胞稳定性上起重要作用[6];可激活机体特异性免疫反应,从而抵抗绿脓杆菌的感染[7, 8],在疫苗上具有很好的应用前景[9]。
本实验利用分子克隆方法获得绿脓杆菌OprF原核表达菌株;纯化OprF蛋白,制备和鉴定OprF蛋白多克隆抗体;并对OprF进行系统进化分析,旨在为OprF蛋白功能与疫苗开发研究奠定基础。
1 材料与方法 1.1 材料 1.1.1 菌株与载体P.aeruginosa PAO1菌株,E.coli DH5α菌株,E.coli BL21菌株,pET-28a质粒均由陕西理工学院生物化学分子实验室保存。
1.1.2 实验动物昆明鼠购于汉中市动物交易中心。
1.1.3 试剂蛋白胨、IPTG、酵母粉,以及琼脂糖购于西安沃尔森生物技术有限公司;Taq酶、T4 DNA连接酶、限制性内切酶、Protein Marker,以及DNA Marker均为宝生物公司产品;基因组提取试剂盒、质粒提取试剂盒为西安沃尔森生物技术有限公司;胶回收试剂盒为上海生物工程公司;引物合成、基因序列测定均由西安沃尔森生物技术有限公司完成;山羊抗小鼠IgG二抗购于Sigma公司。
1.2 方法 1.2.1 重组质粒的构建根据NCBI公布的绿脓杆菌基因序列,设计oprF基因引物:Primer 1:5'-ACAGGATCCATGAAACTGAAGAACACC-3';Primer 2:5'-AGTCTCGAGTTACTTGGCTTCAGCTTC-3',下划线分别为限制性内切酶位点BamH I和Xho I。50 μL的PCR反应体系:PCR反应缓冲液5 μL,模板DNA 2 μL,10 mmol/L dNTP 2 μL,25 μmol/L引物各1 μL,Taq酶0.5 μL,补水至50 μL。PCR反应条件为:94℃预变性3 min;94℃变性30 s,55℃退火45 s,72℃延伸45 s,30个循环;72℃充分延伸10 min;最后16℃保温。采用0.8%琼脂糖凝胶电泳检测PCR片段大小,胶回收试剂盒回收目的DNA片段。再将PCR产物与pET-28a质粒载体利用BamH I和Xho I双酶切后,T4 DNA连接酶16℃连接过夜,转化E.coli DH5α,提取重组质粒进行BamH I和Xho I双酶切鉴定及测序鉴定,检验正确后转化E.coli BL21表达菌株,制备OprF原核表达菌株。
1.2.2 重组蛋白的表达检测将鉴定正确的OprF表达菌株单克隆过夜培养,以1:100倍转接入新鲜的LB培养基中,待OD600≈0.6时,加入终浓度0.5 mmol/L IPTG诱导培养5 h,离心收集1 mL菌体,加入200 μL上样缓冲液,沸水中煮样5 min,上样10 μL,SDS-PAGE蛋白电泳检测OprF蛋白表达情况。
1.2.3 重组蛋白的纯化由于OprF的表达蛋白主要以包涵体形式存在,因此采用SDS-PAGE蛋白电泳切胶纯化OprF比较合适,主要步骤为:大量培养获得OprF表达菌株,加入50 mmol/L Tris-HCl (pH7.4)缓冲液超声破碎,沉淀用洗涤液(含0.05% Triton X-100的Tris-HCl溶液)洗涤后,将包涵体溶解于8 mol/L尿素溶液中;进行SDS-PAGE蛋白电泳,切下目的条带,研钵中研磨后加入蛋白浸提液(含0.1% SDS的Tris-HCl溶液),4℃浸提过夜,离心收集上清,加入1:4(V/V)的丙酮沉淀蛋白,离心除去丙酮后加入50 mmol/L Tris-HCl (pH7.4)的蛋白溶解液,最后取适量溶液电泳检测蛋白的纯度与浓度。
1.2.4 重组蛋白的复性SDS-PAGE电泳切胶纯化获得的OprF蛋白无生物学活性,可采用尿素浓度梯度的方法复性蛋白,主要步骤为:将纯化的OprF蛋白溶解于8 mol/L尿素溶液,置透析袋中,再将其放入含6 mol/L尿素的50 mmol/L Tris-HCl (pH7.4)中,4℃放置4 h;接着依次为4、2、1和0.5 mol/L尿素,最后置于50 mmol/L Tris-HCl (pH7.4)中,4℃放置4 h;然后离心取上清溶液,取2 μL溶液进行SDSPAGE蛋白电泳检测。
1.2.5 重组蛋白小鼠多克隆抗体的制备选用约5周龄的雄性昆明鼠6只,每只免疫纯化的OprF蛋白50 μg/每次。首次免疫采用弗氏完全佐剂,之后均采用弗氏不完全佐剂。将佐剂与OprF蛋白充分乳化,直至冰水中不扩散为止。首次免疫10 d后进行第2次免疫,7 d后进行第3次加强免疫。第3次免疫7 d后,小鼠眼球取血的方法获得血清,置于4℃冰箱中过夜析出,离心取上清,最后将血清保存于-80℃冰箱中备用。
1.2.6 ELISA法检测抗体效价利用ELISA酶联法检测抗血清效价,主要步骤为:将复性的OprF蛋白溶解至0.05 μg/μL,于对应的96孔板中加入100μL,37℃作用1 h,排空液体,加入200 μL封闭液,37℃孵育2 h,然后每孔加100 μL不同稀释度的小鼠一抗血清(对照加入PBS溶液),并且同一稀释度血清采用3个重复;37℃孵育30 min;洗涤后加入100 μL二抗,37℃孵育30 min;加入50 μL底物A (双氧水)与50 μL底物B (TMB)的混合液,37℃避光显色10 min,最后加入终止液,450 nm读数[10]。
1.2.7 Western blotting法检测抗体特异性Western blotting显色方法检测小鼠OprF抗血清特异性[11]。为消除pET-28a质粒上自带的His标签蛋白所产生抗体的影响,采用绿脓杆菌OprF蛋白进行特异性检测。主要步骤为:收集培养的绿脓杆菌,加入上样缓冲液,沸水中煮样5 min,上样10 μL进行蛋白电泳,然后转NC膜,与不同稀释度的小鼠抗血清(对照加入阴性抗血清)相作用,洗涤后,加入二抗孵育,最后DAB显色,确定OprF抗血清的特异性。
1.2.8 OprF蛋白序列系统发生分析根据NCBI数据库公布的细菌OprF蛋白氨基酸序列,利用DNA MAN软件进行同源性分析;通过MEGA5.02软件,并结合Neighbour-Joining方法构建系统发生树[10]。
2 结果 2.1 重组质粒的构建以绿脓杆菌基因组为模板,进行PCR扩增oprF基因。获得约1 053 bp的基因片段,与目的基因大小一致(图 1)。将pET-28a质粒与PCR产物进行双酶切后,连接酶连接转化E.coli DH5α菌株,提取重组质粒,双酶切检测获得约1 053 bp片段(图 2),与目的基因大小一致。此外,重组基因的测序结果显示与NCBI公布的基因序列一致。
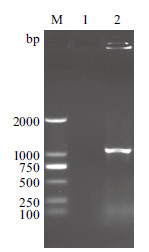 |
| M:DNA Marker;1:阴性对照;2:oprF基因 图 1 绿脓杆菌oprF 基因PCR 扩增 |
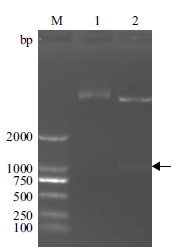 |
| M:DNA Marker;1:oprF重组质粒;2:oprF重组质粒BamH I和Xho I双酶切 图 2 OprF 重组质粒的双酶切检测 |
将检测确认的含有OprF重组质粒的菌株经过IPTG诱导,SDS-PAGE电泳获得约38 kD的蛋白条带,重组蛋白表达大小情况与预期一致;并利用SDSPAGE蛋白电泳切胶的方法获得OprF蛋白,经尿素梯度复性获得纯化的OprF蛋白(图 3)。
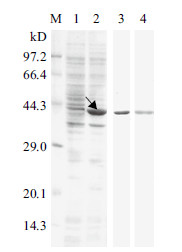 |
| M:蛋白Marker;1:未诱导菌株;2:IPTG诱导菌株;3:SDS-PAGE切胶纯化的OprF蛋白;4:复性纯化的OprF蛋白 图 3 OprF 蛋白的表达与纯化 |
测将纯化的OprF蛋白免疫小鼠,获得的抗血清经ELISA法检测。结果(图 4)表明,其抗体效价达到1:12 800倍。
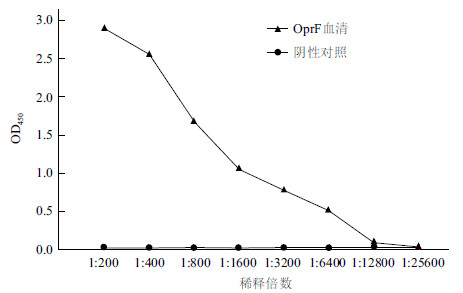 |
| 图 4 OprF 多克隆抗体效价的检测 |
利用Western blotting显色技术,发现绿脓杆菌株与不同稀释度的OprF抗血清作用后有蛋白条带显现,而对照组未出现(图 5),表明OprF小鼠多克隆抗体特异性较好。
 |
| A:1:200倍稀释的抗血清;B:1:400倍稀释的抗血清;C:1:800倍稀释的抗血清;D:阴性对照(1:200倍稀释的血清) 图 5 Western blotting 检测OprF 多克隆抗体特异性 |
利用DNAMAN软件,对NCBI公布的10种细菌的OprF蛋白氨基酸序列进行同源性分析,结果(图 6)发现不同的细菌OprF存在较高的同源性,尤其C端不同种细菌同源性更高;假单胞菌属细菌的同源性明显高于其它属细菌(食烷菌)。采用MEGA软件构建的OprF系统进化树结果(图 7)显示,假单胞菌属的亲缘关系相对于食烷菌更近。
 |
| 图 6 OprF 蛋白氨基酸序列的多重比对 |
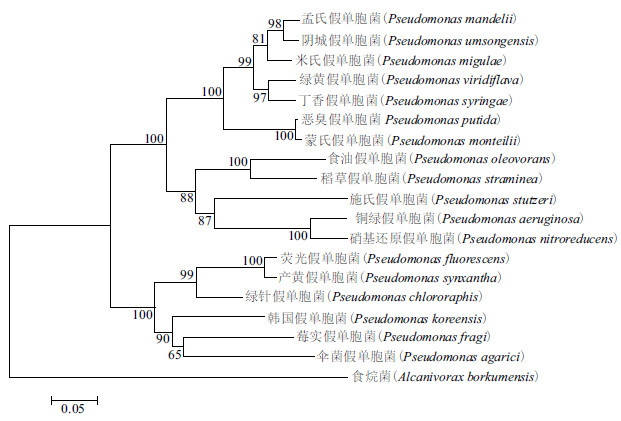 |
| 图 7 MEGA 软件构建的OprF 氨基酸序列系统进化 |
绿脓杆菌是医院感染最常见的条件致病菌之一[12, 13],其耐药性的不断增加,给防治带来一定的困难[14]。OprF为绿脓杆菌主要外膜蛋白之一,具有很强的免疫原性[5, 15],动物免疫实验表明其激活机体产生的特异性免疫能有效抵抗绿脓杆菌的感染[7, 8];且自身无耐药性等特点[16, 17],在疫苗上具有研究价值。然而,获得抗体是OprF蛋白免疫学功能研究的基础。有实验成功制备了OprF的单克隆抗体,但制备程序复杂[18],某些实验也无需使用单抗。多克隆抗体以其成本低、周期短及效果好等优点得到广泛运用[19]。目前,使用原核表达蛋白免疫小鼠制备多克隆抗体仍是最常见的手段之一[20]。本实验利用分子方法获得OprF原核表达载体,纯化OprF蛋白,并成功制备与鉴定多克隆抗体;但获得的抗体滴度较低,因而采用多只小鼠免疫的方式,以抵消滴度低的影响。为进一步研究OprF蛋白免疫学功能奠定基础。
OprF蛋白具有重要的生物学功能,在遗传进化上具有相对保守性。本研究通过OprF系统进化研究证实不同菌株的氨基酸序列具有很高的同源性,并且C端同源性更高,这可能与其执行特定的功能有关;研究还证实假单胞菌属细菌的同源性高于其他属的细菌。这些发现为OprF蛋白的交叉免疫保护作用研究提供依据。因而,可结合后续的免疫攻毒保护实验,为开发广谱抑菌的OprF蛋白疫苗制剂研究奠定基础。
4 结论利用分子克隆方法获得绿脓杆菌外膜蛋白OprF表达菌株;通过SDS-PAGE电泳切胶纯化、尿素梯度复性获得OprF蛋白,免疫小鼠制备OprF蛋白多克隆抗体。ELISA法结果显示,OprF抗血清滴度达1:12 800倍,Western blotting证实抗血清具有很好的特异性。采用DNAMAN软件对OprF序列同源性分析发现其C端在不同细菌间存在较高同源性;MEGA软件对OprF的系统发生分析发现假单胞菌属细菌的亲缘关系高于其它属细菌。
| [1] | Zhu X, Ma Z, Wang J, et al. Importance of tryptophan in transforming an amphipathic peptide into a Pseudomonas aeruginosa-targeted antimicrobial peptide[J]. PLoS One, 2014, 9(12):e114605. |
| [2] | Tanideh N, Rokhsari P, Mehrabani D, et al. The healing effect of licorice on Pseudomonas aeruginosa infected burn wounds in experimental rat model[J]. World J Plast Surg, 2014, 3(2):99- 106. |
| [3] | 胡凯. 铜绿假单胞菌的分布及耐药性分析[J]. 现代预防医学, 2014, 41(21):3999-4001. |
| [4] | 董哲, 高成生. 铜绿假单胞菌注射液对结肠部分切除大鼠免 疫系统影响的研究[J]. 中国现代医学杂志, 2011, 21(33): 4132-4134. |
| [5] | Krause A, Whu WZ, Xu Y, et al. Protective anti-Pseudomonas aeruginosa humoral and cellular mucosal immunity by AdC7- mediated expression of the P. aeruginosa protein OprF[J]. Vaccine, 2011, 29(11):2131-2139. |
| [6] | Sugawara E, Nagano K, Nikaido H. Alternative folding pathways of the major porin OprF of Pseudomonas aeruginosa[J]. FEBS J, 2012, 279(6):910-918. |
| [7] | Peluso L, de Luca C, Bozza S, et al. Protection against Pseudomonas aeruginosa lung infection in mice by recombinant OprF-pulsed dendritic cell immunization[J]. BMC Microbiol, 2010, 10(9): 1741-1752. |
| [8] | Ding B, von Specht BU, Li Y. OprF/I-vaccinated sera inhibit binding of human interferon-gamma to Pseudomonas aeruginosa[J]. Vaccine, 2010, 28(25):4119-4122. |
| [9] | Krause A, Whu WZ, Qiu J, et al. RGD capsid modification enhances mucosal protective immunity of a non-human primate adenovirus vector expressing Pseudomonas aeruginosa OprF[J]. Clin Exp Immunol, 2013, 173(2):230-241. |
| [10] | 刘祥. 溶藻弧菌附着定植因子ACFA 原核载体构建、表达条 件优化及多克隆抗体制备[J]. 华北农学报, 2015, 30(1): 35-41. |
| [11] | 刘祥, 李惠. 大肠埃希菌外膜蛋白OmpA 表达质粒构建和诱 导条件优化[J]. 生物技术, 2013, 23(4):32-36. |
| [12] | 刘祥. 铜绿假单胞菌外膜蛋 F 原核载体构建、表达条件优化 及免疫保护作用研究[ J]. 中国现代医学杂志, 2015, 25:2-16. |
| [13] | 李群, 杨洪江, 林书祥, 等. 铜绿假单胞菌重金属离子耐受性 调查及相关机制的研究[J]. 生物技术通报, 2013(6):160- 166. |
| [14] | 陈春琳, 刘祥, 王成祥, 等. 铜绿假单胞菌外膜蛋白I 的原核 表达、纯化及免疫保护作用研究[J]. 生物技术通报, 2015, 31(7):207-213. . |
| [15] | Westritschnig K, Hochreiter R, Wallner G, et al.A randomized, placebo-controlled phase I study assessing the safety and immunogenicity of a Pseudomonas aeruginosa hybrid outer membrane protein Opr F/Ivac cine(IC43) in healthy volunteers[J]. Hum Vaccin Immunother, 2014, 10(1):170- 183. |
| [16] | Stryjewska A, Kiepura K, Librowski T, et al. Biotechnology and genetic engineering in the new drug development Part Ⅱ monoclonal antibodies, modern vaccines and gene therapy[J]. Pharmacological Reports, 2013, 65(5):1086-1101. |
| [17] | Zhang L, Cai D, Zhao X, et al. Liposomes containing recombinant gp85 protein vaccine against ALV-J in chickens[J]. Vaccine, 2014, 32(21):2452-2456. |
| [18] | 王燕, 窦恒利, 陈世敏, 等. 抗铜绿假单胞菌外膜蛋白F 单克 隆抗体制备及夹心ELISA 检测方法的建立[J]. 细胞与分子 免疫学杂志, 2010, 26(9):880-883. |
| [19] | 刘祥, 陈春琳, 牟欢, 等. 重组人骨硬化蛋白的表达、纯化及 多克隆抗体制备[J]. 生物技术, 2014, 24(6):68-72. |
| [20] | 刘祥. 小鼠骨形成蛋白BMP3 的原核表达及多克隆抗体制备 与鉴定[J]. 华北农学报, 2015, 30(3):8-13. |




