薯蓣(Dioscorea opposite Thunb)是薯蓣科(Dioscoreaceae)薯蓣属(Diosorea L.)单子叶缠绕藤本植物,广泛分布于热带至温带地区,是西非、东南亚和南美的主要粮食和经济作物。小花盾叶薯蓣(Dioscorea parviflora C.T.Ting),又名苦良姜,是云南省特有的薯蓣种类,主要分布于金沙江河谷流域。因其薯蓣皂甙含量较高,具有较高的药用价值,近年来,大量的小花盾叶薯蓣野生资源受到严重破坏。为了提高商品价值,该品种在云南省已形成规模化种植。但薯蓣常以营养繁殖方式连续多年进行栽培,薯蓣病害发生严重,尤其以病毒病的发生更为明显[1]。
薯蓣褪绿坏死花叶病毒(yam chlorotic necrotic mosaic virus,YCNMV)是近年来从云南小花盾叶薯蓣分离到的一个新病毒,属于马铃薯Y病毒科(Potyviridae)柘橙病毒属(Macluravirus)成员[2, 3]。目前,柘橙病毒属共收录有7个病毒,其中6个确定种,1个暂定种,YCNMV被国际病毒命名委员会(ICTV)确定为该病毒属的暂定成员[3]。
国际上检测植物病毒主要从病毒生物学特征(例如,病毒颗粒形态、长度、宿主范围及感病植株症状等)、血清学以及分子生物学角度进行鉴别[4]。但薯蓣样品常存在着复合侵染情况[5],单纯从植物病征难以进行准确有效的判断;同时,薯蓣叶片含有大量的皂苷、多糖等物质,对RNA的提取技术及成本要求较高,为该病毒的检测带来很多困难。因此,为了能快速有效的检测该病毒及进一步确定该病毒的分类学地位,本实验克隆YCNMV病毒的CP基因,并通过基因工程的方法构建原核表达载体,获得该病毒的CP融合蛋白,经免疫注射新西兰白兔制备抗血清,旨在建立起相对敏感、特异、可靠的血清学检测体系,为该病毒的检测提供帮助。
1 材料与方法 1.1 材料实验用毒源由本实验室采自云南永胜县,并保存于实验室无虫温室大棚内由专人负责管理与维护。pET-30a原核表达载体由本实验室保存于-80℃冰箱;DH5α菌株、BL21(DE3)菌株、rTaq酶、Easysee Western Marker等购自北京全式金生物技术有限公司;EcoR V、Hind III内切酶以及T4连接酶等购自Fermentas公司;DL5000 Marker、质粒抽提试剂盒、胶纯化回收试剂盒、M-MLV Reverse Transcriptase、Ribonuclease Inhibitor、IPTG、pMD19-T simple克隆载体及X-Gal、LA Taq DNA聚合酶购自TaKaRa公司;40%丙烯酰胺购自北京鼎国生物公司;羊抗兔IgG购自ABcam;Tris-base、EDTA-Na2+、甘油、Tryptone、Yeast extract及透析袋等其他常用试剂均购自Sigma公司;Ni-NTA+Agarose亲和纯化柱购自QIAGEN公司;引物由上海捷瑞生物工程有限公司及Invitrogen上海合成部进行合成;菌液送南京金斯瑞生物科技有限公司测序。
1.2 方法 1.2.1 薯蓣总RNA的提取及cDNA的合成薯蓣总RNA按照RNeasy Plant mini (QIAGEN公司)试剂盒所述方法提取,以NanoDrop检测OD260/280并在1.5%浓度的变性琼脂糖凝胶电泳以确定提取RNA的质量,符合标准的样品于-80℃冻存备用。以M4T (5'-GTTTTCCCAGTCACGAC (T)15-3')引物进行反转录,共两步。反转录第一步体系如下:1 μL M4T引物;5 μL模板RNA (185 ng/μL);共计6 μL反应液于70℃孵育10 min后冰浴急冷2 min。第二步体系如下:6 μL第一步反应液;2 μL 5×M-MLV Buffer;0.5 μL dNTP Mixture (10 mmol/L each);0.25 μL RNase Inhibitor (40 U/μL);0.5 μL M-MLV反转录酶(200 U/μL);0.75 μL RNase free ddH2O,以上共计10 μL反应液,于42℃反应1 h,70℃反应15 min,反应产物于-80℃冰箱冻存。
1.2.2 pET30a-CP原核表达载体的构建根据前期工作中以Sprimer/M4引物对[6]扩增获得的YCNMV病毒3'端序列(数据未提供),由上海捷瑞生物工程公司合成如下引物:CP-F:5'-GCAGATATCATGG ATCTTACAGCGCCAG-3';CP-R:5'-GCAAAGCTTTTA ATATAAGGCTGGACGC-3'(下划线部分分别为EcoR V及Hind III酶切位点)。以稀释10倍后的cDNA为模板,采用TaKaRa公司LA Taq DNA聚合酶按照使用说明书上所述体系进行PCR扩增。扩增产物经1.5%(W/V)琼脂糖凝胶100 V电泳60 min分离后,以TaKaRa公司胶纯化回收试剂盒精确切取目的条带回收,具体操作参照试剂盒所述步骤进行。纯化产物与pMD19-T simple按照说明书所述比例于16℃过夜连接后转化DH5α感受态细胞,经蓝白斑筛选及菌液PCR进行初步验证后,提取阳性单克隆质粒送南京金斯瑞公司测序以验证质粒序列。将验证序列无误的质粒及pET-30a空载体以EcoR V及Hind III按说明书所述体系分别进行双酶切后纯化回收目的片段与酶切后的pET30a载体,T4连接酶进行连接后,将pET30a-CP载体转化到BL21(DE3)感受态细胞,再经过菌液PCR及pET30a-CP质粒测序验证无误后,获得含有pET30a-CP载体的表达菌株。
1.2.3 CP基因的诱导表达体系的优化及蛋白纯化转化后的表达菌先以不同浓度IPTG、不同诱导时间进行诱导以摸索最佳诱导表达条件并对该融合蛋白的溶解性进行分析。最终诱导表达产物经10% SDSPAGE电泳后,以考马斯亮蓝G-250染色检测结果。诱导表达的蛋白使用Ni+-NTA Agarose亲和纯化柱进行纯化后,分别以70、100、200和300 mmol/L咪唑梯度洗脱,确定最佳洗脱条件。洗脱蛋白以透析袋和PBS缓冲液(pH7.4)进行透析,透析蛋白经NanoDrop检测浓度及质量后冻存于-80℃冰箱。
1.2.4 抗血清的制备、效价检测及Western blotting检测纯化后的蛋白经过定量检测后,免疫2只新西兰白兔(2-2.5 kg),每2-3周进行一次皮下免疫(免疫抗原400 μg/次),共免疫4次,待效价大于1:50 000时进行采血制备抗血清,冻存于-80℃冰箱备用。获得的抗血清以ABcam公司的羊抗兔-HRP作为二抗,以ID-ELISA检测其效价(效价=样品OD/空白OD≥2.1,即P/N≥2.1时的最高稀释度,包被抗原浓度5 μg/mL,100 μL/孔),并通过Western blotting检测其与抗原蛋白结合的特异性情况[7]。
1.2.5 样品植株的ID-ELISA检测将样品叶片以1:10 000(W/V)的比例,以包被缓冲液PBST进行稀释后,研磨,经短暂离心后取上清100 μL/孔加入到酶标板中,以制备的兔抗作为一抗,辣根过氧化物酶标记的羊抗兔IgG为二抗进行ID-ELISA检测,最后以TMB显色并测定OD值,计算P/N。
2 结果 2.1 YCNMV CP基因的克隆及原核表达载体的构建以RNeasy Plant mini (QIAGEN)试剂盒可获得高质量的总RNA (图 1),可以用于后续试验。以设计的CP基因特异引物CP-F及CP-R可扩增到800 bp左右的特异性条带,该条带与预期大小相符(图 2)。将该条带切胶纯化并插入到pMD19-T simple克隆载体中,测序结果表明,该分离物CP基因核苷酸序列为867 nt,序列能通读,能正确翻译氨基酸序列,连接在载体中的CP基因序列与预测的CP基因核苷酸和氨基酸序列同源性均为99.65%(图 3和图 4),即获得的CP基因序列与预期序列基本一致。该克隆载体经双酶切后,将CP基因插入到pET-30a原核表达载体,测序结果表明,核苷酸序列与之前测定序列一致。说明已成功构建了YCNMV-CP基因的原核表达载体。
 |
| M:TaKaRa DL5000 DNA Marker;1:RNA样品 图 1 薯蓣总RNA 样品琼脂糖凝胶电泳 |
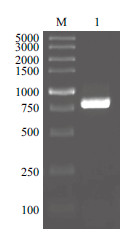 |
| M:TaKaRa DL5000 DNA Marker;1:CP基因RT-PCR产物 图 2 CP 基因RT-PCR 扩增产物琼脂糖凝胶电泳 |
 |
| 图 3 连接到pMD19-T Simple 上的CP 核苷酸序列与模板序列比对结果 |
 |
| 图 4 载体中CP 蛋白与模板CP 蛋白氨基酸序列比对 |
将成功构建的pET30a-CP原核表达载体转化BL21(DE3)菌株进行诱导表达,初步确立诱导表达体系为0.8 mmol/L IPTG,以28℃诱导6 h,同时分析融合蛋白的溶解性。SDS-PAGE结果(图 5)表明,表达的融合蛋白多数以包涵体的形式集中在沉淀部分,而上清中仅存在相对较少的表达蛋白。诱导表达产物经离心后,上清液中的融合蛋白经Ni+-NTA亲和层析柱纯化后,以PBS缓冲液(pH7.4)进行透析,以NanoDrop检测,单次纯化蛋白浓度为0.192-0.231 mg/mL。
 |
| M:Low protein marker;L:表达菌裂解液;P:沉淀;S:上清;1,2:纯化的蛋白样品 纯化蛋白溶解度及纯度的SDS-PAGE 电泳分析图 5 |
制备的抗血清通过ID-ELISA检测效价,结果表明该抗血清在稀释1:256 000时,P/N=2.2,表明该抗血清效价为1:256 000,可以用于后续检测(表 1)。Western blotting (图 6)分析表明,制备的抗体仅与抗原蛋白产生特异条带,而免疫前血清(CK-)在相同位置无条带。
 |
| M:Easysee Western Marker;CK:免疫前血清;1-3:稀释10倍后的不同纯化CP蛋白样品 图 6 CP 蛋白抗血清的Western blotting 检测 |
以制备的抗血清对采自云南省境内丽江、鹤庆、维西、映华、禄丰及永胜等地共计101个表现出褪绿、坏死等症状的薯蓣病叶样品研磨液进行ID-ELISA检测(图 7)并测定其吸光度值。检测出映华(6株)、禄丰(2株)及永胜(5株)等3地共计13个样品ID-ELISA结果显示为阳性(P/N≥2.1)。筛选出的阳性样品经电镜及RT-PCR检测后证实该样品内确实含有YCNMV病毒。
 |
| 1-5:不同地点采集的薯蓣样品,其中1号样品检测为阳性,其余为阴性;Blank:空白对照;CK+:CP纯化蛋白,阳性对照;CK-:健康本氏烟叶片研磨液,阴性对照 图 7 不同地区样品的ID-ELISA 检测结果 |
薯蓣褪绿坏死花叶病毒(YCNMV)是近年来在小花盾叶薯蓣中新发现的柘橙病毒属病毒,属于马铃薯Y病毒科。目前仅见该病毒侵染薯蓣,尚未发现该病毒侵染其他物种的报道,鲜见与该病毒相关的其他研究报道。薯蓣是我国一种重要的药材,同时也是深受群众喜爱的一种食材。因此近年来在云南省大理、禄丰等多地已经形成规模化种植。但由于薯蓣是多年生草本缠绕植物,常采用无性繁殖的方式年复一年地进行种植,这为该型病毒的繁殖、扩散提供了良好的条件,同时也对薯蓣的品质与产量带来了不利影响。因此,构建针对该型病毒稳定、可靠的血清学检测体系对后续检测、研发、抗病等工作极为重要。
本实验以RT-PCR及克隆的方法,构建了含有YCNMV CP基因的原核表达载体。通过对该型病毒CP基因进行的序列比对及分析发现,该型病毒分离物仅在CP蛋白N端第17-19位氨基酸残基中存在与其亲缘关系较近的Chinese yam necrotic mosaic virus (CYNMV)中的"DKG "结构域相似的" SKG结构域[8],该结构域是否也与先前报道的存在于马铃薯Y病毒科中高度保守的"DAG "行使相同或相似功能尚不得而知。其他保守序列,如" NGTS (140-143 aa)及"AFDF"(217-220 aa)[9]均在该型病毒CP蛋白中出现。
外源基因在大肠杆菌内进行原核表达时,由于多种因素的存在,如短时间内形成高浓度多肽,导致蛋白无法正确折叠等,极易使表达的蛋白形成包涵体并沉淀[10]。这对后续的蛋白纯化工作造成了很大影响,导致单次纯化的蛋白量大大减少。通过对表达蛋白的溶解状态分析,以及不同诱导表达体系的摸索,实验确立了优化后以较低温度(28℃)、较长时间(6 h)及较高浓度IPTG (0.8 mmol/L)进行诱导表达的体系,促进了CP融合蛋白在大肠杆菌内的可溶性表达。
在抗血清的制备方面,目前,通过电镜负染观察已发现球状、杆状、线状等多种不同类型病毒复合侵染同一株小花盾叶薯蓣的情况(数据未提供),且对于含有大量多糖多酚类物质的植株来说很难提纯病毒[11, 12]。因此,以纯化病毒粒子来制备抗血清的传统方案并不适用。目前,已有诸多通过表达病毒CP基因融合蛋白免疫动物以制备抗血清的研究报道[13, 14, 15, 16, 17]证明,该方法可靠、有效。本研究通过进行RT-PCR、构建原核表达载体、诱导pET30a-CP融合蛋白的表达及纯化、制备抗血清、后续检测筛选等相关工作,成功制备出可用于检测YCNMV的抗血清并应用到样品筛查中,为后续的研究奠定了基础。
4 结论通过构建原核表达载体的方法获得了能够正确表达YCNMV CP基因的大肠杆菌表达菌株。该表达菌表达的融合蛋白经纯化后免疫新西兰大白兔,制备效价较高的抗血清,检测表明该抗血清可以有效地检测到病样中的YCNMV病毒,初步建立起了可用于检测YCNMV的ELISA检测体系。
| [1] | 梁艳丽, 赵庆云, 杨燕, 等. 盾叶薯蓣细胞工程技术研究进 展[J]. 中国农学通报, 2004, 20(4):30-32. |
| [2] | Wang JG, Zou XJ, Zheng HY, et al. Molecular characterization of a new macluravirus from yam in Yunnan, China[J]. Archives of Virology, 2009, 154(8):1379-1380. |
| [3] | King AM, Adams MJ, Lefkowitz EJ, et al. Virus taxonomy : classification and nomenclature of viruses :Ninth Report of the International Committee on Taxonomy of Viruses[M]. San Diego : Elsevier, 2012. |
| [4] | 张京宣, 曹秀芬, 宋涛, 等. 植物病毒检测技术研究进展分 析[J]. 花卉中草药, 2011(30):79-80. |
| [5] | 李明军, 张峰, 陈明霞, 等. 怀山药病毒病的研究[J]. 中草药, 2004, 34(11):3-5. |
| [6] | Chen J, Adams MJ. A universal PCR primer to detect members of the Potyviridae and its use to examine the taxonomic status of several members of the family[J]. Archives of Virology, 2001, 146(4): 757-766. |
| [7] | Hirano S. Western blot analysis. In Nanotoxicity[M]. Totowa : Humana Press, 2012. |
| [8] | Kondo T, Fujita T. Complete nucleotide sequence and construction of an infectious clone of Chinese yam necrotic mosaic virus suggest that macluraviruses have the smallest genome among members of the family Potyviridae[J]. Archives of Virology, 2012, 157(12): 2299-2307. |
| [9] | Shukla DD, Ward CW, Brunt AA. The potyviridae[M]. Wallingford :Cab International, 1994. |
| [10] | Vallejo LF, Rinas U. Strategies for the recovery of active proteins through refolding of bacterial inclusion body proteins[J]. Microbial Cell Factories, 2004, 3(1):1-12. |
| [11] | 洪霓, 王国平, 于济民, 等. 苹果茎沟病毒的分离纯化及血清 学检测[J]. 中国农业科学, 1997, 30(5):6-12. |
| [12] | 洪霓. 苹果褪绿叶斑病毒提纯及抗血清制备技术研究[J]. 中国果树, 1999(1):15-18. |
| [13] | 陈立伟, 宗晓娟, 王文文, 等. 樱桃病毒A 外壳蛋白基因克隆 及其原核表达[J]. 中国农学通报, 2012, 28(13):195-199. |
| [14] | 王亚娇, 任堂雨, 刘艳, 等. 小麦矮缩病毒外壳蛋白基因的原 核表达, 抗体制备及应用[J]. 植物病理学报, 2013, 43(4): 362-367. |
| [15] | 陈文华, 韦传宝, 贾玉成, 等. 大豆花叶病毒CP 基因原核表 达与抗血清制备[J]. 生物技术通报, 2009(10):98-101. |
| [16] | 杨宇, 韦传宝, 华俊雅, 等. 大蒜A 病毒CP 基因的原核表达 及抗血清制备[J]. 生物技术通报, 2011(7):139-142. |
| [17] | 王洪星, 龚殿, 孙玉娟, 等. 高粱花叶病毒外壳蛋白的原核表 达及其抗血清制备[J]. 生物技术通报, 2013(1):167-171. |





