肿瘤免疫逃逸是阻碍抗肿瘤免疫治疗的一大障碍,巨噬细胞通过其表面表达的Fc受体对包括肿瘤在内的靶细胞行使吞噬作用,是抗体发挥细胞毒作用(antibody dependent cell-mediated cytotoxicity,ADCC)的主要效应细胞。在抗肿瘤免疫反应中,巨噬细胞发挥吞噬作用涉及巨噬细胞识别靶细胞表面的促吞噬( "eat me" )和抗吞噬( "don't eat me" )信号[1]。巨噬细胞及树突状细胞表面表达信号调节蛋白α(Signal regulatory protein alpha,SIRPα),与一种广泛表达的跨膜蛋白CD47结合[2],使得巨噬细胞启动抗吞噬信号,从而避免了对正常细胞的攻击。
CD47又叫整合素相关蛋白(integrin associated protein,IAP),是一个50 kD的膜表面蛋白,表达广泛,属于免疫球蛋白超家族成员,具有IgV样胞外结构域和5个跨膜区以及1个短的胞质尾[2]。CD47可以结合整合素和凝血栓蛋白-1(thrombospondin-1,TSP-1),参与多种生理和病理过程,包括细胞迁移[3],T细胞和DC的激活[4]以及轴突发育、细胞凋亡、增殖和炎症等。最近一系列研究报道抗CD47单克隆抗体可以阻断CD47-SIRPα信号通路,激活巨噬细胞的吞噬作用,在白血病和淋巴瘤以及肿瘤和实体瘤肿瘤动物模型中,都取得了良好的治疗效果[5, 6, 7, 8, 9, 10],表明CD47可以作为肿瘤治疗的理想靶点。
目前抗CD47的抗体研究主要集中在单克隆抗体。然而,大分子的单克隆抗体具有组织(如实体瘤)的穿透能力差、且难以结合位于细胞表面的蛋白裂隙中的表位(如受体和配体结合部位)的缺点。另外还有生产和储存成本高、价格昂贵等因素限制了这类药物在临床的广泛使用。
纳米抗体是1993年发现的一种仅存在于骆驼科动物中的天然重链抗体的可变区结构(variable domains of the HCAb,简称为VHH)[11],其分子量为15 kD,仅为全分子抗体的1/10,分子大小在纳米级,是目前可以得到的具有完整抗体功能的最小分子片段。这种纳米抗体的抗原结合区具有与常规单抗不同的结构[12],在空间上呈突出的指状结构,因此可以结合一些常规抗体无法接近的抗原表位,如位于受体裂隙中的配体结合部位[13]。这使得这类抗体具有较大的应用价值。
本研究为验证CD47重组蛋白能否在骆驼中激发高滴度的特异抗体,从而为构建骆驼淋巴细胞重链抗体基因表达文库提供材料,我们采用原核表达的人CD47胞外区片段作为抗原免疫骆驼,并检测骆驼免疫CD47后的体液免疫水平,以及骆驼多克隆抗体与Jurkat、Raji (均高表达CD47蛋白[7, 14])细胞表面表达的CD47蛋白的特异结合,为今后制备抗CD47的纳米抗体,进而研究其抗肿瘤作用提供实验基础。
1 材料与方法 1.1 材料 1.1.1 实验材料CD47的cDNA购自Sino Biologicai Inc;DH5α感受态细胞,BL21(DE3)感受态细胞购自天根生化科技(北京)有限公司。雄性新疆双峰驼一头,1年龄,本地区饲养。Raji细胞购自长沙赢润生物技术有限公司,Jurkat细胞由暨南大学生命科学技术学院馈赠。
1.1.2 试剂Ex Taq polymerse,限制性内切酶BamH Ⅰ、EcoRⅠ,T4 ligation购自宝生物工程(大连)有限公司;质粒小提试剂盒、琼脂糖凝胶回收试剂盒购自天根生化科技(北京)有限公司;Ni SepharoseTM 6 Fast Flow购自GE Healthcare公司;胎牛血清(fetal bovine serum,FBS)购自Life Science公司,Bradford法蛋白定量试剂盒购自北京百泰克生物技术有限公司;Mouse anti-CD47 IgG (B6H12)购自BD公司(中国);Rabbit anti-Llama IgG (H&L),Affinity Pure购自ImmunoReagents,Inc;抗His标签鼠源单克隆抗体,山羊抗鼠IgG (H&L)-HRP,山羊抗兔IgG (H&L)-HRP购自康为世纪;完全弗式佐剂及不完全弗式佐剂购自Sigma (中国);细胞膜抽提试剂盒购自碧云天公司;BeyoECL显色液购自Beyotime公司;其他常规试剂为进口或国产分析纯。
1.2 方法 1.2.1 CD47胞外区的扩增将含有CD47的cDNA的质粒转化至DH5α感受态细胞,通过培养细菌,提取质粒,作为PCR扩增CD47胞外区基因序列扩增的模板。根据CD47胞外区碱基序列设计引物:P1:5'-CCGGATCCCAGCTACTATTTAATAAAAC-3'(下划线为含有BamH Ⅰ酶切位点);P2:5'-CCCT CGAGGATTTTATAGCACAACAAAGT-3',(下划线为EcoR Ⅰ酶切位点)。PCR反应体系:ddH2O 13.5 μL,dNTP 2 μL,10×Ex Taq buffer 2 μL,P1 0.3 μL,P2、0.3 μL,TaKaRa Ex Taq 0.3 μL,质粒:1 μL,共20 μL。PCR反应条件:95℃ 5 min;95℃ 35 s,61℃ 35 s,72℃ 35 s,35个循环;72℃ 7 min。PCR产物经琼脂糖凝胶电泳回收纯化。
1.2.2 原核表达质粒的构建和鉴定回收纯化的目的片段用BamH Ⅰ和EcoR Ⅰ限制性内切酶进行双酶切。同时活化DH5α-pET30a菌种,挑取单克隆,提取质粒,用同样的限制性内切酶酶切pET30a。回收酶切的目的片段和载体经T4连接酶16℃过夜连接。最后连接产物转化至大肠杆菌DH5α感受态细胞。挑取转化的阳性克隆提取质粒,进行酶切和基因测序鉴定,重组质粒命名为DH5α-pET30a-CD47。
1.2.3 CD47蛋白的原核表达纯化及鉴定将测序正确的重组质粒转化至BL21(DE3)感受态细胞,37℃培养过夜;次日扎取单克隆,菌液PCR鉴定,按1%接菌到10 mL含有终浓度为50 μg/mL卡那霉素的LB培养基中,220 r/min震荡4 h;加IPTG使终浓度为1 mmol/L诱导4 h,取样经SDS-PAGE检测蛋白的表达。同时用Western blot检测诱导所得蛋白:一抗分别为抗His标签鼠源单克隆抗体,Mouse anti-CD47 IgG,稀释比例均为1:2 000;二抗为山羊抗鼠IgG (H&L)-HRP;稀释比例为1:5 000,ECL显色,Las4000检测。大量培养和诱导BL21-pET30a-CD47,用镍亲和层析柱纯化。
1.2.4 CD47蛋白免疫新疆双峰驼纯化的CD47蛋白经Bradford法测定浓度约为0.9 mg/mL。用纯化的蛋白免疫新疆双峰驼:每次免疫的量为0.44 mg,第一次免疫使用等体积的完全弗式佐剂,之后的6次加强免疫时加等量的不完全弗式佐剂,每14 d免疫1次,共免疫7次,采集免疫前和免疫后的骆驼血清,-20℃保存备用。
1.2.5 ELISA检测多克隆抗体的效价rCD47蛋白在96孔板中4℃包被过夜。对免疫前、后的骆驼血清,进行倍比稀释,作为一抗测定骆驼血清抗CD47蛋白的血清效价。二抗为兔抗美洲驼IgG (H&L),稀释比例为1:3 000;采用HRP-羊抗兔IgG (H&L)作为检测抗体(稀释比例为1:5 000)。底物为TMB,采用ECL检测,酶标仪中测定540 nm吸光值。1.2.6 Western blot检测多克隆抗体与细胞表面表达CD47的结合将Jurkat细胞接种于含10% FBS的1640培养基中,37℃,5.0% CO2培养。收集3×107个Jurkat细胞,利用细胞膜提取试剂盒抽提Jurkat细胞膜蛋白。用分离胶浓度为12%的SDS-PAGE分离蛋白,使用PVDF膜转膜,转膜条件为90 V,1 h。骆驼源多克隆抗体、Mouse anti-CD47 IgG (B6H12.2)为一抗;Rabbit anti-Llama IgG (H&L)、山羊抗鼠IgG (H&L)-HRP分别为二抗;山羊抗兔IgG (H&L)-HRP为三抗。ECL显色,Las4000检测。
2 结果 2.1 PCR扩增CD47胞外区基因片段将pGEM-CD47质粒作为模板,用CD47特异引物扩增该基因片段。CD47胞外区片段大小为363 bp (图 1)。
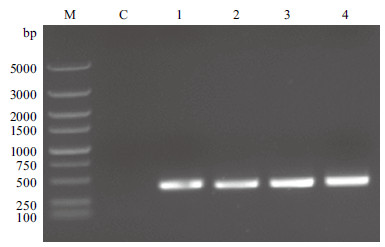 |
| M:DNA分子量标准;C:阴性对照;1-4:PCR扩增CD47基因片段 图 1 PCR 扩增CD47 胞外区基因片段 |
用限制性内切酶BamH Ⅰ和EcoR Ⅰ对重组质粒pET30a-CD47进行双酶切,出现一条线性载体条带和一条363 bp的目的条带(图 2),将酶切鉴定正确的重组质粒测序,结果表明插入的目的基因核苷酸序列完全正确。
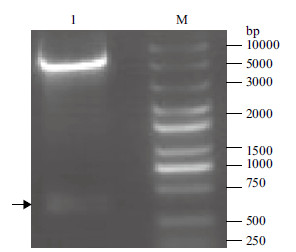 |
| M:DNA分子量标准;1:BamHⅠ/EcoRⅠ双酶切pET30a-CD47 图 2 重组表达质粒双酶切分析 |
将阳性克隆的重组子小量扩增后,用1 mmol/L的IPTG诱导,得到22 kD的重组蛋白(图 3),蛋白大小符合预期分子量。且经Western blotting检测(图 4-B),鉴定所得蛋白为CD47。进一步大量诱导菌体,经超声破碎后,检测到重组蛋白以包涵体形式表达。沉淀用含4 mol/L尿素的Tris-HCl溶解,通过镍亲和层析之后,重组蛋白纯度可达90%以上。
 |
| M:蛋白Marker;1:未诱导的菌体蛋白;2:诱导后的菌体总蛋白;3:超声破碎、12 000 r/min,10 min离心后的上清蛋白;4:超声破碎,离心后,用含4 mol/L尿素的Tris-HCl缓冲液溶解沉淀后的上清蛋白;5:纯化CD47蛋白过程中,最后一次洗涤杂蛋白的流川;6:纯化后的CD47蛋白 图 3 SDS-PAGE 检测CD47 蛋白表达 |
通过Western blotting检测重组蛋白CD47。结果(图 4-A)显示,纯化的CD47蛋白与抗His标签的单克隆抗体特异结合。经1 mmol/L IPTG诱导4 h的菌体总蛋和纯化的CD47蛋白均可与Mouse anti-CD47 IgG结合(图 4-B),而不与未诱导的菌体总蛋白结合。
 |
| M:蛋白Marker;1:未诱导的菌体蛋白;2:纯化的CD47蛋白;3:未诱导的菌体蛋白;4:纯化的CD47蛋白;5:IPTG诱导后,菌体及CD47粗蛋白 图 4 Western blotting 检测CD47 蛋白 |
利用重组蛋白免疫新疆双峰驼,获得了抗CD47的骆驼源多克隆抗体。取免疫前的血清和最后一次加强免疫后第4天收集的血清,通过ELISA测定抗体的效价。抗原CD47蛋白的包被量为5 μg/孔;骆驼来源的血清按1×103、2×103、1×104、2×104、1×105和2×105梯度稀释。结果(图 5)表明骆驼来源的抗体效价至少为1:200 000。
 |
| 图 5 ELISA 测定骆驼来源抗CD47 抗体的效价 |
Western blotting结果(图 6)表明,与抗CD47单抗B6H12.2一样,骆驼多克隆抗体既能与重组的CD47蛋白结合,也能与Jurka、Raji细胞表面CD47蛋白特异性结合。而未免疫的血清(图 6-A泳道1,6-B泳道3和4)与重组CD47和细胞表面表达的CD47均不结合。
 |
| M:蛋白Marker;1:未免疫血清;2:免疫血清;3,5,7:Jurkat细胞膜提取物;4,6,8:Raji细胞膜提取物 图 6 Western blotting检测骆驼多抗与rCD47(A)和细胞表面CD47蛋白(B)的结合 |
新疆双峰驼属于骆驼科骆驼属,该属目前仅存两种。除广泛分布于我国新疆、青海、内蒙等地以及蒙古的双峰驼外,还有分部于中亚地区和非洲北部的单峰驼。由于新疆双峰驼饲养方式多为放养,给免疫操作带来了困难。另外,根据我们和国外研究者的经验,并不是所有抗原都能在骆驼中激发高滴度抗体反应。Daley[15]发现,感染Parelaphostrongylus tenuis寄生虫的美洲驼不能产生保护性的抗体反应。为了获得高水平的抗CD47骆驼IgG,尤其是重链亚型的抗体,有必要分析其体液免疫水平。本研究采用重组CD47胞外区蛋白,经过对骆驼7次免疫后,在骆驼外周血中检测到了高滴度的抗CD47 IgG抗体(1:200 000),表明免疫策略是成功的,重组表达的CD47抗原在骆驼中具有较强的免疫源性。
CD47为5次跨膜蛋白,其氨基端116个氨基酸为胞外Ig样结构域,是结合SIRPα的主要区域[16],该区域也是抗体结合的主要位点。因此,本研究克隆和表达了这部分序列,作为免疫用抗原。但在最初大肠杆菌中表达人CD47胞外区蛋白时,表达量极低甚至不表达。考虑到大肠杆菌密码子的偏好性,我们对CD47的密码子进行了优化。优化后的CD47基因在大肠肝菌中获得了较高水平的表达,满足了免疫骆驼的要求。另外,尽管骆驼属于体型高大的动物,但国外报道用于免疫的抗原的剂量最少可低至50 μg/次[17]。本实验采用抗原剂量为0.44 mg/次,皮下单点或多点注射,激发了较高的抗体反应。今后在免疫骆驼时还可以对免疫用抗原剂量进行优化,以最大限度减少抗原的用量,并获得高水平的抗体反应。
4 结论本研究采用原核表达,并经过密码子优化后的人CD47胞外区抗原可以在骆驼体内诱导高滴度的抗体反应,免疫后的新疆双峰驼血清特异性结合CD47蛋白,可用于后续抗体基因文库的构建。免疫印迹检测表明抗CD47骆驼抗血清也可与Jurkat和Raji细胞表面高表达的CD47特异结合,表明新疆双峰驼是获得重链抗体的可靠宿主,也是制备重链抗体库的良好材料。
| [1] | Chao MP, Weissman IL, Majeti R. The CD47-SIRPα pathway in cancer immune evasion and potential therapeutic implications[J]. Curr Opin Immunol, 2012, 24(2):225-232. |
| [2] | Brown EJ, Frazier WA. Integrin-associated protein(CD47)and its ligands[J]. Trends Cell Biol, 2001, 11(3):130-1355. |
| [3] | Jaiswal S, Jamieson CH, Pang WW, et al. CD47 is upregulated on circulating hematopoietic stem cells and leukemia cells to avoid phagocytosis[J]. Cell, 2009, 138 :271-285. |
| [4] | Sarfati M, Fortin G, Raymond M, et al. CD47 in the immune response :Role of thrombospondin and sirp-alpha reverse signaling[J]. Curr Drug Targets, 2008, 9(10):842-850. |
| [5] | Poels LG, Peters D, van MY, et al. Monoclonal antibody against human ovarian tumor associated antigens[J]. J Natl Cancer Inst, 1986, 76 :781-791. |
| [6] | Chao MP, Alizadeh AA, Tang C, et al. Therapeutic antibody targeting of CD47 eliminates human acute lymphoblastic leukemia[J]. Cancer Res, 2011, 71 :1374-1384. |
| [7] | Chao MP, Alizadeh AA, Tang C, et al. Anti-CD47 antibody synergizes with rituximab to promote phagocytosis and eradicate non- Hodgkin lymphoma[J]. Cell, 2010, 142 :699-713. |
| [8] | Rendtlew Danielsen JM, Knudsen LM, Dahl IM, et al. Dysregulation of CD47 and the ligands thrombospondin 1 and 2 in multiple myeloma[J]. Br J Haematol, 2007, 138 :756-760. |
| [9] | Chan KS, Espinosa I, Chao MP, et al. Identification, molecular characterization, clinical prognosis, and therapeutic targeting of human bladder tumor-initiating cells[J]. Proc Natl Acad Sci, 2009, 106 :14016-14021. |
| [10] | Willingham SB, Volkmer JP, Gentles AJ. The CD47-signal regulatory protein alpha(SIRPa)interaction is a therapeutic target for human solid tumors[J]. Proc Natl Acad Sci, 2012, 109 (17):6662-6667. |
| [11] | Hamers-Casterman C, Atarhouch T, Muyldermans S, et al. Naturally occurring antibodies devoid of light chains[J]. Nature, 1993, 363(6428):446-448. |
| [12] | Serge M. Nanobodies :Natural single-domain antibodies[J]. Annual Review of Biochemistry, 2013, 82 :17.1-17.23 |
| [13] | De GE, Silence K, Decanniere K, et al. Molecular basis for the preferential cleft recognition by dromedary heavy- chain antibodies[J]. Proc Natl Acad Sci USA, 2006, 103(12): 4586-4591. |
| [14] | Zhao XW, Taco WK, Timo KB. targeting of CD47-SIRP? Enough for treating hematopoietic malignancy[J]. BLOOD, 2012, 119 : 18. |
| [15] | Daley LP, Gagliardo LF, Duffy MS, et al. Application of monoclonal antibodies in functional and comparative investigations of heavychain immunoglobulins in new world camelids[J]. Clin Diagn Lab Immunol, 2005, 12(3):380-386. |
| [16] | Barclay AN, Van den Berg TK. The interaction between Signal Regulatory Protein Alpha(SIRPα)and CD47 structure, function, and therapeutic target[J]. Annu Rev Immunol, 2013, 32 :25- 50. |
| [17] | Lauwereys M, Ghahroudi MA, Desmyter A, et al. Potent enzyme inhibitors derived from dromedary heavychain antibodies[J]. EMBO J, 1998, 17 :3512-3520. |




