因生理发育尚未成熟,幼龄畜禽消化能力弱,消化吸收饲料中营养成分能力低,从而影响生长[1]。饲料中添加外源酶可有效解决该问题。水解酶是催化水解反应酶的总称,是提高饲料消化率和利用率的重要酶之一[2]。如饲料中添加脂肪酶可促进脂肪的消化,释放出更多中链脂肪酸,还可促进脂溶性维生素等的吸收,提高饲料转化率[3]。除脂肪酶外,蛋白水解酶也可用作饲料添加剂,可催化多肽或蛋白质的水解,释放氨基酸,提高饲料中蛋白的消化吸收率,促进畜禽生长[4]。羧肽酶(Carboxypeptidases,CPs)是蛋白水解酶类,能从肽链的C端逐个降解、释放游离氨基酸[5]。将其添加在饲料中,能提高牲畜消化能力。但因CPs在动物胃中的酸性环境及内源消化酶(胃蛋白酶和胰蛋白酶)环境中存留时间较长,其稳定性受到较大影响[6, 7]。虽可使用适当的稳定剂降低这种影响,但有时因加工时间过长、温度过高仍会严重破坏其催化活性[8]。
为了满足CPs不断发展的应用需求,对于CPs特性提出更高的要求,尤其是耐酸性、抗蛋白酶特性。此特性可使CPs在无稳定剂保护下顺利通过胃部酸性环境,避免因加工对其活性的破坏。因此,获得具有耐酸、抗蛋白酶特性的CPs是目前的研究热点之一。CPs主要来源于微生物、植物和哺乳动物[9]。哺乳动物来源CPs由胰腺分泌至消化道后,经酸性食糜浸泡和内源消化酶降解后仍可帮助消化食物,具有催化活性[10],所以推测其具有耐酸、抗蛋白酶特性。有关耐酸抗蛋白酶特性检测的报道较多,如可利用模拟胃肠道模型[11],筛选具备耐酸、抗蛋白酶特性的木聚糖产生菌;采用人体胃肠道模型检测微生态菌株Lactobacillus acidophilus对胃酸和蛋白酶的抗逆能力[12]。哺乳幼崽消化器官不发达,消化机能不完善,如仔猪出生时胃内仅有凝乳酶,胃蛋白酶很少,且因胃底腺部缺乏游离盐酸,胃蛋白酶基本没有活性,而肠腺和胰腺发育较完善,胰蛋白酶活性较高[1]。哺乳动物胰脏中富含CPs,且有关来源于猪胰腺中CPs的报道较多。如赵莹[14]从猪胰脏中获得羧肽酶A,并将其基因在毕赤酵母中进行了外源表达;王福清等[15]报道了猪胰羧肽酶B的提取工艺和该酶的稳定性。
有报道称,羧肽酶A1(CPA1)具备耐酸抗蛋白酶特性。此外,该酶除能够水解蛋白质外,还能水解油脂,具备转酯功能。在以橄榄油为底物时,CPA1能催化油脂分解成游离脂肪酸。此功能使其催化底物范围明显大于只有单一催化活性的CPs。作为一种高效生物催化剂,酶具有专一性,不同的底物需要不同的酶催化分解。因饲料中含有多种营养成分,使用单一酶制剂难以达到理想的效果[16]。解决该问题方法较多,其中一种是获得具有多功能催化特性的酶制剂。在酸性环境下,丝氨酸羧肽酶具有末端蛋白水解酶、酯酶和脱酰胺酶的活性[19]。CPA1属于金属羧肽酶家族,CPA1具有多功能催化活性,且还具有耐酸抗蛋白酶特性,添加在饲料中能加快营养物质的消化、吸收利用,降低饲养成本。并有报道称猪CPA1基因已能在毕赤酵母表达,这为猪CPA1的大规模生产奠定了基础[14]。针对此特点,结合模拟胃肠道模型的方法,本实验采用pH2.0缓冲液模拟畜禽胃酸环境,40 U/mL胰蛋白酶模拟肠道内源消化酶环境[13],分别检测CPs的耐酸、抗蛋白酶特性。并对该酶水解蛋白特性和转酯功能特性进行较为细致的研究,对其耐酸抗蛋白酶特性进行研究,以期为今后该酶进一步研究和使用提供参考。
1 材料与方法 1.1 材料 1.1.1 羧肽酶粗酶液的制备取成年家猪新鲜胰脏500 g,搅肉机搅碎,与2-3倍体积pH7.0、50 mmol/L磷酸盐缓冲液混合,高速组织捣碎机中打碎,离心去残渣,取上清粗酶液4℃保存。
1.1.2 试剂与仪器实验中所用p-Nitrophenyl acetate、p-Nitrophenyl butyrate、p-Nitrophenyl decanoate、p-Nitrophenyl myristate、p-Nitrophenyl palmitate购自Sigma-Aldrich。猪胰蛋白酶购自生物工程(上海)股份有限公司。其余试剂均为国产或进口分析纯。AKTA purifier购自通用电气医疗集团。HiTrap Q HP,5Í5 mL购自GE Healthcare Life Sciences。
1.1.3 溶液0.2 mol/L Na2HPO4(甲液):称取Na2HPO4 28.4 g,用蒸馏水溶解并定容至1 000 mL。
0.2 mol/L NaH2PO4(乙液):称取Na2HPO4 24 g,用蒸馏水溶解并定容至1 000 mL。
50 mmol/L磷酸盐缓冲液(pH7.0):吸取甲液81 mL,乙液19 mL,即成为0.2 mol/L磷酸盐缓冲液。使用时用ddH2O稀释4倍,即成为50 mmol/L磷酸盐缓冲液,校正pH值为7.0。
20 mmol/L磷酸盐缓冲液(pH7.0):吸取甲液81 mL,乙液19 mL,即成为0.2 mol/L磷酸盐缓冲液。使用时用ddH2O稀释10倍,即成为20 mmol/L磷酸盐缓冲液,校正pH值为7.0。
1 mol/L NaCl溶液:称取58.5 g NaCl,加水800 mL,至全部溶解,定容至1 000 mL。
底物pNPB溶液:取pNPB溶解于10 mL异丙醇中,配置成3 mg/mL底物溶液。4℃保存。
2%聚乙烯醇溶液:称取20 g聚乙烯醇,加水900 mL,沸水中加热搅拌,直至全部溶解,冷却后定容至1 000 mL。
橄榄油乳化液:取橄榄油与2%聚乙烯醇溶液以1:3的比例混合,高速组织匀浆机10 000 r/min乳化6 min,分3次进行。
1.2方法 1.2.1羧肽酶活性的测定 1.2.1.1 Folin显色法取1 mL适当稀释的酶液,37℃水浴预热1 min,加入1 mL 1%酪蛋白溶液,37℃水浴保温10 min,迅速加入2 mL 0.4 mol/L三氯乙酸终止反应,室温静置15 min,10 000 r/min离心10 min,取上清1 mL,置于试管中,加入5 mL 0.4 mol/L Na2CO3溶液及1 mL福林酚工作液,测定680 nm吸光度。对照在加入酪蛋白溶液前先加入三氯乙酸,其余条件相同。将每分钟水解酪蛋白释放1 μg酪氨酸的酶量定义为一个蛋白酶活力单位[17]。
1.2.1.2 橄榄油滴定法取4 mL橄榄油乳化液加入到5 mL 50 mmol/L的磷酸盐缓冲液中(pH7.0),并加入1 mL适当稀释的酶液,在37℃,100 r/min震荡条件下反应15 min,加入10 mL 95%乙醇终止反应。用0.05 mol/L NaOH滴定样品生成的脂肪酸,计算消耗NaOH的量。酶活单位的定义:在37℃,pH7.0的条件下,样品水解油脂每分钟释放1 μmol游离脂肪酸所需的酶量为一个活力单位(U)。
1.2.1.3 分光光度法将pNPB溶液与50 mmol/L磷酸盐缓冲液(pH7.0)以1:9混合,吸取2.7 mL上述混合液,加入300 μL适当稀释过的酶液,37℃反应15 min,用3 mL 95%乙醇终止反应,在410 nm波长处测定样品溶液的吸光值。酶活单位的定义:在37℃,pH7.0的条件下,样品水解4-硝基苯丁酸酯(pNPB)每分钟释放1 μmol对硝基苯酚(pNP)所需的酶量为一个酶活力单位(U)。
1.2.2 蛋白浓度测定蛋白质浓度的测定采用Bradford法[18],以牛血清白蛋白为标准蛋白。
1.2.3 离子交换层析使用20 mmol/L磷酸盐缓冲液(pH7.0)平衡HiTrap Q柱,排除气泡,在恒定低温操作下,适当稀释的粗酶液以恒定流速通过蠕动泵流过层析柱,后利用1 mol/L的NaCl溶液进行梯度洗脱,收集洗脱样品,测定酶活和蛋白质浓度。
1.2.4 羧肽酶水解蛋白特性的检测 1.2.4.1 最适反应pH使用pH6.0-12.0 50 mmol/L的缓冲液(pH6.0-8.0 Na2HPO4/Na2HPO4缓冲液、pH9.0-12.0硼酸-硼酸钠缓冲液)配置1%酪蛋白溶液,按照Folin显色法测定CPA1的残余活力。以残余酶活最大值pH下的酶活力为100%,计算其他pH条件下的相对活力。
1.2.4.2 pH稳定性利用pH2.0-8.0的缓冲液(pH2.0-3.0甘氨酸-HCl缓冲液、pH4.0-5.0乙酸-乙酸钠缓冲液、pH6.0-8.0 Na2HPO4/Na2HPO4缓冲液)0℃下处理酶液1 h,在最适温度和pH下,按照Folin显色法测定酶活,以残余酶活最大值pH下的酶活力为100%,计算其他pH值下的相对活力。
1.2.4.3 最适反应温度将CPA1酶液在最适pH、不同温度下(10℃-70℃)反应,采用Folin显色法测定其最适反应温度。将酶活最高值温度下的酶活力为100%,计算其他温度下酶的相对活力。
1.2.4.4 热稳定性将CPA1酶液分别在30℃-80℃保温1 h,在最适温度和pH条件下,Folin显色法测定残余酶活力以分析其温度稳定性。以0℃保温的CPA1酶活力为100%,计算不同温度下的相对活力。
1.2.5 羧肽酶转酯功能特性的检测 1.2.5.1 底物特异性的测定分别将不同碳链的脂肪酸酯(p-Nitrophenyl acetate、p-Nitrophenyl butyrate、p-Nitrophenyl decanoate、p-Nitrophenyl myristate、p-Nitrophenyl palmitate)溶解于异丙醇,均配制成3 mg/mL底物溶液。在37℃,pH7.0,50 mmol/L磷酸盐缓冲液中分别测定CPA1在这5种底物下的活性。以测定活性最大值底物下的酶活力为100%,计算其他底物下酶的相对活力。
1.2.5.2 最适反应pH在pH2.0-8.0 50 mmol/L的缓冲液(配置同"1.2.4.2")中,利用分光光度法测定CPA1的残余活力。以残余酶活最大值pH下的酶活力为100%,计算其他pH条件下的相对活力。
1.2.5.3 pH稳定性利用pH2.0-8.0的缓冲液0℃处理酶液1 h,在最适温度和pH下,利用分光光度法测定酶活,以残余酶活最大值pH下的酶活力为100%,计算其他pH值下的相对活力。
1.2.5.4 最适反应温度将CPA1酶液在最适pH、不同温度下(10℃-70℃)反应,采用分光光度法测定其最适反应温度。将酶活最高值温度下的酶活力为100%,计算其他温度下酶的相对活力。
1.2.5.5 热稳定性将CPA1酶液分别在30℃-80℃保温1 h,最适温度和pH条件下用分光光度法测定残余酶活力分析其温度稳定性。以0℃保温的CPA1酶活力为100%,计算不同温度处理后的相对活力。
1.2.5.6 动力学参数测定用不同浓度的p-Nitrophenyl butyrate (0.5-8 mmol/L)为底物,采用分光光度法测酶活性,根据米氏方程V=Vmax×[S]/(Km+[S]),用双倒数法作图。即以酶促反应的倒数1/V对底物浓度的倒数1/[S]做一直线,根据其斜率及截距计算Km、Vmax和Vcat。
1.2.6 羧肽酶耐酸抗蛋白酶特性检测 1.2.6.1 耐酸性检测将适当稀释的CPA1酶液在pH2.0甘氨酸-盐酸缓冲液中,37℃保温1 h,以1:4的比例将混合液与pH7.0的磷酸盐缓冲液混合,37℃保温20 min,采用分光光度法测定其活性。对照以pH7.0的磷酸盐缓冲液代替pH2.0甘氨酸-盐酸缓冲液,其他条件相同,设定对照活性为100%,计算样品相对活性。
1.2.6.2 抗蛋白酶特性检测将适当稀释CPA1酶液在pH7.0的磷酸盐缓冲液中,37℃保温1 h,以1:4的比例将混合液与含胰蛋白酶40 U/mL,pH7.0的磷酸盐缓冲液混合,37℃保温20 min,采用分光光度法测定其活性。对照未经胰蛋白酶处理,其他条件相同,设定对照活性为100%,计算样品相对活性。同时另取适当稀释的CPA1酶液分别在含有0、10、20、30、40、50、60、70和80 U/mL的胰蛋白酶的pH7.0磷酸盐缓冲液中,37℃热处理60 min,将混合液进行SDS-PAGE蛋白电泳分析,观察条带的变化,以未经胰蛋白酶处理的CPA1酶样作为对照。
2 结果 2.1 猪胰腺羧肽酶A1的分离纯化经过离子交换层析条件优化,结合橄榄油滴定法确定30%盐(1 mol/L NaCl溶液)梯度洗脱样品具有活性(Peak2),直接经过磷酸盐缓冲液冲洗下来的蛋白杂峰(Peak1)和60%及100%高盐梯度洗脱下来的蛋白杂峰(Peak3和Peak4)均不含活性(图 1)。收集Hitrap Q阴离子交换柱纯化有活性样品,经SDS-PAGE分析,结果为单一蛋白条带,其表观分子量为(34±1) kD (图 2)。综合其活性及蛋白浓度测定结果得知其比活力为22.4 U/mg。对其进行质谱分析,并与NCBI蛋白数据库进行比对,结果(图 3)显示其与猪胰腺CPA1相似性最高。
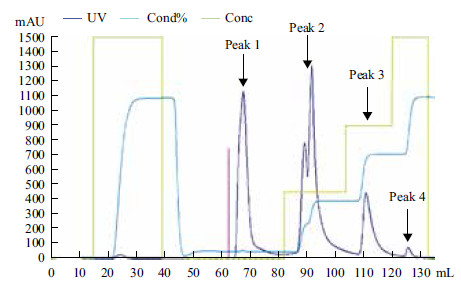 |
| 图 1 离子交换层析 |
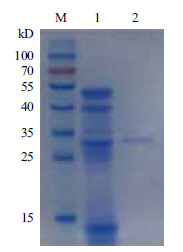 |
| M:蛋白Marker;1:CPA1粗酶液;2:30%盐梯度洗脱样品 图 2 粗酶液和纯化后酶液的SDS-PAGE 分析 |
 |
| 图 3 质谱分析比对结果 |
CPA1除能够水解酪蛋白外,还能水解橄榄油中的油脂。CPA1在以酪蛋白和橄榄油为底物时,比活力分别为53.14 U/mg和22.4 U/mg。说明CPA1除具有蛋白酶活性外,还具有转酯功能。但橄榄油成分复杂,含有多种碳链脂肪酸甘油酯。脂肪酶和酯酶均可催化转酯反应。酯酶催化水解短碳链的酯类(C<10);脂肪酶能够水解长碳链的酯类(C>10)[19]。为探究CPA1转酯活性底物特异性,本研究以含不同碳链脂肪酸酯为底物对其鉴定。结果(图 4)显示,CPA1对碳链长度小于10的脂肪酸酯的催化活性高于碳链长度大于10的,且在以4-硝基苯丁酸酯(C4)为底物的情况下,CPA1的活性明显高于其他碳链作为底物时CPA1的活性,表明CPA1转酯活性催化底物种类与酯酶相近。测定了CPA1以p-Nitrophenyl butyrate为底物时的动力学参数,结果表明,Km=5.075 μmol/mL,Vmax=0.0134 μmol/mL·min,Kcat=8.25 μmol/mg·min。
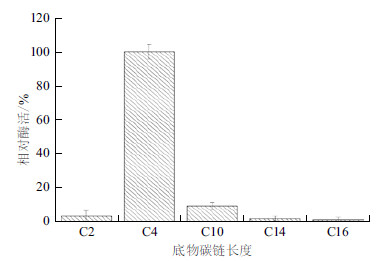 |
| 图 4 CPA1 的底物特异性 |
CPA1转酯活性在pH2.0-6.0之间较低,处于缓慢上升趋势,至pH6.0时,其活性仅为最大活性的20%。CPA1转酯活性最适反应pH为7.4,而其蛋白酶活性最适反应pH为7.6。但pH为6.0时,CPA1蛋白酶活性维持在70%,结果高于其转酯活性。pH继续上升,CPA1的蛋白酶活性和转酯活性均下降。但其蛋白酶活性下降缓慢,至pH10.0时,仍有60%的活性,而其转酯活性在pH8.0时已降至50%(图 5)。结果表明,CPA1的蛋白酶活性和转酯活性最适pH大致相同。
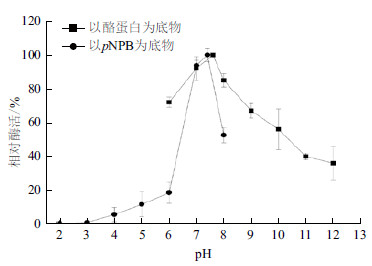 |
| 图 5 CPA1 最适反应pH |
CPA1经不同pH缓冲液预处理1 h,结果(图 6)表明,在pH3.0-7.0范围内稳定,酶活力均保持在90%以上。pH2.0的条件下处理1 h,CPA1的酶活力仍大于75%;pH8.0的碱性条件下处理1 h,CPA1的转酯活性和蛋白酶活性均下降,但其转酯活性下降较快,活性降至75.7%。结果表明,CPA1的pH稳定性宽泛,在酸性条件下可稳定存在。
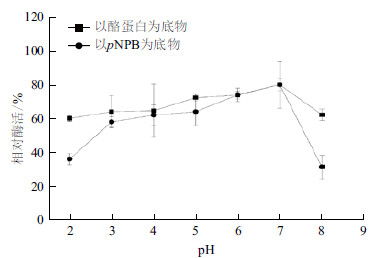 |
| 图 6 CPA1 经不同pH 缓冲液处理1 h 后的稳定性 |
CPA1的蛋白酶和转酯活性的最适反应温度均为35℃,且二者10℃-40℃均具有较高活力(>50%)。温度高于50℃时,CPA1蛋白酶活性下降缓慢,至70℃时维持在60%以上;CPA1转酯活性开始迅速下降,50℃时降至14.23%,至70℃时仅有5%。结果(图 7)表明,CPA1的蛋白酶活性和转酯活性最适反应温度相同。相比于蛋白酶活性,CPA1转酯活性受温度影响较大。
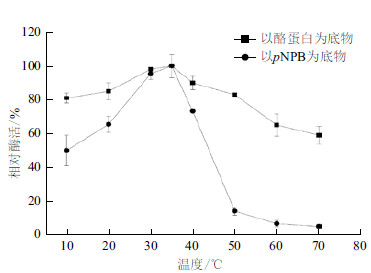 |
| 图 7 CPA1 最适反应温度 |
CPA1经不同温度处理1 h后,其蛋白酶活性稳定,即使是在80℃下温浴1 h,其活性仍保持在80%以上。CPA1转酯活性在30℃-50℃之间维持在80%以上,但当温度升至80℃时,酶活力降至64.4%。结果(图 8)表明,CPA1蛋白酶活性和转酯活性均具有较高的热稳定性,但相比于蛋白酶活性,CPA1转酯活性热稳定性较差。
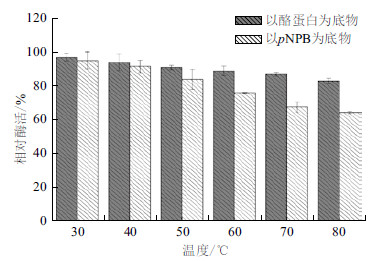 |
| 图 8 CPA1 在不同温度下保温1 h 后的热稳定性 |
模拟食糜在胃肠道消化,CPA1经pH2.0酸性环境处理1 h (不添加胰蛋白酶),活性残留95.65%;用pH7.0磷酸盐缓冲液模拟肠道中性环境,添加胰蛋白酶40 U/mL处理20 min,CPA1活性降至78.14%。结果表明,CPA1的耐酸性较强,对胰蛋白酶存在抵抗能力。为检验CPA1的稳定性,采用不同活性胰蛋白酶(0、10、20、30、40、50、60、70和80 U/mL),并对其进行1 h处理。将处理后的样品进行SDS-PAGE分析,在(34±1) kD处均检测到蛋白条带,且条带亮度基本一致(图 9),表明CPA1可抵抗较宽范围活性的胰蛋白酶。此特性为CPA1在肠道内发挥作用提供了保障。
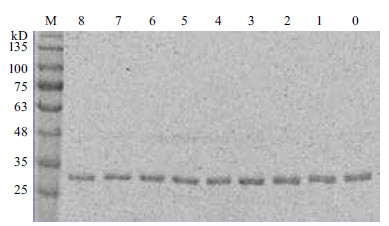 |
| M:蛋白Marker;0-8:胰蛋白酶活性依次为0、10、20、30、40、50、60、70和80 U/mL 图 9 CPA1 经不同活性胰蛋白酶处理后的SDS-PAGE 分析 |
CPs能分解蛋白质,释放游离氨基酸,因此在饲料中得到广泛应用,获得性能优良的CPs具有重要的经济和社会效益。目前,多数CPs对酸性环境和内源消化酶敏感,而CPs发挥作用的前提是必须有一定活力的酶能够达到其在消化道中的作用部位,在胃中强酸环境下保持活力且不被蛋白酶所破坏。因此CPs在酸性和内源性消化酶环境中的稳定性一直是影响其实际应用的限制因素。哺乳动物消化道内CPs经过酸性环境浸泡和消化酶降解,仍可帮助消化食物,具有催化活性[10],是很好的耐酸抗蛋白酶CPs来源。研究表明,酶催化活性与其结构和构象相关,蛋白质从无规则卷曲折叠成特定的功能型三维结构[20],获得其催化活性。本实验从猪胰脏中分离得到了一种CPA1,耐酸特性检测结果显示,经pH2.0酸性环境处理后,活性残留95.65%;CPA1转酯活性pH稳定性结果显示,CPA1经pH2.0缓冲液处理1 h,酶活为78.7%。CPA1转酯活性在30℃-40℃具有较高的热稳定性,酶活维持在95%以上,同时以未经热处理的CPA1的活性为100%(0℃保存),所以CPA1经0℃和35℃处理后,其活性差别较小,可忽略。因此,CPA1经强酸环境处理后结果的不同与中性环境保温处理有关,CPA1活性经强酸处理后造成的损失可在中性环境中重新获得。因此推测pH的变化导致CPA1结构和构象的变化,进而导致其催化活性的变化。同时CPA1最适反应pH结果显示,其在pH2.0-6.0的酸性环境中基本无活性,直至pH7.0时,CPA1活性迅速由pH2.0的18.6%上升至93.73%。因此可进一步推测CPA1经酸性环境处理时,其三级结构解体,导致该酶基本失去活性。该酶被转移至中性环境后,CPA1迅速从无规则卷曲折叠转换成原本功能性立体结构,因此重新获得其催化活性。要确定推测是否正确,下一步需对CPA1采用不同pH缓冲液处理,并借助荧光光谱法等技术检测CPA1蛋白结构和构象[21],验证此推断是否正确。
该酶除具有耐酸抗蛋白酶特性外,还具备双功能催化特性。CPA1除能够水解蛋白质外还能够水解油脂,具备转酯功能。CPA1属于金属羧肽酶家族,CPA1的催化需要Zn2+的参与。Zn2+被包围在His69、His196、Glu72和水分子组成的四面体结构中,形成CPA1催化活性中心。CPA水解肽键时,水分子被Zn2+极化,在与Glu270的共同作用下攻击多肽链上易切开的碳原子[22]。因CPA1同时具备蛋白酶活性和转酯功能,所以推测该酶催化活性中心也可作用于酯键,催化酯类物质的水解。下一步实验应验证CPA1转酯能力催化原理推测结果。研究方法较多,如使用二胺四乙酸(EDTA)、苯甲基磺酰氟(PMSF)、β-巯基乙醇等蛋白酶抑制剂对CPA1进行处理,观察其转酯活性的变化,从而判断CPA1催化转酯反应的活性中心结构。
本实验从家猪胰脏中获得CPA1,该酶既具有多功能催化特性,还具有较强的耐酸抗蛋白酶特性。猪在中国分布较为广泛,品种也多种多样,如民猪、陆川猪和宁乡猪等[23]。对动物源CPs的研究,除猪外,还有牛和鼠等[9]。因哺乳动物消化食物过程较为相似,推测其他来源CPs同样具备耐酸抗蛋白酶等优良特性,需进一步研究。
4 结论CPA1既能水解蛋白质,也可水解油脂;具有较高的耐酸抗蛋白酶特性和较高的热稳定性。
| [1] | 高海燕, 高鹏飞, 李忠建. 猪的消化生理特点及配制饲料应注 意的事项[J]. 南方养猪·营养与日粮, 2006, 2(3):22-23. |
| [2] | 方希修, 王冬梅. 饲用酶制剂的应用研究[A]. 2006 山东饲料 科学技术交流大会论文集[C]. 2006 |
| [3] | Decuypere JA, Dierick NA. The combined use of triacyglycerols containing medium-fatty acids and exogenous lipolytic enzymes as an alternative to in-feed antibiotics in piglets :concept, possibilities and limitations[J]. Nutr Res Rev, 2003, 16(2):193-210. |
| [4] | 肖竞, 孙建议, 李卫芬. 酸性蛋白酶及其在畜牧业中的应用[J]. 饲料博览, 2003(3):27-29. |
| [5] | Rawlings ND, Barrett AJ, Woessner JF. Handbook of proteolytic enzymes[M]. New York :Academic Press Inc, 2004. |
| [6] | Luo HY, Wang YR, Li J, et al. Cloning, expression and characterization of a novel acidic xylanase, XYL11B, from the acidophilic fungus Bispora sp. MEY-1[J]. Enzyme and Microbial Technology, 2009, 45(2):126-133. |
| [7] | Cai HY, Shi PJ, Bai YG, et al. A novel thermoacidophilic family 10 xylanase from Penicillium pinophilum C1[J]. Process Biochemistry, 2011, 46(12):2341-2346. |
| [8] | 杨培龙, 姚斌. 饲料用酶制剂的研究进展与趋势[J]. 生物工 程学报, 2009, 25(12):1844-1851. |
| [9] | 吴静, 闵柔, 邬敏晨, 等. 羧肽酶研究进展[J]. 食品与生物技 术学报, 2012, 31(8):1673-1689. |
| [10] | Aviles FX, Vendrell J, Guasch A, et al. Advances in metalloprocarboxypeptideses :emerging details on the inhibition mechanism and on the activation process[J]. Eur J Biochem, 1993, 211 :381-389. |
| [11] | 刘新育, 李学琴, 王明道, 等. 耐酸及耐蛋白酶的木聚糖酶产 生菌的筛选[J]. 河南农业科学, 2012, 41(6):152-154. |
| [12] | 赵瑞香, 李刚, 牛生洋, 等. 微生态菌株Lactobacillus Acidophilus 在模拟人体胃与小肠蛋白酶环境中抗性的研究[J]. 中国食品学报, 2006, 6(4):19-23. |
| [13] | 方洛云, 谯仕彦, 林刚, 等. 人工猪小肠液酶活的确定[A]. 中国畜牧兽医学会2009 学术年会论文集(下册)[C].2009. |
| [14] | 赵莹. 猪羧肽酶A1 酶原的基因克隆及其在毕赤酵母中的表 达[D]. 雅安:四川农业大学, 2009. |
| [15] | 王福清, 李素霞, 等. 猪胰腺羧肽酶B 提取工艺中的激活条件 与稳定性研究[J]. 中国生化药物杂志, 2007, 28 :250-251. |
| [16] | 赵林果, 王传槐, 叶汉玲. 复合酶制剂降解植物性饲料的研 究[J]. 饲料研究, 2001, 1(1):2-5. |
| [17] | 戴玄, 唐兵, 陈向东, 等. 产高温蛋白酶微生物菌种资源的研 究[J]. 微生物学杂志, 1997, 17(3):25-29. |
| [18] | Bradford M. A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of proteindye binding[J]. Anal Biochem, 1976, 72(2):248-254. |
| [19] | Martinelle M, Holmquist M, Hult K. On the interfacial activation of Candida antarctica lipase A and B as compared with Humicola lanuginosa lipase[J]. Biophys Acta, 1995, 1258(3):272-276. |
| [20] | Alberts B, Johnson A, Lewis J, et al. The shape and structure of proteins[M]//Molecular Biology of the Cell. New York :Garland Science, 2002. |
| [21] | Wang H, Andersen KK, Sehgal J, et al. pH regulation of the kinetic stability of the lipase from Thermomyces lanuginosus[J]. Biochemistry, 2012, 52(1):264-276. |
| [22] | 郑佩婵. 人羧肽酶A1、抗精浆单链抗体/ 人羧肽酶A1 融合 蛋白的表达及活性测定[D]. 西安:中国人民解放军第四军 医大学, 2010. |
| [23] | 张劲硕. 世界猪的种类、分布和现状[J]. 动物学杂志, 2007 (1):7-8. |




