瘤背石磺(Onchidium struma)俗称土海参、海癞子、土鸡、乌纱鳖、涂龟、土鲍等,属于软体动物门(Mollusca)腹足纲(Gastropoda)肺螺亚纲(Pulmonata)柄眼目(Stylommatophora)石磺科(Onchidiidae),全身裸露无壳,是用肺呼吸的一种进化贝类[1]。在我国主要分布于江苏、上海、浙江、福建、广东、香港、海南、广西等地,其生长在陆地和海洋的过渡带,分布于滩涂潮间带高潮线附近。民间流传瘤背石磺具有滋补、壮阳、清凉、祛火、祛湿等功效[2, 3, 4]。营养成分分析结果表明,瘤背石磺具有较高的药用价值和保健作用[5]。
研究发现贝类多糖也具有多种生物活性及药用价值,紫贻贝[6]多糖具有良好的抗氧化活性;范秀萍[7]研究发现波纹巴非蛤多糖(PUG-1)对高脂模型小鼠具有较好的降低血脂与预防动脉粥样硬化作用,贝类多糖还具有如抗肿瘤[8, 9, 10]、抗病毒[11]、抗衰老[12]等生物活性,从生物体内提取出来的多糖对正常细胞毒副作用小,多糖药物的研制成为当今世界新药的重要发展方向之一,从而使多糖生物资源的开发和利用成为了研究热点。管菊[13]在研究中发现瘤背石磺中的总糖含量约为26.06%,目前国内外关于石磺的研究主要集中在系统分类、生物学特性、受精机制、繁殖、胚胎发育、神经系统以及营养价值等方面,其多糖的提取、工艺条件优化及其生物活性的研究报道几乎没有。考虑到实际实验的可操作性及实验室仪器的局限性,综合考量最后采取经典的多糖提取法--热水浸提醇沉法,该法具有经济、简单、容易操作,仪器设备易得的优点。李雪梅[14]利用热水浸提法提取出扇贝中的水溶性多糖,并对提取条件进行优化。本研究采用热水浸提法提取瘤背石磺中的多糖,通过响应面法[15, 16]实验设计对多糖的提取工艺条件进行优化,并对粗多糖的体外抗氧化能力做初步测定,以期为瘤背石磺生物活性物质的研究和开发提供一些参考。
1 材料与方法 1.1 材料 1.1.1 瘤背石磺预处理瘤背石磺(采自上海崇明岛)解剖去其内脏,置于-80℃的低温下备用。
1.1.2 试剂无水葡萄糖、苯酚、浓硫酸、1,1-二苯基-2-苦肼基(DPPH自由基)、水杨酸、硫酸亚铁、过氧化氢等化学试剂均为分析纯。
1.1.3 仪器多功能粉碎机(永康市小宝电器有限公司),AL104电子分析天平(精确至0.0001 g,梅特勒-托利多仪器(上海)有限公司),美谱达UV-6100型紫外分光光度计(上海美谱达仪器有限公司),DHG-9077A型电热恒温干燥箱(上海精密实验设备有限公司),HWS-26双列六孔恒温水浴锅(上海慧泰仪器制造有限公司),TDL-40B低速台式大容量离心机(上海圣科仪器设备有限公司),MLLI-Q超纯水仪(美国Millipore公司)。
1.2 方法 1.2.1 瘤背石磺粗多糖的提取工艺流程瘤背石磺→绞碎→石油醚浸泡12 h →乙醇浸泡4 h → 50℃烘箱烘干→水浴浸提→过滤离心→取上清液→浓缩→脱蛋白(Sevage试剂脱蛋白)→离心(除蛋白)→透析(4 d)→浓缩→醇沉(加入4倍体积95%乙醇,4℃静置过夜)→离心45℃恒温干燥→灰白色瘤背石磺粗多糖。
1.2.2 葡萄糖标准曲线的描绘多糖含量的测定采用苯酚-硫酸法[17],绘制标准曲线(图 1),得回归方程为:y=0.0075x+0.0012,R2=0.9927,结果表明,葡萄糖的微克含量在16-72 μg范围内,线性关系良好。
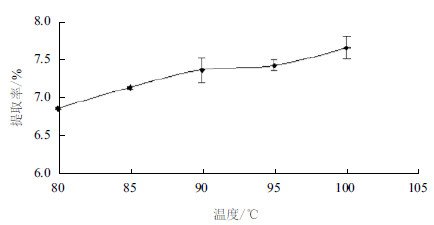 |
| 图 1 浸提温度对瘤背石磺多糖提取率的影响 |
准确称取瘤背石磺干燥粉1 g,放入50 mL的锥形瓶中,按照设定的料液比加入蒸馏水,在设定的时间和温度下提取,过滤离心分离,取上清液,按照苯酚-硫酸法测定并计算提取液中多糖的含量。计算方程如下:
多糖的提取率(%)=C×N×V/M×10-3×100%式中,C为待测液的浓度;N为稀释倍数;V为待测液体积;M为样品质量。
1.2.4 单因素实验通过热水浸提法,分别考察料液比(20、30、40、50和60 mL/g),提取温度(80、85、90、95和100℃),提取时间(15、20、25、30和35 h)这3个因素进行单因素的优化实验,采用苯酚-硫酸法测石磺多糖浓度,以多糖得率为指标,考察各个因素对瘤背石磺多糖得率的影响。
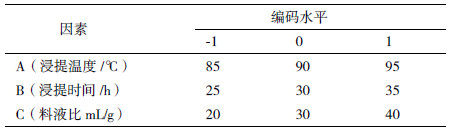
1.2.5 响应面实验在上述单因素基础上,根据Box-Behnken Design (BBD)中心组合实验设计原理,设计出3因素3水平实验方案[18]。以瘤背石磺多糖的提取率为响应值,利用Design Expert 8.05软件对实验结果进行数据分析,得出最佳提取工艺条件。实验因子和水平,见表 1。
参照陈玉琴等[19]的实验方法,略有改动,降低了其中DPPH自由基的浓度为0.5 mmoL/L,进行实验,重复实验3次,求取平均值,以VC作对比。
清除率(%)=[1-(A样品-A空白)/A对照]×100%
1.2.6.2 清除羟基自由基能力的测定参考李粉玲等[20]的实验方法,略有改动,10倍稀释了实验试剂的浓度,并延长反应时间至30 min。重复实验3次,求取平均值,以VC作对比。
清除率(%)=[1-(A样品-A空白)/A对照]×100%
2 结果 2.1 瘤背石磺多糖提取的单因素实验 2.1.1 温度对总糖得率的影响图 1显示,随着浸提温度的提高,瘤背石磺多糖的提取率明显增高,当温度高于90℃时,多糖的提取率增加相对缓慢。由于加热时间过长,受实验条件限制,温度最高只能稳定在95℃,所以浸提温度选择85℃-95℃。
2.1.2 时间对总糖得率的影响图 2显示,随浸提时间的延长瘤背石磺多糖的提取率不断提高,浸提时间达到30 h,提取率达到最大值。随着浸提时间的延长,提取率下降。故选择浸提时间在30 h左右。
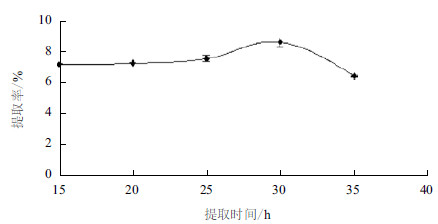 |
| 图 2 浸提时间对瘤背石磺多糖提取率的影响 |
图 3显示,当料液比低于30 mL/g时,多糖的提取率一直呈现上升趋势,在料液比为30 mL/g时提取率达到最高,随着料液比的继续增大,提取率降低。故选择30 mL/g为响应面的最优值。
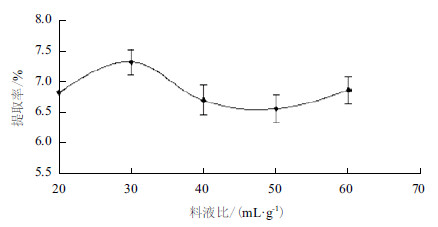 |
| 图 3 料液比对瘤背石磺多糖提取率的影响 |
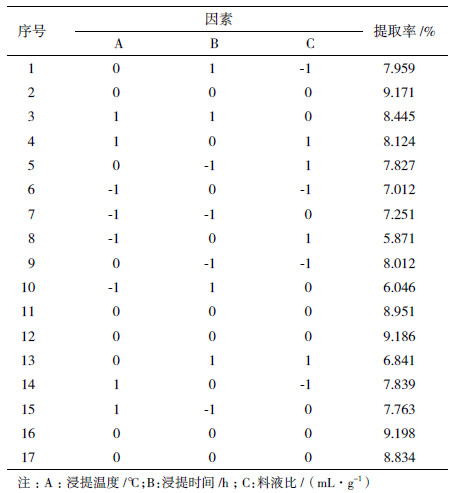
依据单因素实验结果,选择浸提温度、浸提时间、料液比3个因素为响应面实验的自变量,以多糖提取率为响应值,进行3因素3水平的优化实验。利用Design expert 8.05软件进行数据处理和回归分析,结果如表 2所示。
通过Design-Expert 8.05软件对表 2中的数据进行处理,得到多糖提取率对浸提温度、浸提时间、料液比3个因素的二次多项回归方程为:
R1=-312.57062+7.07377A-0.10520B-0.056838C+0.018870AB+7.13000×10-3AC-4.66500×10-3BC-0.042800A2-0.024870B2-7.86500×10-3C2
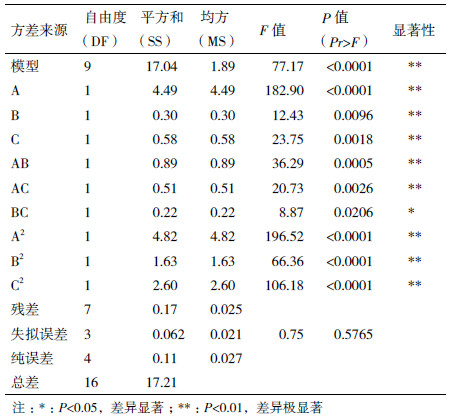
对该模型进行方差分析,结果(表 3)显示,P < 0.000 1,表明模型极显著;失拟项P=0.576 5> 0.05,没有显著性,说明所选的模型对该实验拟合程度较好,误差较小。其中模型的复相关系数R2=0.990 0,校正后的R2=0.977 2,说明该模型可以解释97.72%的响应值Y的变化,预测R2值0.932 5与校正的值0.977 2相差不大,表明实验的实际值与预测值拟合的较好。
A、B、C三个因素的一次项均小于0.01,说明这3个因素对多糖提取率都极显著。交互项AB、AC都小于0.01,均达到了极显著的水平,BC小于0.05达到显著水平,3个因素的二次项均达到极显著水平(P < 0.01),说明3个因素之间都存在一定的交互作用,且因素之间的交互作用对多糖提取率都显著影响。表 3的方差分析显示,3个因素对瘤背石磺多糖提取率的影响程度依次为A (浸提温度)>C (料液比)>B (浸提时间)。
2.2.2 瘤背石磺多糖的响应面分析利用Design Expert 8.05软件,绘制各影响因素对瘤背石磺多糖的响应曲面图,根据响应曲面的坡度和等高线的形状可以比较判断各因素及其交互作用对提取率影响的强弱。该拟合方程的二次项系数都是负数,所以图 4-图 6中每个响应曲面都是开口向下的凸形曲面,等高线沿某一因素轴方向曲线的疏密程度反映在响应曲面上表现为曲面的陡峭程度,等高图上曲线越密,响应曲面则越陡,说明响应值对该因素的变化较敏感,图 4-图 6中的响应面3D图显示,当各因素在一定范围内增大时,响应值也随之增大,当各因素超出响应面极值继续增加时,响应值则减小,等高图中的中心点投影在3D图中为最高点,则该点的提取率最高,而根据等高线图 4-图 6中等高线沿各自轴方向的疏密程度可以比较出各因素的影响力大小分别是:A>B、A>C、C>B。等高线的形状可反映出交互影响的强弱,椭圆形表示两因素交互作用显著,而圆形则与之相反,图 4-图 6中的等高曲线都是椭圆形,说明浸提温度和浸提时间、浸提温度和料液比、浸提时间和料液比之间交互作用较为显著且各因素之间的交互作用对多糖的提取率影响显著。最后得出3种因素对多糖提取率的影响是:A (浸提温度)>C (料液比)>B (浸提时间),该结果与回归模型显著性检验相吻合。
 |
| 图 4 提取率f=(A,B)响应曲面及等高线图(C=30.00) |
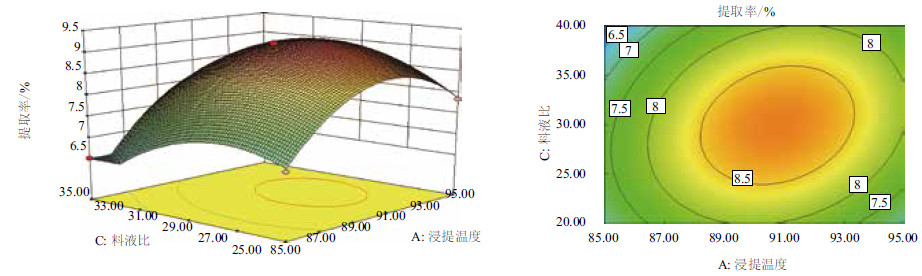 |
| 图 5 提取率f=(A,C)响应曲面及等高线图(B=30.00) |
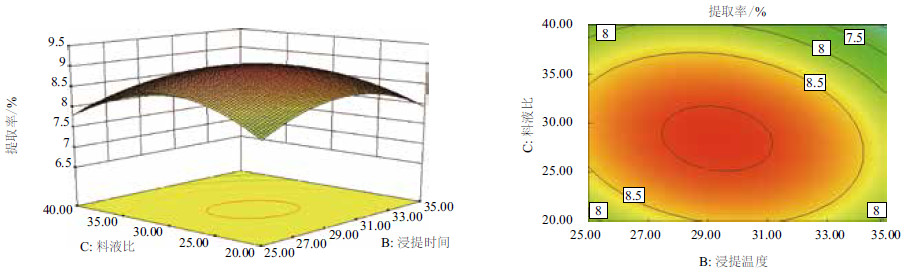 |
| 图 6 提取率f=(B,C)响应曲面及等高线图(A=90.00) |
根据上述响应面的模型与结果分析,得到最佳条件下的瘤背多糖的提取率为9.206%,其中浸提温度为91.65℃,浸提时间29.93 h,料液比29.05 mL/g。为了检测响应面法所得数据的可靠性,同时也为了实验操作方便,选取浸提温度92℃,浸提时间30 h,料液比29 mL/g。在此条件下,平行重复实验3次的平均值为(9.062±0.091)%。实际测得的平均值与理论预测值相差很小,说明该模型可靠性高,工艺的重复性好。
2.3 瘤背石磺多糖体外抗氧化实验 2.3.1 DPPH自由基清除能力图 7显示,在测定的浓度范围内,VC和瘤背石磺多糖对DPPH自由基都有较强的清除能力,但与多糖相比,VC的清除能力明显更强且一直维持在较高水平。多糖对DPPH自由基的清除力随着瘤背石磺多糖浓度的增加呈正相关关系,当浓度大于2 mg/mL时,多糖对DPPH自由基的清除率明显增强。当多糖浓度为10 mg/mL时,清除率最高达到76.98%。对DPPH的清除率IC50为4.36 mg/mL。
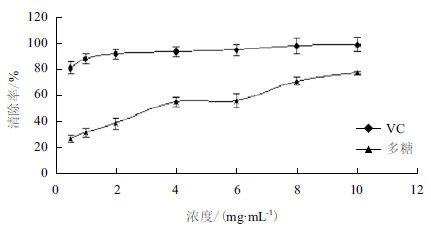 |
| 图 7 瘤背石磺多糖对DPPH 自由基的清除率 |
图 8显示,在测定的多糖浓度范围内,瘤背石磺多糖和VC均对羟基自由基有较强的清除力。与多糖相比,VC的清除能力更强且一直维持在较高的水平。瘤背石磺多糖对羟基自由基的清除力随多糖浓度的增加而增强,最高清除率达到80%。说明瘤背石磺多糖对羟基自由基的清除能力达到较高的水平。对羟基自由基的清除率IC50为3.12 mg/mL。
 |
| 图 8 瘤背石磺多糖对羟基自由基的清除率 |
本实验对瘤背石磺多糖提取工艺条件进行优化,对其抗氧化活性进行评价。选取3个影响因素(浸提温度、浸提时间、料液比)进行单因素的优化实验,在单因素基础上,根据Box-Behnken Design (BBD)中心组合实验设计原理,以多糖提取率为响应值,设计出3因素3水平实验方案,利用Design Expert 8.05软件对实验结果进行数据分析,得出最佳提取工艺条件。通过多糖清除DPPH自由基和羟基自由基的能力来评价多糖的抗氧化活性。
在单因素的实验中,浸提温度、浸提时间和料液比对多糖提取率的影响均呈现先升高后降低的趋势。当浸提温度低于95℃时,随着温度的逐渐升高,分子的运动加剧,加快了多糖溶解扩散的速度,从而使多糖的提取率上升,所以在适度范围内浸提温度的升高有利于多糖的提取,但温度过高会破坏多糖的结构,部分多糖水解为单糖或低聚糖,从而导致多糖提取率下降[21];在一定的浸提时间内,多糖随着浸提时间的延长,在水中的溶解度不断增加,当多糖扩散达到平衡时,多糖的提取率下降,浸提时间过长会影响甚至破坏多糖结构从而导致多糖的提取率下降;浓度梯度是提取的动力,在一定范围内提高料液比有利于多糖的提取,但当料液比超过某一极限时,再提高料液比则效果不明显,同时考虑到节约能源,所以选择最优料液比为30 mL/g。
在多糖抗氧化实验中,以VC作为阳性对照,考察多糖对两种自由基的清除能力。首先DPPH自由基由于其化学结构中含有十分活泼的单电子,其醇溶液呈紫色,并且在517 nm处有一强吸收峰,瘤背石磺多糖的加入可以捕获并清除其单电子,导致溶液褪色和吸收强度的减弱[22];其次根据Fenton反应,H2O2与Fe2+发生氧化还原反应,生成OH·自由基,其存活时间较短但具有极高的反应活性,与水杨酸结合生成一种在510 nm处有强吸收的有色物质,抗氧化剂多糖的加入清除并降低了OH·自由基的浓度,则有色物质生成量减少,溶液颜色变淡且吸光度减小[23]。
4 结论利用响应面法优化瘤背石磺多糖提取的工艺条件,确定多糖的最佳提取工艺为浸提温度92℃,浸提时间30 h,料液比29 mL/g,提取率为9.062%。对瘤背石磺多糖体外抗氧化实验表明,在一定的浓度范围内,多糖对DPPH自由基和羟基自由基的清除能力都较强。
| [1] | Britton KM. The Onchidiacea(Gastropoda, Pulmonata)of Hong Kong with a worldwide review of the genera[J]. Journal of Molluscan Studies, 1984, 50(3):179-191. |
| [2] | 邱立言. 苏沪沿海瘤背石磺的形态和习性[J]. 动物学杂志, 1991, 26(3):33-36. |
| [3] | 沈和定, 陈汉春, 陈贤龙, 等. 石磺繁殖生物学的实验研究[J]. 水产学报, 2006, 30(6):753-760. |
| [4] | 孙变娜, 沈和定. 特色海洋中药-- 石磺[J]. 现代养生, 2013 (11):8. |
| [5] | 黄金田, 王爱民. 瘤背石磺营养成分分析及品质评价[J]. 海 洋科学, 2008, 32(11):29-35. |
| [6] | 邹艳君, 雷荣剑. 紫贻贝粗多糖的提取及其体外抗氧化的研 究[J]. 海峡药学, 2014, 26(7):41-43. |
| [7] | 范秀萍, 董晓静, 吴红棉, 等. 波纹巴非蛤多糖对高脂模型小鼠 血脂的影响[J]. 现代食品科技, 2014(1):7-10, 21. |
| [8] | 王莅莎, 朱蓓薇, 孙黎明, 等. 鲍鱼内脏多糖的体外抗肿瘤和免 疫调节活性研究[J]. 大连工业大学学报, 2008, 27(4):289- 293. |
| [9] | 杜挺挺, 陈荫, 钟城城, 等. 贻贝多糖的结构修饰及其体外抗肿 瘤活性测定[J]. 浙江海洋学院学报:自然科学版, 2014(4): 354-357. |
| [10] | Chen SG, Wang Jf, Xue CH, et al. Sulfation of a squid ink polysaccharide and its inhibitory effect on tumor cell metastasis[J]. Carbohydrate Polymers, 2010, 81(3):560-566. |
| [11] | 范巧云, 许礼发, 李朝品, 等. 扇贝多糖体外抗乙型肝炎病毒 活性的研究[J]. 中国人兽共患病学报, 2011, 27(4):307- 310. |
| [12] | 陈大勇, 张凤先, 李慧萍, 等. 动物源多糖的药理活性研究进 展[J]. 经济动物学报, 2013, 17(2):109-112. |
| [13] | 管菊, 沈和定, 钱静, 等. 四种石磺营养成分分析及价值评 价[J]. 食品工业科技, 2013, 34(17):349-353. |
| [14] | 李雪梅, 苏运聪, 王颉. 响应面法优化水溶性扇贝多糖的提取 工艺[J]. 中国食品学报, 2014, 2(14):127-132. |
| [15] | Hill WJ, Hunter WG. A review of response surface methodology : A literature review[J]. Technometrics, 1966, 8 :571-590. |
| [16] | Mead R, Pike DJ. A review of response surface methodology from a biometrics view point[J]. Biometrics, 1975, 31(12):803-851. |
| [17] | 张惟杰. 糖复合物生化研究技术[M]. 第2 版. 杭州:浙江 大学出版社, 2006. |
| [18] | 万阅, 齐计英, 曾红, 等. 响应面法优化香菇多糖的超声辅助 提取工艺[J]. 生物技术通报, 2015, 31(1):79-85. |
| [19] | 陈玉琴, 南海娟, 刘坤峰. 蕨菜多糖提取及抗氧化特性[J]. 北方园艺, 2014(14):128-132. |
| [20] | 李粉玲, 蔡汉权, 林泽平. 红豆多糖抗氧化性及还原能力的研 究[J]. 食品工业, 2014, 35(2):190-194. |
| [21] | 郝继伟. 响应面法优化超声辅助提取蒙山松茸多糖工艺[J]. 中药材, 2010, 33(7):1159-1163. |
| [22] | 陈玉琴, 南海娟, 刘坤峰. 蕨菜多糖提取及抗氧化特性[J]. 北方园艺, 2014(14):128-132. |
| [23] | 王超, 甄润英. 海芦笋多糖超声波辅助提取工艺及抗氧化活性 研究[J]. 食品与机械, 2012, 28(6):138-141. |