2.江南大学生物工程学院工业生物技术教育部重点实验室,无锡214122
2.School of Biotechnology,Key Laboratory of Industrial Biotechnology of Ministry of Education,Jiangnan University,Wuxi 214122
L-瓜氨酸是一种游离的氨基酸,是人体尿素循环的重要中间代谢物,具有多种生理功能。利尿、护肝,可与L-鸟氨酸、L-精氨酸等共同治疗高氨血症[1, 2];参与内源性细胞舒张因子一氧化氮的合成,有助于扩张血管、抑制动脉硬化,可用于治疗高血压、冠心病及男性性功能障碍等疾病[3, 4, 5];在肠道中L-瓜氨酸通过谷氨酸-鸟氨酸代谢途径合成,可作为检验小肠移植时异体排斥效应程度的指示剂[6];L-瓜氨酸与精氨酸结构相似,对体内自由基表现出高度的活性,可作为天然高效的新抗氧化剂[7],由此可见L-瓜氨酸在医药用品、保健食品以及化妆品中应用前景广阔。随着人们保健意识的提高,对L-瓜氨酸的需求量日益增多,因此生产L-瓜氨酸具有重大的意义。
L-瓜氨酸主要是由精氨酸脱亚胺酶(arginine deiminase,ADI,EC3.5.3.6)催化L-精氨酸盐酸盐水解生成L-瓜氨酸和氨[8, 9]。利用ADI催化生成L-瓜氨酸由于原料易得、工艺简单、产物浓度高等优点逐渐成为L-瓜氨酸制备的潜力途径。
本研究将来源于Pseudomonas putida ACCC 10185[10]的ADI基因(arcA)连接到表达载体pET-24a (+),获得重组质粒pET-24a (+)-arcA,将其转化Escherichia coli BL21(DE3)并进行摇瓶发酵,经超声波破碎,检测破壁上清液中的ADI酶活。在此基础上,对酶转化工艺进行研究,旨在获得高效制备L-瓜氨酸的方法。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒恶臭假单胞菌(Pseudomonas putida ACCC 10185):由ACCC菌种保藏中心购买;E.coli JM109、E.coli BL21(DE3)、表达载体pET-24a (+):为本实验室保藏;克隆载体pMD18-T Simple vector:购自TaKaRa公司。
1.1.2 培养基LB培养基(g/L):蛋白胨10,酵母粉5,NaCl 10,卡那霉素0.03,pH7.0。
TB培养基(g/L):蛋白胨12,酵母粉24,甘油5,K2HPO4 2.31,KH2PO4 16.43,卡那霉素0.03,pH7.0。
1.1.3 试剂限制性内切酶、T4 DNA连接酶、PrimerStar HS DNA聚合酶、碱性磷酸酶CIAP、核酸分子量标准及琼脂糖:购自TaKaRa公司;PCR产物纯化试剂盒、琼脂糖凝胶DNA回收试剂盒、质粒小提试剂盒:天根生化科技有限公司;卡那霉素、氨苄青霉素、异丙基-β-D-硫代半乳糖苷(IPTG)、蛋白质相对分子质量标准、L-精氨酸盐酸盐、瓜氨酸标样:购自生工生物工程(上海)有限公司;其它分析纯试剂均购自国药集团化学试剂有限公司。
1.1.4 主要仪器凝胶成像仪、蛋白电泳仪购自美国Bio-Rad公司;DYY-6C型核酸电泳仪购自北京六一仪器厂;高效液相色谱仪购自Agilent公司;细胞破碎仪购自北京科实兴业科技有限公司;紫外可见光分光光度计购自日本Shimadzu公司。
1.2 方法 1.2.1 工程菌的构建提取Pseudomonas putida ACCC 10185的基因组,PCR扩增目的基因arcA,将所得片段割胶回收后,连接克隆载体pMD18-T Simple vector,将连接产物转入E.coli JM109感受态细胞中,在平板培养基上培养过夜,挑取单克隆至液体培养基中培养,抽提质粒得到pMD18-T-arcA,经Nde Ⅰ和Hind Ⅲ双酶切后,将目的基因片段割胶回收,T4连接酶将目的基因与经相同酶切处理的表达载体pET-24a (+)连接,连接产物转入E.coli JM109感受态细胞中,在平板培养基培养过夜后,挑取单克隆进行液体培养,抽提得到重组质粒pET-24a (+)-arcA。将pET-24a (+)-arcA进行双酶切验证,验证正确后转入E.coli BL21(DE3)感受态细胞中,涂布LB平板培养基,挑取单克隆进行液体培养,保存甘油管,-80℃保存。
1.2.2 摇瓶发酵生成ADI 1.2.2.1 种子培养接一定量-80℃甘油管中保存的菌液至LB培养基,37℃、200 r/min,培养8 h。
1.2.2.2 摇瓶发酵将种子液以5%的接种量转接至TB培养基,37℃培养至OD600约为1.0时,加入终浓度为0.4 mmol/L的IPTG[11, 12],置于25℃、转速200 r/min进行重组蛋白的诱导表达,诱导18 h后离心收集菌体,用50 mmol/L,pH6.0 Na2HPO4-NaH2PO4缓冲液复溶菌体至5 OD,超声波破碎后离心,破壁上清即为ADI粗酶液,测定粗酶液中的ADI酶活,经与发酵液OD折算后,即为每毫升发酵液中的ADI酶活。
1.2.3 ADI活性测定利用二乙酰一肟-氨基硫脲比色法测定ADI酶活[13]。用50 mmol/L,pH6.0的磷酸盐缓冲液配制0.2 mol/L L-精氨酸盐酸盐溶液作为底物,取100 μL适当稀释的酶液加入1 mL底物中,于37℃条件下反应30 min,加入1 mL 10%三氯乙酸终止反应,沸水浴5 min,稀释一定倍数后测定瓜氨酸含量,并计算酶活。酶活定义:37℃条件下,每分钟转化1 μmol L-精氨酸盐酸盐生成瓜氨酸的酶量定义为1 U。
1.2.4 L-瓜氨酸的制备及含量测定以50 mmol/L,pH6.0的磷酸盐缓冲液配制浓度为650 g/L的L-精氨酸盐酸盐溶液,加酶量为24 U/g底物,与一定量的酶液充分混匀后在37℃、100-200 r/min水浴摇床中反应7 h。转化后的反应液加入等体积的三氯乙酸后,静置2 h,12 000 r/min离心10 min,取上清进行分析。利用HPLC进行产物分析的色谱条件是:Agilent 1200 HPLC色谱仪,Agilent自动进样器,色谱柱250×4.6 mm 5 μm Inertsil ODS-3 Column,Agilent紫外检测器;流速0.8 mL/min;柱温40℃。转化率定义为生成的L-瓜氨酸的摩尔数/L-精氨酸盐酸盐的摩尔数×100%。
2 结果 2.1 ADI重组菌的构建 2.1.1 重组质粒pET-24a (+)-arcA的构建提取Pseudomonas putida ACCC 10185的基因组,PCR扩增目的基因arcA,将携带目的基因的质粒pMD18-T和本实验室质粒pET-24a (+)分别经Nde Ⅰ和Hind Ⅲ双酶切后,割胶回收目的基因片段和pET-24a (+),连接后转入E.coli JM109感受态细胞,培养重组菌并抽提质粒。重组质粒经Nde Ⅰ和Hind Ⅲ双酶切验证,结果(图 1)显示,在大约5 300 bp和1 300 bp处有条带,分别与载显体及基因大小一致,表明重组表达载体pET-24a (+)-arcA构建成功。
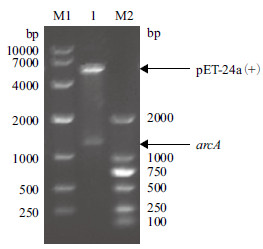 |
| M1:10000 bp DNA Ladder Marker;M2:2000 bp DNA Ladder Marker;1:重组质粒pET-24a (+)-arcA 图 1 重组质粒pET-24a (+)-arcA酶切验证 |
将重组质粒pET-24a (+)-arcA转化E.coli BL21(DE3)感受态细胞,经0.4 mmol/L IPTG诱导培养后收集菌体,处理后得ADI粗酶液。经检测,ADI酶活为26 U/mL发酵液。SDS-PAGE (图 2)分析显示,ADI破壁上清液在大约43 kD处出现一条蛋白条带,与理论ADI分子量相符,表明ADI在E.coli BL21(DE3)中成功表达。
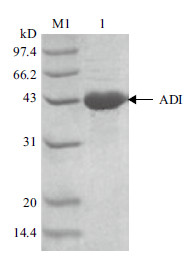 |
| M:蛋白质Marker;1:E.coli BL21(DE3)/pET-24a (+)-arcA破壁上清 图 2 精氨酸脱亚胺酶SDS-PAGE 分析 |
以650 g/L L-精氨酸盐酸盐为底物,加酶量为24 U/g底物,pH6.0,转速100-200 r/min,分别在30℃、37℃、40℃、50℃、60℃和70℃水浴摇床中转化7 h,HPLC检测L-瓜氨酸生成量。图 3表明,高温条件下转化率较低,而低温条件下转化率明显提高,最高值为100%。这是因为低温有利于酶的稳定,而高温时酶的热稳定性较差,反应过程中酶易失活,导致转化率较低,因此37℃为最佳转化温度。
 |
| 图 3 反应温度对酶转化的影响 |
以650 g/L L-精氨酸盐酸盐为底物,加酶量为24 U/g底物,反应温度37℃,转速100-200 r/min,分别在pH4.0、5.0、5.5、6.0、6.5、7.0和8.0中转化7 h,HPLC检测L-瓜氨酸生成量。图 4表明,当初始pH为6.0时,L-瓜氨酸转化率为100%。pH的改变可使酶分子上的侧链基团处于不同的解离状态,影响底物的结合和进一步的反应,或者影响酶的空间结构,从而影响酶的活性,因此过酸或过碱对酶促反应都不利,在pH为6.0时L-瓜氨酸转化率最高。
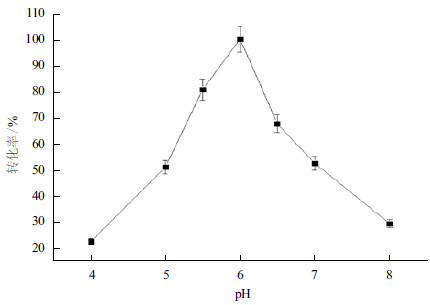 |
| 图 4 反应初始pH 对酶转化的影响 |
以100 g/L L-精氨酸盐酸盐为底物,加入不同量的ADI,加酶量分别为底物12、24和36 U/g,反应温度37℃,pH6.0,转速100-200 r/min,转化3.5 h,HPLC检测L-瓜氨酸生成量。图 5表明,随着加酶量的增多,相同时间内L-瓜氨酸转化率逐渐增大,但是不同加酶量条件下,L-瓜氨酸转化率均能达到100%。考虑到经济性因素,选择加酶量为底物24 U/g。
 |
| 图 5 加酶量对酶转化的影响 |
分别配制浓度为50、100、150、200、300、400和650 g/L的L-精氨酸盐酸盐溶液,加酶量为24 U/g底物,反应温度37℃,pH6.0,转速100-200 r/min,定时取样,HPLC检测L-瓜氨酸生成量。图 6表明,随着L-精氨酸盐酸盐浓度的增大,相同时间内L-瓜氨酸转化率越来越低,但随着转化时间的延长,L-瓜氨酸的浓度不断增加,最终均能达到100%,因此将转化时间定为7 h。
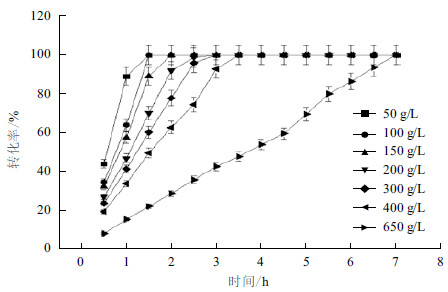 |
| 图 6 底物浓度对酶转化的影响 |
以650 g/L L-精氨酸盐酸盐为底物,加酶量为24 U/g底物,反应温度37℃,pH6.0,分别在转速100、150和200 r/min中转化7 h,HPLC检测L-瓜氨酸生成量。结果显示,不同转速对L-瓜氨酸转化率无影响。
3 讨论早在1971年,来自日本的Kakimoto等[14]就利用Pseudomonas putida ATCC 4359 ADI生产瓜氨酸,以L-精氨酸盐酸盐为底物,反应62 h后转化率达到90.5%;1973年,Chibata等[9]报道同一来源的ADI,以L-精氨酸或DL-精氨酸为底物,可生产瓜氨酸浓度达80 g/L以上;1974年,Yamamoto等[15]用聚丙烯酰胺凝胶包埋上述来源的细胞,可将浓度0.5 mol/L的L-精氨酸盐酸盐完全转化为L-瓜氨酸;2014年,王颖等[16]将来源于Pseudomonas putida ATCC 4359的ADI在E.coli中克隆表达,利用重组菌制备的粗酶液可将20 g/L L-精氨酸有效转化为L-瓜氨酸,转化率高于90%,该酶显示出了与来源于Pseudomonas putida ACCC 10185的ADI 99.76%的同源性。
我国对于其他来源的ADI转化L-精氨酸盐酸盐生成L-瓜氨酸的研究也有一些报道。2005年,曹瑜等[17]利用Streptococcus faecalis NJ402游离细胞的ADI,在10 L转化罐中,可将质量浓度200 g/L的L-精氨酸完全转化成L-瓜氨酸。2006年,张鹏等[18]运用海藻酸钠包埋法固定化Streptococcus faecalis CGMCC 1866细胞生产L-瓜氨酸,L-精氨酸转化率高达99%。2008年,郑璞等[19]利用填充床反应器固定化假单胞菌细胞连续制备L-瓜氨酸,固定化细胞对底物的摩尔转化率在95%以上。同年,姚海峰等[20]利用Streptococcus faecalis BT001,作用于浓度为96 g/L的L-精氨酸,转化率达到98%;2010年,赵艳杰等[21]利用海藻酸钠固定化上述细胞,填充床反应器中连续转化浓度为100 g/L的L-精氨酸底物,摩尔转化率为95.1%;2011年,屈冉[22]利用聚氨酯固定化上述细胞,填充床反应器中转化浓度为100 g/L的L-精氨酸底物,L-瓜氨酸的产量在65 g/L左右。同年,郑雄敏等[23]利用高产ADI Streptococcus faecalis BM-2 CGMCC No.4990菌株,在30 L发酵罐上小试发酵,产L-瓜氨酸量达到98 g/L。2012年,胡延奇[24]利用工程菌中的ADI作用于质量浓度60 g/L的精氨酸,瓜氨酸的产量达55.1 g/L。
本实验在E.coli BL21(DE3)中成功表达了来源于Pseudomonas putida ACCC 10185的ADI,酶活力单位为26 U/mL。重点考察了该重组酶制备L-瓜氨酸的应用,考察了温度、pH、底物浓度、加酶量等对酶转化的影响,在最优条件下能将650 g/L的L-精氨酸盐酸盐完全转化成L-瓜氨酸,均高于上述研究。下一步的研究重点是将该重组菌在3 L发酵罐中进行优化,获得更高表达量的酶液,为工业化奠定基础。同时,该工艺流程简单,操作方便,这为L-瓜氨酸的工业化生产奠定了坚实的基础,具有广阔的实际应用前景。
4 结论本研究成功获得了能够胞内表达ADI的重组E.coli BL21(DE3)菌株,初步实验表明重组菌发酵液ADI酶活可达26 U/mL。采用该重组ADI优化了酶法制备L-瓜氨酸的工艺条件。结果表明,底物L-精氨酸盐酸盐浓度650 g/L,反应pH6.0,温度37℃,加酶量24 U/g底物,转速100-200 r/min,转化时间7 h,L-瓜氨酸转化率可达100%。
| [1] | 张克旭. 氨基酸发酵工艺学[M]. 北京:中国轻工业出版社, 1992. |
| [2] | 胡学智. 日本功能性食品研发信息[J]. 山东食品发酵, 2007 (3):14-15. |
| [3] | 王晶, 赵晶. 一氧化氮的生物学效应[J]. 中国基层医药, 2003, 10(12):1316-1318. |
| [4] | 王冰梅. 瓜氨酸——一氧化氮循环[J]. 中国体育科技, 2005, 41(5):130-131. |
| [5] | 刘娟, 路欣欣, 孟慧. 瓜氨酸的药理作用及生产方法的研究进 展[J]. 药学实践杂志, 2011, 29(3):173-175. |
| [6] | Lutgens L, Lambin P. Biomarkers for radiation- induced small bowel epithelial damage :An emerging role for plasma Citrulline[J]. World Journal of Gastroenterology, 2007, 13(22):3033-3042. |
| [7] | Foyer CH, Descourvoeres P, Kunert KJ. Protect ion against oxygen radicals :an important defence mechanism studied in transgenic plants[J]. Plant Cell and Environment, 1994, 17(5):507-523. |
| [8] | Shinji O, Yo kohama S, Masao S. Method of production citrulline by bacterial fermentation :US, 3282794[P]. 1966-07-16. |
| [9] | Chibata I, Shi S, Kakimoto T, et al. Enzymatic preparation of L-citrulline :US, 3730838[P]. 1973-05-13. |
| [10] | Hermes H, Croes L, Peeters W, et al. Metabolism of amino acid amides in Pseudomonas putida ATCC 12633[J]. Appl Microbiol Biotechnol, 1993, 40 :519-525. |
| [11] | Ni Y, Li Z, Sun Z. Expression of arginine deiminase from Pseudomonas plecoglossicida CGMCC2039 in Escherichia coli and its anti-tumor activity[J]. Curr Microbiol, 2009, 58(6):593- 598. |
| [12] | 刘咏梅, 倪烨, 李娜, 等. 精氨酸脱亚胺酶基因在大肠杆菌中 的克隆、表达及纯化[J]. 食品与生物技术学报, 2011, 30(5): 750-756. |
| [13] | 钱嘉南, 孙志浩, 刘宇鹏, 等. 二乙酰一肟- 氨基硫脲比色法 测定酶转化液中的L- 瓜氨酸[J]. 中国医药工业杂志, 2007, 38(7):519-521. |
| [14] | Kakimoto T, Shibatani T, Nishimura N, et al. Enzymatic production of L-citrulline by Pseudomonas putida[J]. Applied Microbiology, 1971, 22(6):992-999. |
| [15] | Yamamoto K, Sato T, Tosa T, et al. Continuous production of L-citrulline by immobilized Pseudomonas putida cells[J]. Biotechnol Bioeng, 1974, 16(12):1589-1599. |
| [16] | 王颖. 酶法转化制备L- 瓜氨酸暨精氨酸脱亚氨基酶的性质研 究[D]. 济南:山东大学:2014. |
| [17] | 曹瑜, 李加友, 焦庆才. 酶法转化制备L 瓜氨酸[J]. 精细化工, 2005, 22(10):759-761. |
| [18] | 张鹏, 张淑荣, 刘春巧, 等. 固定化细胞连续生产L- 瓜氨酸的 方法:中国, CN1948464A[P]. 2006- 11- 24. |
| [19] | 郑璞, 倪晔, 张文. 填充床反应器中固定化假单胞菌细胞连续 制备L- 瓜氨酸[J]. 食品与生物技术学报, 2008, 27(5): 33-38. |
| [20] | 姚海峰, 张淑荣, 欧成武, 等. 粪链球菌转化合成L - 瓜氨酸 的研究[J]. 食品工业科技, 2008, 29(6):256-258. |
| [21] | 赵艳杰, 曾倡, 张淑荣, 等. 固定化粪链球菌酶法连续生产L- 瓜氨酸[J]. 北京化工大学学报:自然科学版, 2010, 37(4): 98-102. |
| [22] | 屈冉. 聚氨酯固定化粪链球菌制备L- 瓜氨酸的研究[D]. 北 京:北京化工大学, 2011. |
| [23] | 郑雄敏, 王震, 刘倩高. 产精氨酸脱亚胺酶菌株及用它生产L- 瓜氨酸的方法:中国, CN102703339A[P]. 2011-8-29. |
| [24] | 胡延奇. L- 瓜氨酸的工程菌制备及在卷烟中的应用[J]. 食 品工业, 2012, 33(8):55-58. |




