1,3-二羟基丙酮(DHA)是一种重要的精细化工产品,可作为农药合成中间体、精细化工原料和医药前体,用途广泛。DHA的生产方法主要有化学合成法和微生物发酵法,当前的生产方法以化学合成法为主,但从技术的经济型和环境的友好性来看,微生物发酵法更具经济和社会效益。自从1898年Bertrand发现利用细菌可以将甘油转化为DHA后,各国科研人员对微生物发酵甘油生产DHA进行了多方面的研究[1]。
氧化葡萄糖酸杆菌(Gluconobacter oxydans)是一种严格好氧菌,经常被用于氧化甘油生成二羟基丙酮[2, 3, 4, 5, 6]。许多科研人员通过优化工艺参数[7],培养基组成[8]、溶氧[9]、培养方式[10]、反应器类型[11, 12]等方式来达到提高DHA产量的目的。也有人针对高产菌株的选育开展研究,例如从自然界筛选高产菌株[13]或者通过激光诱变[14]获得高产菌株,华东理工大学的魏东芝等[15]申请的专利中公布了一种用重组基因工程质粒pET-gdh和pET-ndh转化大肠杆菌,从而构建得到DHA产量提高的工程菌的方法,Li等[16]通过在乙醇脱氢酶缺失菌株中过量表达甘油脱氢酶提高了G.oxydans的DHA产量。
在G.oxydans菌中存在两条甘油氧化的途径,一条是甘油直接氧化成DHA,由不依赖于NAD的膜系甘油脱氢酶催化,最佳pH为6.0,然后DHA被激酶磷酸化成为磷酸二羟丙酮;另一条途径是甘油被激酶催化成为甘油-3-磷酸,最佳pH为8.5,然后被依赖于NAD的脱氢酶氧化成为磷酸二羟丙酮,磷酸二羟丙酮通过PPP途径分解代谢[17]。甘油发酵生产二羟基丙酮的过程便是利用了不依赖于NAD的膜系甘油脱氢酶(以下简称GDH)的催化作用。该酶以氧气作为最终的电子受体,催化中心定位于周质空间,所以底物运输不必透过细胞膜进入细胞内[18]。已有研究表明,甘油脱氢酶GDH是二羟基丙酮合成过程中的关键酶,提高甘油脱氢酶的表达量将提高底物转化的效率[19, 20]。本研究通过PCR方法获得编码甘油脱氢酶的基因sldAB,构建载体pBBR1MCS-2-sldAB,通过电转化将载体pBBR1MCS-2-sldAB转化进入宿主ATCC621H内,旨在得到过量表达甘油脱氢酶的重组菌株GOX205,为用于工业生产的二羟基丙酮重组菌株的构建进行有益探索。
1 材料与方法 1.1 材料 1.1.1 菌株与质粒本实验所用的菌株为G.oxydans ATCC621H,购自ATCC,由本实验室保藏。大肠杆菌DH5α由本实验室保藏。质粒pBBR1MCS-2由中国农业大学惠赠,该质粒具有卡那霉素抗性,可以在大肠杆菌和氧化葡萄糖酸杆菌中进行转化。
1.1.2 酶与化学试剂基因片段回收试剂盒、质粒提取试剂盒、限制性内切酶、T4连接酶、蛋白酶K、Pfu DNA聚合酶和dNTP均购自TaKaRa公司。
甘露醇、甘油、NaCl、MgSO4·7H2O、酵母抽提物、蛋白胨、化学试剂均为分析纯。
1.1.3 引物设计与合成根据G.oxydans染色体中sldAB基因序列设计引物,上游引物命名为sldab-fw、下游引物命名为sldab-re,分别在上下游引物两端添加Hind Ⅲ、EcoR Ⅰ限制性内切酶酶切位点。引物由上海英骏生物技术有限公司合成。引物序列见表 1。
甘露醇液体培养基(g/L):酵母抽提物5.0,蛋白胨3.0,甘露醇25.0。
甘露醇固体培养基:在上述甘露醇液体培养基中加入1.5%(w/v)琼脂粉。
甘露醇-卡那霉素固体培养基:上述甘露醇固体培养基经高温灭菌并冷却至室温后加入卡那霉素至终浓度为50 μg/mL,混匀后倒入灭菌培养皿中。
LB-卡那霉素固体培养基:LB固体培养基(胰蛋白胨10 g/L,酵母抽提物5 g/L,NaCl 10 g/L,琼脂15 g/L,pH7.5)经高温灭菌并冷却至室温后加入卡那霉素至终浓度为50 μg/mL,混匀后倒入灭菌培养皿中。
电转化培养基(g/L):甘露醇80,酵母抽提物15,MgSO4·7H2O 2.5,甘油0.5,CaCl2 1.5。
种子培养基(g/L):甘油10,酵母抽提物20,KH2PO4 1,MgSO4·7H2O 0.5。
发酵培养基(g/L):甘油30-200,酵母抽提物5,CaCO3 7。
1.2 方法 1.2.1 sldAB基因的扩增利用细菌染色体提取试剂盒,提取氧化葡萄糖酸杆菌ATCC621H的染色体DNA,以其为模板用高保真Pfu DNA聚合酶进行PCR扩增,反应条件:94℃预变性4 min;94℃变性30 s,55℃退火30 s,72℃延伸3 min。PCR产物按照PCR产物回收试剂盒说明书要求进行纯化回收。
1.2.2 质粒pBBR1MCS-2-sldAB的构建将扩增得到的sldAB基因片段4 μL与pBBR1MCS-2质粒4 μL分别加入限制性内切酶Hind Ⅲ、EcoR Ⅰ各0.25 μL,10×酶缓冲液2 μL,用无菌水将总体积补充到20 μL,放于37℃条件下消化1-2 h。用试剂盒对酶切产物分别进行纯化回收。在20 μL连接体系中,加入2 μL 10×T4连接酶缓冲液,1 μL T4连接酶,sldAB基因片段3 μL,根据pBBR1MCS-2片段和sldAB基因片段的电泳条带亮度确定pBBR1MCS-2片段的加入量,加水至20 μL,在16℃条件下连接2-3 h后,通过酶切验证得到pBBR1MCS-2-sldAB质粒。1.2.3电转化法构建重组菌株GOX205采用电转化法将质粒pBBR1MCS-2-sldAB导入氧化葡萄糖酸杆菌ATCC621H中,通过卡那霉素抗性压力进行筛选,具体操作为:(1)制备电转化感受态细胞:将氧化葡萄糖酸杆菌ATCC621H接种于装有50 mL电转化培养基的500 mL摇瓶中,将摇瓶放于30℃,200 r/min的摇床中培养至培养液在600 nm的吸光度达到0.4;将细胞通过在4℃,6 000 r/min条件下离心4 min进行收获,并在30 mL的灭菌过的10%(v/v)甘油中重悬,细胞用冷的10%(v/v)甘油洗3次,最后重悬于2 mL 10%(v/v)甘油中,即为电转化感受态细胞;(2)取400 μL电转化感受态细胞用于电转化,每管感受态细胞加入1 μL pBBR1MCS-2-sldAB质粒,用移液器轻轻吸打均匀,置于冰上;(3)将要转化的混合物加入预冷的1 mm的电转化杯中,立即按下按钮电击,脉冲电压2 000 v;(4)立即加800-1 000 μL甘露醇培养基到转化杯中重悬细胞;(5)将细胞转入合适的培养管中置于30℃摇床中培养3-5 h;(6)吸取100-200 μL的菌液涂布到甘露醇-卡那霉素固体培养基平板上,30℃条件下培养3-5 d;(7)挑选转化子:挑出在甘露醇-卡那霉素固体培养基平板上生长的单菌落,提取质粒后进行酶切实验验证,得到转化子GOX205。
1.2.4 转化子的遗传稳定性实验用传代的方法考察转化子的遗传稳定性,将GOX205在不含卡那霉素的甘露醇斜面上进行连续传代20代,并将第1、10、20代转化子提取质粒后用Pst Ⅰ进行酶切验证。与此同时,进行摇瓶发酵实验,将1、10、20代的转化子分别接种于500 mL摇瓶中,每个摇瓶中均装有150 mL甘油初始浓度为30 g/L的发酵培养基,30℃,200 r/min摇床上进行发酵实验,发酵16 h达到发酵终点。比较第1、10、20代转化子的甘油到DHA的转化率。转化率计算公式如下:

利用分光光度计测定发酵液在600 nm处的吸光度,以OD600表示。
1.2.5.2 甘油和DHA的测定高效液相法,Agilent 1100 HPLC仪,流动相为乙腈:水(90:10),色谱柱为Lichrospher 5-NH2(4.6 mm×250 mm),甘油采用示差检测器,柱温35℃,DHA采用紫外检测器,检测波长:271 nm[21]。
1.2.5.3 相对酶活力测定发酵进入稳定期后分别取重组菌株GOX205和出发菌株的发酵液20 mL,8 000 r/min离心10 min收集细胞,将细胞洗涤两次后用磷酸缓冲液(pH6.0)稀释成在OD600处吸光度值相同的细胞悬浮液。在250 mL的三角瓶中加入1 mL的细胞悬液和30 mL 1 mol/L的甘油,30℃,200 r/min反应1 h,检测生成的DHA的量。将1 mL出发菌株的细胞悬液中GDH的酶活力设为1,根据DHA量计算1 mL重组菌株GOX205细胞悬液中GDH的相对酶活力。
2 结果 2.1 目的基因sldAB的获得利用PCR方法扩增目的基因sldAB,并将反应产物进行琼脂糖凝胶电泳分析,结果(图 1)显示,扩增得到的片段大小为3 000 bp左右,经测序比对与目的基因sldAB的同源性为100%。
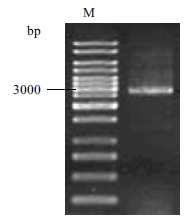 |
| 图 1 sldAB 基因的扩增 |
重组质粒pBBR1MCS-2-sldAB分别用BamH Ⅰ和EcoR Ⅰ酶切,经琼脂糖凝胶电泳上跑胶验证。若质粒构建成功,则经过BamH Ⅰ后应出现大小分别为2 181 bp和6 012 bp的条带;用EcoR Ⅰ酶切,应出现一条8 193 bp的条带。结果(图 2)显示,重组质粒构建成功。
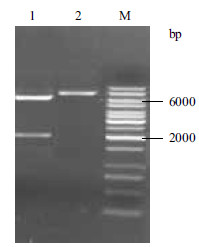 |
| 1:BamH Ⅰ酶切;2:EcoR Ⅰ酶切;M:DNA Marker 图 2 pBBR1MCS-2-sldAB 质粒酶切图谱 |
第1、10、20代转化子在提取质粒并用BamHⅠ酶切后,结果(图 3)显示,经过20次传代后,并未发生质粒丢失或回复突变现象,说明该重组菌株遗传性能稳定。同时,对1、10、20代的转化子进行发酵性能实验,其16 h转化率分别为88.6%、89.8%和88.4%。结果(图 4)表明,经过20次传代后,转化子的发酵性能无明显变化。
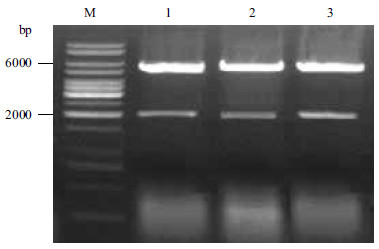 |
| M:DNA Marker;1:第1代;2:第10代;3:第20代 图 3 转化子稳定性的验证 |
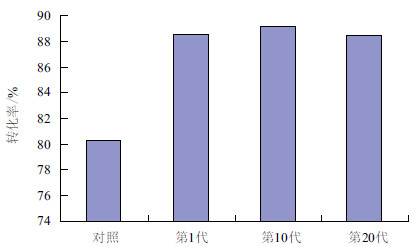 |
| 图 4 转化子稳定性的验证(发酵实验) |
将GOX205与出发菌株在相同的摇瓶培养条件下(甘油初始浓度100 g/L,30℃,200 r/min)发酵至40 h时,两菌株均已进入稳定期,分别取两种发酵液制备相同浓度的细胞悬液,测定GDH的活力。结果(图 5)显示,相同细胞浓度条件下,重组菌株GOX205的酶活力是出发菌株的1.26倍。说明通过sldAB基因的过量表达,GDH的表达量有了明显的提高。
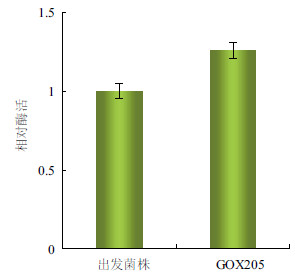 |
| 图 5 重组菌株GOX205 的相对酶活 |
在5 L发酵罐中进行发酵实验考察重组菌株GOX205的发酵性能。发酵培养基中甘油初始浓度为100 g/L,发酵温度30℃,通气量为6 vvm,培养时间为52 h,跟踪测定发酵过程中发酵液吸光度变化与甘油消耗及DHA生成情况。同时将出发菌株ATCC621H做平行对照。结果(图 6-图 8)表明,在100 g/L的甘油发酵液中,GOX205的生长状况良好,DHA浓度达到94.1 g/L,较之于ATCC621H提高了19.7%,甘油残量较之于ATCC621H降低了15.1 g/L。
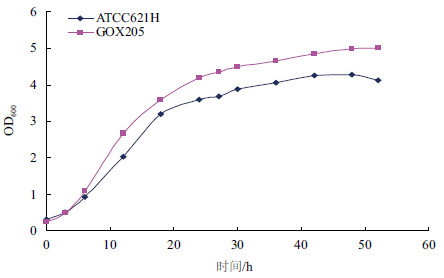 |
| 图 6 重组菌株GOX205 与出发菌株生长性能比较 |
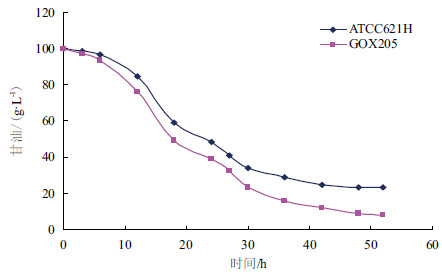 |
| 图 7 重组菌株GOX205 与出发菌株甘油消耗性能比较 |
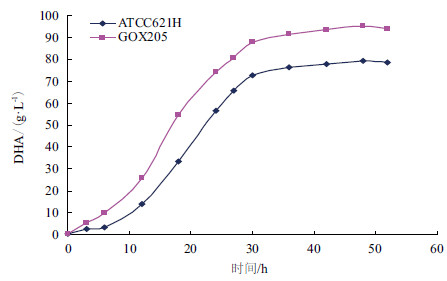 |
| 图 8 重组菌株GOX205 与出发菌株DHA 产量比较 |
底物抑制和产物抑制被认为是制约G.oxydans转化甘油生成DHA的转化效率的重要因素。高浓度的DHA会阻碍甘油的进一步氧化,这种抑制作用对细胞产生不可逆的损害,以至于细胞的活力随时间指数下降,其间GDH的活力也受到影响[22, 23]。在本研究中,当提高甘油初始浓度至150 g/L和200 g/L时,5 L发酵罐间歇发酵时重组菌株GOX205的DHA产量分别达到133 g/L和124 g/L,而出发菌株的DHA产量分别为96 g/L和90 g/L。这说明当GDH的表达量增大时底物抑制作用会降低,细胞活性能够得以保持,这与Gatgens等[20]的研究结论一致。同时Gatgens等[20]的研究表明,过量表达sldAB基因时采用强启动子可以使得sldB基因的表达量显著提高,并且采用强启动子表达的菌株在甘油初始浓度提高时显示出更高的底物抑制消除作用。
在G.oxydans的细胞内,大部分甘油被GDH氧化成为DHA,同时一小部分被膜系乙醇脱氢酶(ADH)氧化生成甘油醛,进而转化为甘油酸[24],Habe等[25]构建了adhA基因敲除的突变菌株,在甘油初始浓度100 g/L的间歇发酵中,G.oxydans野生菌在2 d内消耗完大部分甘油,DHA产量为54.3 g/L,而突变菌株在相同的时间内产生DHA 74.8 g/L,当甘油初始浓度进一步增加时,突变菌株的优势更加明显。在本研究中,重组菌株的相对酶活力较之于出发菌株提高了26%,而Li等[16]的研究显示,在ADH缺失的菌株中过量表达sldAB时,GDH的酶活力较之于出发菌株可提高58%。与之类似的是,Gatgens等[20]在葡萄糖酸-2-脱氢酶缺失菌株中过量表达sldAB时,DHA的产量也高于在野生型菌株中过量表达。这提示我们,微生物的基因彼此之间存在相互关联,要获得更高的DHA产量,除了在过量表达sldAB时引入强启动子,还可以结合代谢工程手段寻找与DHA生成相关的多个基因进行一系列基因工程操作。
4 结论本研究中,通过利用基因工程手段过量表达编码DHA合成途径关键酶--甘油脱氢酶的sldAB基因,构建了重组菌株GOX205,该菌株具有稳定的遗传性能,其发酵甘油生产DHA的性能较出发菌株有明显的提高。
| [1] | Mishra R, Jain SR, Kumar A. Microbial production of dihydroxyacetone[J]. Biotechnol Adv, 2008, 26(4):293-303. |
| [2] | Ohrem Leonhard H, Voβ H. Process model of the oxidation of glycerol with Gluconobacter oxydans[J]. Process Biochemistry, 1996, 31(3):295-301. |
| [3] | Raska J, Skopal F, Komers K, et al. Kinetics of glycerol biotransformation to dihydroxyacetone by immobilized Gluconobacter oxydans and effect of reaction conditions[J]. Collect Czechoslov Chem Commun, 2007, 72(9):1269-1283. |
| [4] | 魏胜华. 氧化葡萄糖杆菌转化甘油制备二羟基丙酮的过程工程 研究[D]. 上海:华东理工大学, 2006. |
| [5] | Claret C, Salmon JM, Romieu C, et al. Physiology of Gluconobacter oxydans during dihydroxyacetone production from glycerol[J]. Appl Microbiol Biotechnol, 1994, 41 :359-365. |
| [6] | Deppenmeier U, Hoffmeister M, Prust C. Biochemistry and biotechnological applications of Gluconobacter strains[J]. Appl Microbiol Biotechnol, 2002, 3 :233-242. |
| [7] | Wethmar M, Deckwer W. Semisynthetic culture medium for growth and dihydroxyacetone production by Gluconobacter oxydans[J]. Biotechnology Techniques, 1999, 13(4):283-287. |
| [8] | Wei S, Song Q, Wei D. Production of Gluconobacter oxydans cells from low-cost culture medium for conversion of glycerol to dihydroxyacetone[J]. Prep Biochem Biotechnol, 2007, 37(2): 113-121. |
| [9] | Svitel J, Sturdik E. Product yield and by-product formation in glycerol conversion to dihydroxyacetone by Gluconobacter oxydans[J]. J Ferment Bioeng, 1994, 78 :351-355. |
| [10] | Wei S, Song Q, Wei D. Repeated use of immobilized Gluconobacter oxydans cells for conversion of glycerol to dihydroxyacetone[J]. Prep Biochem Biotechnol, 2007, 37(1):67-76. |
| [11] | Hekmat D, Bauer R, Neff V. Optimization of the microbial synthesis of dihydroxyacetone in a semi-continuous repeated-fed-batch process by in situ immobilization of Gluconobacter oxydans[J]. Process Biochemistry, 2007, 42 :71-76. |
| [12] | Hekmat D, Bauer R, Fricke J. Optimization of the microbial synthesis of dihydroxyacetone from glycerol with Gluconobacter oxydans[J]. Bioprocess Biosyst Eng, 2003, 26 :109-116. |
| [13] | 徐美娟, 饶志明, 沈微, 等. 一株以甘油为底物产二羟丙酮 (DHA)微生物菌种的筛选及鉴定[J]. 微生物学通报, 2008, 35(3):336-340. |
| [14] | 马丽娟. 生物法生产1, 3- 二羟基丙酮产品研究[D]. 天津: 天津大学, 2009. |
| [15] | 魏东芝, 马兴元, 郑宇. 生产二羟基丙酮的基因工程菌, 其构 建方法机器用途[P]. CN 101092604A, 2007-12-26. |
| [16] | Li MH, Wu J, Liu X, et al.Enhanced productiono fdihydroxyacetone from glycerol by overexpression of glycerol dehydrogenase in an alcohol dehydrogenase-deficient mutant of Gluconobacter oxydans[J]. Bioresource Technology, 2010, 101 : 8294-8299. |
| [17] | Bories A, Claret C, Soueaille P. Kinetic study and optimization of the production of dihydroxyacetone from glycerol using Gluconobacter oxydans[J]. Process Biochem, 1991, 26 :243-248. |
| [18] | Gupta A, Singh VK, Qazi GN, et al. Gluconobacter oxydans :Its biotechnological applications[J]. J Mol Microbiol Biotechnol, 2001, 3 :445-456. |
| [19] | Shinjoh M, Tomiyama N, Miyazaki T, et al. Main polyol dehydrogenase of Gluconobacter suboxydans IFO 3255, membranebound D-sorbitol dehydrogenase, that needs product of upstream gene, sldB, for activity[J]. Biosci Biochem, 2002, 66 :2314- 2322. |
| [20] | Gatgens C, Degner U, Bringer-Meyer S, et al. Biotransformation of g lycerol to dihydroxyacetone by recombinant Gluconobacter oxydans D SM 2343[J]. Appl Microbiol Biotechnol, 2007, 76(3):553-559. |
| [21] | 陈菁, 陈建华, 周怡雯, 等. 高效液相色谱法检测发酵液中二 羟基丙酮和甘油的含量[J]. 中国生化药物杂志, 2007, 28(3): 170-172. |
| [22] | Claret C, Bories A, Soucaille P. Glycerol inhibition of growth and dihydroxyacetone production by Gluconobacter oxydans[J]. Current Microbiology, 1992, 25 :149-155. |
| [23] | Bauer R, Katsikis N, Varga S, et al. Study of the inhibitory effect of the product dihydroxyacetone on Gluconobacter oxydans in a semicontinuous two-stage repeated-fed-batch process[J]. Bioprocess and Biosystems Engineering, 2005, 28(1):37-43. |
| [24] | Habe H, Shimada Y, Yakushi T, et al. Microbial production of glyceric acid, an organic acid that can be mass produced from glycerol[J]. Appl Environ Microbiol, 2009, 75(24):7760- 7766. |
| [25] | Habe H, Fukuoka T, Morita T, et al. Disruption of the membranebound alcohol dehydrogenase-encoding gene improved glycerol use and dihydroxyacetone productivity in Gluconobacter oxydans[J]. Biosci Biotechnol Biochem, 2010, 74(7):1391-1395. |




