副溶血性弧菌为革兰氏阴性嗜盐菌,自然环境中主要存在于河口和沿海中,与水产品污染密切相关,常引起大量鱼类和贝类的感染,造成巨大的经济损失,经常能从生的海鲜品中分离到[1, 2]。食用被其污染的食物可造成急性肠胃炎,表现特征是腹泻、头痛、呕吐、恶心、腹痛和低烧,严重时会引起急性败血症。副溶血性弧菌引起的肠胃炎主要发生在每年4-10月份,在2003-2008年中,该菌引起的肠胃炎的爆发有322起,导致9 041人患病,3 948人住院治疗,流行病学数据显示副溶血性弧菌在亚洲、南美、美国等地,是引起食物性感染的主要原因。在中国,该菌已经成为引起食物中毒的首要病原菌,尤其是在一些沿海城市,其比例超过60%[3, 4, 5, 6]。副溶血性弧菌引起的食物性感染已成为一个不容忽视的问题!为了控制和防止它在水产品饲养中的污染,主要措施是使用消毒剂和抗生素,但这存在明显的弊端,即:细菌耐药性的产生、抗生素药物的残留、对水生动物体内微平衡以及免疫力的破坏,因此寻找其他绿色有效抑菌物质越来越引起人们关注。
黄芩是常用的多年生药用植物,根部是天然无毒产品,含有30多种黄酮类物质,活性物质主要是黄芩苷、汉黄芩素、木蝴蝶素A,其结构如图 1所示。它们具有多种药理作用,例如抗氧化、抗菌、抗炎、抗癌等[7, 8, 9, 10]。虽然关于黄芩提取物的抑菌活性研究有较多报道,但是应用于致病性副溶血性弧菌的研究未见报道。本实验首次通过黄芩对致病性副溶血性弧菌的抑菌活性及机制进行研究,旨在为开发低毒高效、用于水产养殖的绿色抗菌药物及寻找新的药物靶点提供参考。
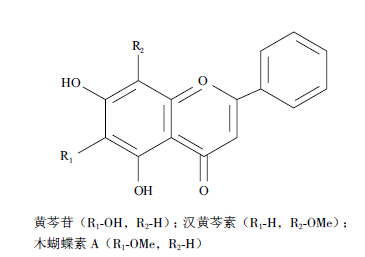 |
| 图 1 黄芩有效成分的结构 |
供试菌株为副溶血性弧菌,由本实验室保存。 1.1.2 中药粗提物
称取黄芩、黄连、大黄、金银花各5.00 g,用50 mL 70%乙醇80℃提取两次,每次1 h。合并提取液,旋转蒸发仪浓缩至浓度为0.5 g/mL,过滤(0.2 μm)除菌后置于4℃冰箱保存。 1.1.3 培养基
LB培养基:1% NaCl,1% peptone,0.5% yeast extract。 1.1.4 主要试剂和仪器
丙烯酰胺(Acrylamide),甲叉双丙烯酰胺(Bis-acrylamide),三羟甲基氨基甲烷(Tris),十二烷基硫酸钠(SDS),考马斯亮蓝R-250/G250(Coomassie brilliant blue R-250/G250)等试剂购于上海Sangon生物工程有限公司;无水乙醇、甲醇、冰乙酸、浓盐酸等试剂购于汕头西陇化工有限公司;TDL-5-A型低速大容量离心机(上海安亭科学仪器厂);UV-2102C紫外可见分光光度计(上海优尼柯仪器有限公司);SPX-250B型生化培养箱(上海跃进医用光学仪器厂);JSM-6360LA扫描电镜。 1.2 方法 1.2.1 中药醇提取物对副溶血性弧菌敏感性实验 1.2.1.1 牛津杯法
取100 μL稀释至107 CFU/mL的菌液,均匀涂布平板,将中药粗提液200 μL加入到牛津杯中,以无菌水为阴性对照,20 μg/mL卡那霉素为阳性对照。先在4℃冰箱中放置4 h待药液扩散一段时间,然后再移至37℃培养16 h后观察,测定抑菌圈大小。 1.2.1.2 液体倍比稀释法
采用二倍倍比稀释法测定中药粗提液的最低抑菌浓度(MIC),以不加粗提液为阴性对照,不浑浊的最低药物浓度为MIC值。 1.2.1.3 平皿法测定最低杀菌浓度(MBC)
根据MIC的观察结果,将培养液划线于LB培养基上。平皿内无细菌生长的最小药物浓度为MBC值。 1.2.2 抑菌机制的分析 1.2.2.1 副溶血性弧菌生长曲线的绘制
将100 μL已培养12 h的副溶血性弧菌加入到含1/2MIC和MIC粗提液的100 mL LB培养基中,以不加粗提液为阴性对照。37℃摇床培养,每隔2 h取样测OD,连续测量16 h,绘制出药物组和对照组的生长曲线(λ=600 nm)。 1.2.2.2 杀菌曲线的绘制[11]
在4 mL培养液中加入粗提液,使终浓度为MIC和2MIC,以不加粗提液为阴性对照。每管中加入稀释后的副溶血性弧菌使其浓度为105-106 CFU/mL。37℃摇床培养,每隔2 h取100 μL菌液采用平板计数(T=0、2、4、6和8 h)。然后平板在37℃下培养16 h,记录菌落形成数量。最后以时间为横坐标,每毫升菌落形成单位的对数值为纵坐标作图绘制杀菌曲线。 1.2.2.3 扫描电镜观察[12]
将培养至对数期的副溶血性弧菌按2%接种量,接种到含MIC粗提液的培养液中,以不加粗提液为阴性对照。37℃摇床培养,6 h后取样,离心去上清,2.5%的戊二醛4℃固定过夜后用0.2 mol/L的PBS (pH7.4)洗3次,然后依次用30%、50%、70%、85%、90%和100%乙醇脱水一次,每次15 min,最后涂片、干燥、喷金,在扫描电镜JSM-6360LA下观察。 1.2.2.4 对细胞膜的作用[13]
用Bradford法测蛋白浓度,首先分别加0、20、40、60、80和100 mL 1 mg/mL的牛血清蛋白到5 mL的Bradford中,室温显色5 min,于721分光光度计下,595 nm作比色测定,绘制标准曲线。将培养至对数期的副溶血性弧菌按2%接种到含MIC粗提液的培养液中,以不加药液为阴性对照。37℃摇床培养,每隔2 h (T=0、2、4和8 h)取样,离心,收集上清,测蛋白浓度,每组测定3次。 1.2.2.5 SDS-PAGE和细胞可溶性蛋白含量的测定
将培养至对数期的副溶血性弧菌按2%接种到含MIC粗提液的培养液中,以不加药液为阴性照组。37℃摇床培养,收集2、4、6和8 h菌体(0.05 g湿重)超声破碎提取蛋白。选用5%浓缩胶,10%分离胶,染色液用0.5%考马斯亮蓝R-250,上样40 μL进行电泳。Bradford法测定可溶性蛋白浓度,每组测定3次。 2 结果 2.1 黄芩等醇提取物对副溶血性弧菌的抑制活性及MIC和MBC
牛津杯法测定结果(表 1和图 2)显示,不同中药醇提物对副溶血性弧菌的抑制活性有很明显的差异,其中黄芩的效果最好,金银花的效果最差,抑菌圈直径分别是22.00±1.00 mm和15.00 mm,虽然都小于卡那霉素形成的抑菌圈(24.00±2.64 mm),但是黄芩形成抑菌圈的大小与其相差较小,而阴性对照组则无抑菌圈的形成。最低抑菌浓度(MIC)是评价抗菌药物抑菌活性的指标,指在体外用培养基培养16-24 h后,能抑制细菌生长的最低药物浓度。最低杀菌浓度(MBC)则是指将细菌杀死的最低药物浓度。MIC和MBC的结果(表 2)也进一步显示,不同中药粗提液对副溶血性弧菌的抑制活性存在很大差异。其中黄芩对副溶血性弧菌有十分明显的抑制效果,MIC和MBC均为3.91 mg/mL。而其他中药的效果较差,MIC为15.64 mg/mL。基于上述结果,在随后的机制研究中,以黄芩为研究对象。
 |
| 图 2 不同中药对副溶血性弧菌的抑菌圈 |
生长曲线结果(图 3)显示,对照组的细菌生长具有典型的生长特征,呈S型生长曲线。当菌液中添加1/2MIC药物时,细菌的活性被部分抑制,细菌的延迟期长达8 h,但是之后细菌也可以进入正常的对数期和稳定期,而且菌的终浓度与对照差距较小。当药物浓度是MIC时,细菌菌液的OD值处于一个平稳状态,基本没有变化。这说明在MIC溶度下黄芩醇提物将细菌完全抑制或杀灭,因此细菌不能生长。
 |
| 图 3 加入不同溶度黄芩后副溶血性弧菌的生长曲线 |
黄芩醇提物的杀菌效率通过杀菌曲线来评价。杀菌曲线结果(图 4)显示,黄芩的抑菌活性与药物浓度存在依赖性。随着培养时间延长,对照组的菌数稳定增加。而当药液为MIC和2MIC时,菌的数量逐渐减少,并且当药液为MIC时,需要8 h才能将菌全部杀死,当药液为2MIC时,第6 h菌已经被完全杀死。
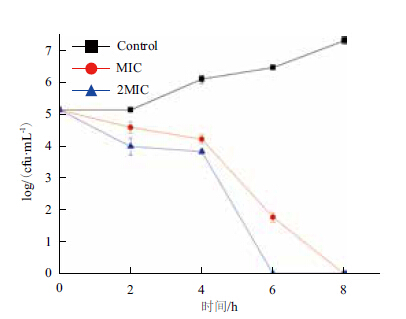 |
| 图 4 黄芩对副溶血性弧菌的杀菌曲线 |
扫描电镜可以用来观察微生物细胞在面对外界压力时的形态变化,对照组的菌体(图 5-A)为长杆状,表面光滑,形态饱满,没有细胞破损情况。而用药组中,有部分菌体(图 5-B)发生明显变化,表面粗糙,扭曲变形,并且开始裂解。
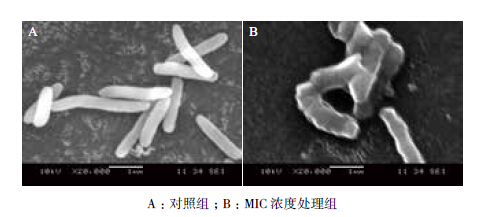 |
| 图 5 副溶血性弧菌培养6 h 后电镜观察结果 |
黄芩醇提物对副溶血性弧菌细胞膜的作用通过测定上清液蛋白含量来评价,结果(图 6)显示,经黄芩处理后,培养液中的蛋白含量随着时间的增加而升高,在第8 h时的蛋白含量约为初始时的两倍。而对照组培养液的蛋白含量虽然出现不规律的变化,但是一直在较低的水平内变化。说明经黄芩处理后,菌体的细胞膜受到破坏,蛋白质释放,导致培养液中蛋白含量升高。
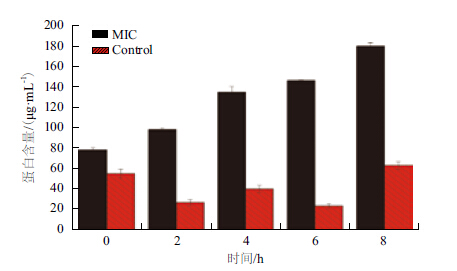 |
| 图 6 副溶血性弧菌经黄芩处理后蛋白释放情况 |
通过SDS-PAGE来确定黄芩对副溶血性弧菌的可溶性蛋白的影响,结果(图 7)显示,经黄芩作用后,与对照组相比,加药组的副溶血性弧菌蛋白表达在2、4、6和8 h中基本不受影响,没有条带的明显缺失或颜色变浅。经Bradford法测其蛋白浓度,结果(图 8)显示,在2、4、6和8 h时,加药组的总蛋白含量也无明显变化(P>0.05),说明黄芩对副溶血性弧菌的蛋白表达没有影响。
 |
| 图 7 副溶血性弧菌经黄芩处理后蛋白变化情况 |
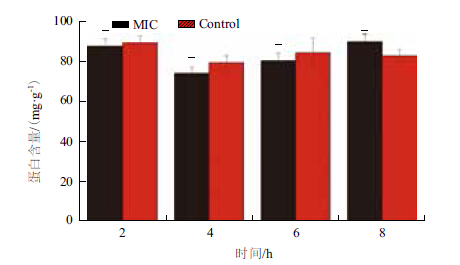 |
| 图 8 副溶血性弧菌经黄芩处理后可溶性蛋白含量变化情况 |
近年来抗生素在水产养殖中的滥用,使得药物残留以及细菌耐药性的问题越来越严重,寻找绿色药物来代替抗生素引起人们的关注。具有抗菌消炎作用的中草药在我国已经有几千年的历史,由于它们的低毒、低残留等优点受到人们的青睐。本研究希望从已证实的有较好抑菌活性的黄芩、大黄、黄连、金银花中筛选出对副溶血性弧菌有较强抑制作用的中药[14, 15, 16, 17]。抑菌圈结果显示,4种中药对副溶血性弧菌的抑制活性有很大的差异,并且MIC和MBC也与抑菌圈的关系一致,即抑菌圈直径越大MIC和MBC越小。黄芩对副溶血性弧菌的抑菌效果最为显著,这与Rashed等[18]和Duan等[11]的研究一致,他们发现黄芩对G-和G+都具有很好的抑菌效果。其他3种中药对副溶血性弧菌的抑制效果较差,可能是它们有效成分对副溶血性弧菌没有明显的抑制活性或者由于提取方法不当,导致抑菌活性不高。如在张锐利[19]和时维静[20]的研究中,也发现通过不同提取方法所得到提取物的抑菌效果相差很大。
菌液的OD600值能够衡量细菌的数量,因此OD600的变化可以反映黄芩醇提物对副溶血性弧菌的抑制和杀灭作用。结果发现黄芩抑制副溶血性弧菌主要是延长细菌的延迟期,而在一段时间之后细菌依然能够进入正常的稳定期,而且数量也与对照组一致。杨艾青[21]在研究黄芩对沙门氏菌的生长曲线时也发现延迟期被延长的结果,但最后达到的菌浓度比对照组低很多。杀菌曲线的结果也显示,在前6 h时,随着时间的延长,黄芩的杀菌效果变弱,这与Duan等[11]在研究黄芩提取物对链球菌的抑制活性时得到的结果一致。基于此结果,在后面实验的取样测量中选择前8个小时的生化作为参考指标。
细菌的许多代谢过程都与细胞膜功能相关,而细胞膜结构的完整是行使正常功能的重要保证。完整的细胞膜具有选择透过性,带电离子和大分子物质无法自由通过细胞膜屏障,而当细胞膜完整性遭到破坏时,首先会导致小分子物质如钠钾离子的释放,然后是大分子的蛋白核酸等物质释放到培养液中[22]。如Ikigai等[23]通过脂质体模型,发现黄酮类物质对细胞膜造成破坏,导致小分子物质从胞内渗透出来。Sato等[24]在研究黄酮类物质对口腔微生物的抑制活性时,发现上清液260 nm处的吸光值增加,反应细胞内的核酸等物质的渗漏,说明破坏了细胞膜的完整性。本研究通过测定上清液蛋白浓度来判断细菌细胞膜是否受到损伤。结果显示,经过黄芩处理后,上清液的蛋白浓度不断上升,而对照组的变化很小。而且He等[25]通过同样的方法,也发现大肠杆菌经黄酮类物质处理后上清液蛋白含量显著性提高。本实验中,扫描电镜观察到细菌形态的变化,表面变得粗糙,不光滑,表明黄芩对副溶血性弧菌的细胞膜产生破坏作用。Sikkema等[26]报道大部分膜活性抑菌物质是强疏水性的,因为疏水性有助于它们在细胞膜上积累,干扰其结构,并且可以通过与细胞壁细胞膜的相互作用对细胞膜造成破坏,导致通透性增加,而黄芩的主要活性成分正是具有较强疏水性的黄酮类物质。而且在Tsuchiya等[27]的研究报道中,也发现由于黄酮类物质的疏水性以及C3位的电荷与细胞膜的相互作用,改变了细胞膜的流动性。因此副溶血性弧菌的细胞膜是黄芩的一个作用靶点。在Lee等[28]的研究中也报道了黄酮类物质直接对细胞膜的破坏作用。黄芩对副溶血性弧菌的具体抑制机制以及是否存在除了细胞膜之外的其他靶点,需要进一步的研究。
另一方面,由于蛋白质在生命活动中扮演着重要的角色,生物合成都离不开蛋白质的参与,所以通过对细胞蛋白提取来进一步探索黄芩是否会通过抑制蛋白质的表达而达到抑菌效果。虽然Yong等[29]研究抗菌植物对大肠杆菌的抑菌机制时,发现了7种与蛋白转运和外膜有关的蛋白合成受到抑制;陈禹先等[30]也发现黄芩素能强烈抑制耐甲氧西林金黄色葡萄球菌蛋白的表达,但是副溶血性弧菌经黄芩处理后,SDS-PAGE的结果显示,在不同的处理时间下,蛋白的条带并没有发生明显变化。进一步对细菌可溶性蛋白含量测定说明,黄芩处理组与对照组的蛋白含量没有显著性差异(P>0.05),说明黄芩对副溶血性弧菌不是通过抑制蛋白合成而起作用。 4 结论
本研究从常见的4种抑菌中药黄芩、黄连、大黄、金银花中筛选对副溶血性弧菌有较好抑制效果的中药,并对其抑菌机制进行初步研究。结果表明,黄芩对副溶血性弧菌具有很好的抑制效果,并且其抑菌机制主要是黄酮类物质对细胞膜造成破坏,最终导细胞的裂解死亡。
| [1] | Li CC,Ye ZC.Identification of a novel vaccine candidate by immunogenic screening of Vibrio parahaemolyticus outer membrane proteins[J].Vaccine,2014,32:6115-6121. |
| [2] | Joseph SW,Colwell RR,Kaper JB.Vibrio parahaemolyticus and related halophilic Vibrios[J].Critical Reviews in Microbiology, 1982,10(1):77-124. |
| [3] | Suffredini E,Mioni R,Mazzette R,et al.Detection and quantification of Vibrio parahaemolyticus in shellfish from Italian production areas[J].International Journal of Food Microbiology,2014,184: 14-20. |
| [4] | Su YC,Liu C.Vibrio parahaemolyticus:a concern of seafood safety[J].Food Microbiology,2007,24(6):549-558. |
| [5] | Wu YN,Wen J,Ma Y,et al.Epidemiology of foodborne disease outbreaks caused by Vibrio parahaemolyticus,China,2003- 2008[J].Food Control,2014(46):197-202. |
| [6] | 陈瑞英,鲁建章,苏意诚,等.食品中副溶血性弧菌的危害分析、检测与预防控制[J].食品科学,2007,28(1):341-346. |
| [7] | Golmakani E,Mohammadi A,Ahmadzadeh Sani T,et al.Phenolic and flavonoid content and antioxidants capacity of pressurized liquid extraction and perculation method from roots of Scutellaria pinnatifida A.Hamilt.subsp alpina (Bornm) Rech.f.[J].The Journal of Supercritical Fluids,2014,95:318-324. |
| [8] | Sato Y,Suzaki S,Nishikawa T.Phytochemical flavones isolated from Scutellaria barbata and antibacterial activity against methicillin-resistant Staphylococcus aureus[J].Journal of Ethnopharmacology,2000,72:483-488. |
| [9] | Kim EH,Shim B,Kang S.Anti-inflammatory effects of Scutellaria baicalensis extract via suppression of immune modulators and MAP kinase signaling molecules[J].Journal of Ethnopharmacology, 2009,126:320-331. |
| [10] | Park HS,Park KI,Hong GE.Korean Scutellaria baicalensis Georgi methanol extracts inhibits metastasis via the Forkhead Box M1 activity in hepatocellular carcinoma cells[J].Journal of Ethnopharmacology,2014,155:847-851. |
| [11] | Duan CY,Matsumura SS,Kariya N,et al.In vitro antibacterial activities of Scutellaria baicalensis Georgi against cariogenic bacterial[J].Pediatric Dental Journal,2007,17(1):58-64. |
| [12] | Rinki Dandapat,Bhabani Sankar,Jena,Pradeep Singh Negi. Antimutagenic and antibacterial activities of Peltophorum ferrugineum flower extracts[J].Asian Pacific Journal of Tropical Disease,2012:S778-S782. |
| [13] | Wang CJ,Chang T,Yang H,et al.Antibacterial mechanism of lactic acid on physiological and morphological properties of Salmonella Enteritidis,Escherichia coli and Listeria monocytogenes[J].Food Control,2014,6(34):231-236. |
| [14] | 任艳芳,刘畅,何俊瑜,等.基于中药乙醇提取物的柑橘采后保鲜与抑菌技术[J].农业机械学报,2012,4(5):122-129. |
| [15] | Bandyopadhyay S,Patra PH,Mahanti A.Potential antibacterial activity of berberine against multi drug resistant enterovirulent Escherichia coli isolated from yaks (Poephagus grunniens) with haemorrhagic diarrhoea[J].Asian Pacific Journal of Tropical Medicine,2013,4:315-319. |
| [16] | Raudsepp P,Anton D,Roasto M.The antioxidative and antimicrobial properties of the blue honeysuckle (Lonicera caerulea L.),Siberian rhubarb (Rheum rhaponticum L.) and some other plants,compared to ascorbic acid and sodium nitrite[J].Food Control,2013,31(1):129-135. |
| [17] | 周小楠,董群.金银花等6种中草药对痢疾杆菌体外抑菌效果研究[J].安徽农业科学,2012,40(6):3278-3279. |
| [18] | Rashed K,Ciric A.Antimicrobial and cytotoxic activities of Alnus rugosa L.aerial Parts and identification of the bioactive components[J].Industrial Crops and Products,2014,59:189- 196. |
| [19] | 张锐利,包东东,刘华英.不同提取方法对北五昧子提取物抑茵活性的影响[J].安徽农业科学,2010,38(24):13177- 13179. |
| [20] | 时维静,赵浩如,路振香.黄连解毒栓不同提取方法及制备工艺的研究[J].中国实验方剂学杂志,2005,11(4):2-4. |
| [21] | 杨艾青,艾启俊,张德权.几种中草药乙醇提取物对沙门氏菌生长特性曲线的影响[J].中国农学通报,2011,7(14):73- 76. |
| [22] | Beveridge EG,Boyd I,Dew I.Haswell M.Electron and light microscopy of damaged bacteria[M]//In Mechanisms of action of chemical biocides.Oxford,UK:Blackwell scientific publications, 1991:135-153. |
| [23] | Ikigai H,Nakae T,Hara Y,Shimamura T.Bactericidal catechins damage the lipid bilayer[J].Biochim Biophys Acta,1993,11 (47):132-136. |
| [24] | Sato M,Tsuchiya H,Akagiri M,et al.Growth inhibition of oral bacteria related to denture stomatitis by anticandidal chalcones[J].Aust Dental Journal,1997,42:343-346. |
| [25] | He MY,Wu T,Pan SY,et al.Antimicrobial mechanism of flavonoids against Escherichia coli ATCC 25922 by model membrane study[J].Applied Surface Science,2014,305:515- 521. |
| [26] | Sikkema J,de Bont JA,Poolman B.Mechanisms of membrane toxicity of hydrocarbons[J].Microbiological Reviews,1995,59 (2):201-222. |
| [27] | Tsuchiya H,Iinuma M.Reduction of membrane fluidity by antibacterial sophoraflavanone G isolated from Sophora exigua[J].Phytomedicine,2000,7(2):161-165. |
| [28] | Lee SY,Kim KBWR,Lim SI,Ahn DH.Antibacterial mechanism of Myagropsis myagroides extract on Listeria monocytogenes[J]. Food Control,2014,42:23-28. |
| [29] | Yong AL,Ooh KF,Ong HC,et al.Investigation of antibacterial mechanism and identification of bacterial protein targets mediated by antibacterial medicinal plant extracts[J].Food Chemistry, 2014,11:1-21. |
| [30] | 陈禹先,周彤,谢鲲鹏,等.黄芩素对耐甲氧西林金黄色葡萄球菌抑茵机制的研究[J].畜牧兽医学报,2013,44(12): 2000-2006. |





