苏云金芽胞杆菌(Bacillus thuringiensis,Bt)是一种能产生杀虫晶体蛋白(Insecticidal crystal proteins,ICPs)的革兰氏阳性细菌[1, 2],ICPs主要由cry基因和cyt基因编码,并具有广谱的杀虫活性[3],且一种晶体蛋白可以对一种或多种害虫具有杀虫活性[4]。Bt杀虫剂有毒力高、对人畜与天敌安全、不污染环境等优点[5, 6]。目前,全世界几十个国家已广泛使用Bt制剂,用于农业害虫的生物防治[7]。
长期以来由真菌引起的植物病害十分普遍且日趋严重,给农业生产带来巨大的损失。其中由镰孢菌属(Fusarium)真菌引起的马铃薯干腐病尤为常见,已严重影响马铃薯的生产。马铃薯干腐病是马铃薯储藏期的主要病害之一[8],据报道,每年因马铃薯镰孢菌干腐病导致的产量损失可达6%-25%,窖贮损失率高达60%,该病害已成为马铃薯产业进一步发展的瓶颈问题[9]。为了拓展Bt在生防领域的应用范围,国内外早已开始对Bt抑制Fusarium进行究。2008 年韩苗苗等[10]发现 Bt519-1 菌株对禾谷镰孢菌(Fusarium graminearum)和尖孢镰孢菌(Fusarium oxysporum)具有抑制作用。2013年Akram等[11]发现Bt199菌株可以诱导多种方式抵御尖孢镰孢菌(Fusarium oxysporum)。2014年Rocha等[12]证明苏云金芽胞杆菌库斯塔克亚种(B.thuringiensis subsp.kurstaki)菌株对轮状镰孢菌(Fusarium verticillioides)具有很好的抑制作用。
针对大多数苏云金芽胞杆菌对真菌抑制作用不高的弱势,本实验室经筛选获得一株可以高效抑制镰孢菌的菌株BtLTS290,本研究首次对该菌株在抑制镰孢菌生长及抑菌物质理化性质等方面进行测试分析,旨在为Bt在抑制镰孢菌作用上的进一步研究及应用提供借鉴。 1 材料与方法 1.1 材料 1.1.1 供试菌株
苏云金芽胞杆菌BtLTS290菌株,由本实验室分离自从吉林采集的土壤样品。供试病原真菌:从黑龙江各地区分离的马铃薯干腐病的6种致病菌,腐皮镰孢菌[Fusarium solani (Mart.)]、拟丝孢镰孢菌(Fusarium trichothecioides Wollenw)、燕麦镰孢菌[Fusarium avenaceum (Corda&Fr.) Sacc]、接骨木镰孢菌(Fusarium sambucinum Fuckel)、茄病镰孢菌(Fusarium solani)和拟枝孢镰孢菌(Fusarium sporotrioides Sherb),由东北农业大学生命科学学院植物教研室李凤兰老师馈赠。 1.1.2 培养基
液体LB培养基:胰蛋白胨10 g、酵母提取物5 g、氯化钠10 g、蒸馏水1 L,pH7.0。
固体LB培养基:在液体LB培养基中加13 g/L的琼脂。固体1/2LB培养基:胰蛋白胨10 g、酵母提取物5 g、氯化钠10 g、琼脂13 g、蒸馏水1 L,pH7.0。
PDA培养基:马铃薯200 g、葡萄糖20 g、琼脂18 g、蒸馏水1 L,pH7.0。发酵培养基:牛肉膏5 g、蛋白胨10 g、氯化钠5 g、蒸馏水1 L,pH7.2。 1.2 方法 1.2.1 BtLTS290菌株晶体形态观察
方法及具体步骤参照文献[13]。 1.2.2 菌落对峙法测定抑真菌生物活性
在内径9 cm的PDA培养皿距中心2.5 cm的4个对称点接种活化的Bt菌株,培养24 h后,分别在培养皿中央接种直径8 mm的马铃薯干腐病菌菌饼,重复3次,于25℃恒温培养箱中培养3-4 d后,观察并测量抑菌效果,计算R值,即抑菌圈直径与菌落直径之比。同时用解剖针分别挑取正常生长的真菌菌丝和被抑制的真菌菌丝于载玻片上,载玻片上预先滴一滴无菌蒸馏水,然后轻轻盖好盖玻片,尽量控制气泡产生,把制好的玻璃片放在高倍显微镜下观察。 1.2.3 Bt菌株无菌发酵液的制备
将冻存管中储存的BtLTS290在LB平板上划线活化[14],30℃培养12 h后,挑取单菌落接入装有5 mL LB液体培养基的试管中,30℃、180 r/min下培养12 h。取1 mL活化菌液接入装有100 mL发酵培养基的500 mL三角瓶中,30℃、180 r/min条件下振荡培养3 d。同时取1 mL液体LB培养基接入装有100 mL发酵培养基的500 mL三角瓶中作为对照,30℃、180 r/min条件下振荡培养3 d。之后,将发酵菌液在4℃、8 000 r/min下离心20 min,收集上清液经细菌滤器(滤膜孔径0.25 μm)过滤除菌,即得到无菌发酵液,4℃保存备用。 1.2.4 Bt菌株无菌发酵液抑菌活性的测定
采用菌丝生长速率法[15],以供试的6种马铃薯干腐病致病菌为检测菌,测定Bt菌株发酵液中活性代谢产物的抑菌活性。将BtLTS290菌株的无菌发酵液1 mL与9 mL冷却到45℃左右的PDA培养液混匀,倒入无菌的培养皿中制成培养基平板。待凝固后将供试病原真菌菌饼(8 mm)倒置放在平板中央,每处理3次重复,以9 mL PDA培养液和1 mL未接菌的发酵培养基作为对照。将上述处理在25℃下培养4 d后,用十字交叉法测量供试菌菌落生长直径(mm),计算菌丝生长抑制率。计算公式:菌丝生长抑制率(%)=(对照菌落直径-处理后菌落直径)/(对照菌落直径-8 mm)×100%。 1.2.5 Bt菌株抑菌活性物质产生时间及稳定性测定 1.2.5.1 Bt菌发酵时间
分别设1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5和5.0 d,共9个采样点,测定不同发酵时间发酵液的抑菌活性。 1.2.5.2 热稳定性
取无菌发酵液分装离心管中,分别置于水浴40℃、60℃、80℃、100℃、121℃加热20 min,待自然冷却后,测定各处理液的抑菌活性。 1.2.5.3 pH稳定性
取无菌发酵液50 mL,分别用1 mol/L的HCl和1 mol/L的NaOH处理将其pH值分别调至3、5、7、9、10和11,并于4℃冰箱中过夜,然后调回原pH约7.0左右,测定各处理液的抑菌活性。 1.2.5.4 抗蛋白酶K稳定性
取离心管3支,编号为1、2、3,1号和2号管中各装入无菌发酵液10 mL,3号管中加入未接菌的发酵液10 mL,1号和3号管中分别加入蛋白酶K溶液(20 mg/mL)50 μL,充分混匀后,置于37℃下1 h,然后分别测定各处理液的抑菌活性。以上实验均重复3次,以燕麦镰孢菌作为指示菌,以未接菌的发酵液作对照,采用菌丝生长速率法测定各处理液的抑菌活性。 2 结果 2.1 晶体形态观察
Bt菌株LTS290产生的晶体形态,光学显微镜(图 1-A)下箭头所示,从左到右依次为球形晶体和芽胞;电镜(图 1-B)中箭头所指,从左到右依次为球形晶体和芽胞。
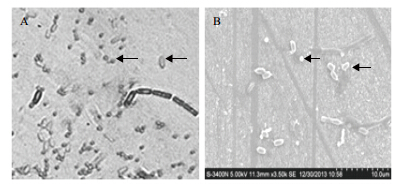 |
| 图 1 Bt 野生菌株 LTS290 的光学显微镜图(A) 和电镜晶体图(B) |
Bt LTS290菌株对6种镰孢菌都有抑制作用,仅以经燕麦镰孢菌为例,如图 2-A所示,计算BtLTS290菌株对燕麦镰孢菌的抑制率R值,约为0.3。通过对燕麦镰孢菌菌丝显微结构进行观察,结果(图 2-B,C)显示,正常生长的菌丝长,且呈直线型生长,而被抑制的菌丝短,并且变得弯曲,菌丝被抑制效果显著。
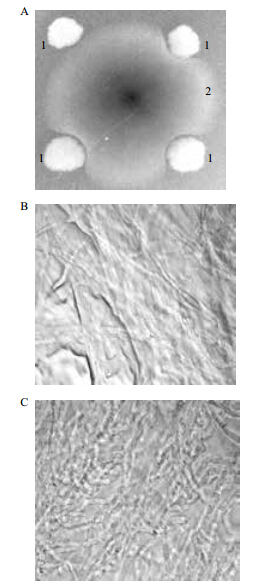 |
| A :BtLTS290 菌株对燕麦镰孢菌的抑制作用(1 为 BtLTS290,2 为燕麦镰孢菌);B :光学显微镜下正常生长的菌丝形态 ;C :光学显微镜下被抑制的菌丝形态图 2 BtLTS290 菌株对黄色镰刀菌的抑制作用 |
Bt LTS290无菌发酵液对6种镰刀菌菌丝的生长抑制如图 3所示,通过计算,结果表明Bt LTS290无菌发酵液对燕麦镰孢菌和接骨木镰孢菌菌丝生长抑制率分别为91.38%和91.76%,而对其他供试镰孢菌的菌丝生长抑制率在73%-87%之间。
 |
| A :腐皮镰孢菌 ;B :接骨木镰孢菌 ;C :拟丝孢镰孢菌 ;D :拟枝孢镰孢菌 ;E :茄病镰孢菌 ;F :燕麦镰刀菌 ;1 :对照(镰孢菌菌饼 +9 mL PDA 培养液 +1 mL 未接菌的发酵培养液);2 :镰孢菌菌饼 +9 mL PDA培养液 +1 mL Bt LTS290 的无菌发酵培养液图 3 Bt LTS290 无菌发酵液对马铃薯干腐病 6 种致病镰孢菌的抑菌作用 |
图 4表明,菌株Bt LTS290发酵1 d时未产生抑菌物质,在发酵3 d时抑菌物质积累最多,对燕麦镰刀菌菌丝生长抑制率最高,发酵时间3-4 d内对燕麦镰刀菌菌丝生长抑制率未见明显变化,但4.5 d后发酵液的抑菌活性开始下降。
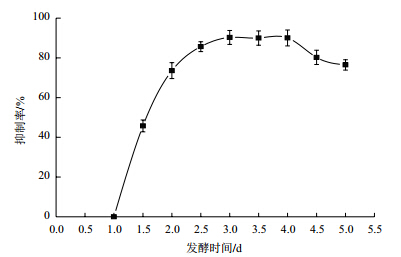 |
| 图 4 BtLTS290 不同发酵时间对燕麦镰刀菌的抑菌活性 |
对菌株Bt LTS290无菌发酵液的热耐受性实验结果表明,当发酵液的处理温度为40-100℃时处理20 min时,发酵液上清仍然具有抑菌活性,并且抑菌活性基本不变,仍维持在90%左右。经过121℃处理20 min后仍然具有抑菌活性,但抑菌活性明显降低。 2.4.3 pH稳定性
Bt LTS290无菌发酵液经不同pH处理后,其稳定性结果(图 5)表明,BtLTS290发酵液在pH3-11范围内均有抑菌活性,并且变化幅度不大,pH为7时抑菌活性最高。
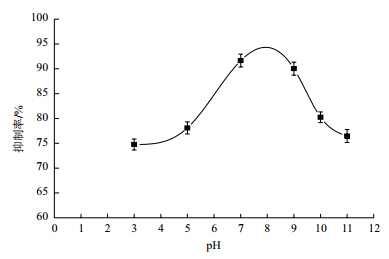 |
| 图 5 Bt LTS290 产抑菌物质在不同 pH 值下的稳定性 |
1号和2号处理的无菌发酵液对燕麦镰孢菌都具有抑菌活性,并且测定数值非常接近。而3号未接菌的发酵液对燕麦镰孢菌没有抑制作用,说明BtLTS290菌株发酵液中的活性代谢产物对蛋白酶K具有较强的稳定性。 3 讨论
苏云金芽胞杆菌作为一种重要的生防细菌,主要用于农业虫害的防治。但随着农业和环境可持续发展的需要,筛选出多功能Bt菌株变得尤为重要。
关于苏云金芽胞杆菌抑真菌的报道非常多,但对于其抑真菌机制尚无明确报道[16]。本研究证明BtLTS290菌株对马铃薯干腐病镰孢菌具有一定的抑制作用,由于PDA培养基以及培养的温度不利于BtLTS290的生长,抑菌圈不是十分明显,但通过显微镜可以明显观察到镰孢菌菌丝的生长被严重抑制。由于未进行更微观的显微结构观察,如孢子的萌发是否被抑制,因此有必要参照一些文献[10, 11],对孢子的萌发程度进行检测。但BtLTS290的无菌发酵液对镰孢菌菌丝的抑制率明显,说明无菌发酵液中的抑菌物质对镰孢菌有很强的抑制作用。已报道的芽胞杆菌抑菌物质种类很多,有细菌素、脂肽、小分子蛋白及几丁质酶等。目前关于几丁质酶的报道较多,几丁质酶不但对真菌的生长有抑制作用,而且可以协同Cry毒素进行杀虫[17, 18, 19]。而对于BtLTS290无菌发酵液中的抑菌物质是什么,我们并不十分清楚,但可以肯定的是此物质具有良好的热稳定性和pH稳定性。因此,对于抑菌作用来源于何种物质仍需进一步深入研究。除此之外,对于BtLTS290菌株中何种cry基因编码了晶体蛋白,可参考一些新基因的克隆方法进行鉴定[20, 21]。 4 结论
由本实验室分离得到的野生菌株BtLTS290对马铃薯干腐病致病镰孢菌具有较好的抑制作用,尤其对菌丝生长的抑制作用明显。以腐皮镰孢菌、拟丝孢镰孢菌、燕麦镰孢菌、接骨木镰孢菌、茄病镰孢菌和拟枝孢镰孢菌作为指示菌,测得BtLTS290菌株的无菌发酵液对这6种马铃薯干腐病致病镰孢菌的菌丝生长抑制率均在73%-91%之间。对菌株BtLTS290所产的抑菌活性物质的理化性质进行研究发现,其抑菌活性物质对温度不敏感,在pH3-11内抑菌活性变化不大,并且对蛋白酶K不敏感,说明抑菌活性物质具有良好的稳定性。
| [1] | Schnepf E,Crickmore N,Van Rie J,et al.Bacillus thuringiensis and its pesticidal crystal proteins[J].Microbiol Mol Biol Rev,1998,62(3):775-806. |
| [2] | 中国科学院微生物研究所翻译.伯杰氏细菌鉴定手册[M].北京:科学出版社,1984. |
| [3] | 李玉红,李海涛,高继国,等.苏云金芽胞杆菌cry2Ab、cry9Ea基因的表达及活性分析[J].生物技术通报,2012,3(10):100-105. |
| [4] | de Maagd RA,Bravo A,Crickmore N.How Bacillus thuringiensishas evolved specific toxins to colonize the insect world[J].Trends Genet,2001,17(4):193-199. |
| [5] | Marroquin LD,Elyassnia D,Griffitt JS.Bacillus thuringiensis (Bt) toxin susceptibility an disolation of resistance mutants in the nematode Caenorhabditis elegans[J].Genetics,2000,155(4):1693-1699. |
| [6] | Garcia-robles I,Sanchchez J,Gruppe A.Mode of action of Bacillus thuringiensis pS86Q3 strain in hymenopteran forest pests[J].Insect Biochem Mol Biol,2001,31(9):849-856. |
| [7] | 魏艳敏.生物农药及其应用技术问答[M].北京:中国农业大学出版社,2007:68-71. |
| [8] | 周全,张廷义,杜玺.马铃薯块茎干腐病发生危害及防治[J].植物保护,2006,32(2):103-105. |
| [9] | 赵生山,牛乐华.马铃薯贮藏期病害调查及药剂防治研究[J].农业科技与信息,2008,11:44-46. |
| [10] | 韩苗苗,肖亮,蔡峻,等.一株抑真菌、对甜菜夜蛾高效的苏云金芽胞杆菌菌株[J].微生物学通报,2008,35(11):1750-1754. |
| [11] | Waheed A,Asrar M,Asmat AJ.Bacillus thuringiensis strain 199 can induce systemic resistance in tomato against Fusarium wilt[J].Eur J Microbiol Immunol (Bp),2013,3(4):275-280. |
| [12] | Rocha LO,Tralamazza SM,Reis GM,et al.Multi-Method approach for characterizing the interaction between Fusarium verticillioides and Bacillus thuringiensis subsp.kurstaki[J].PLoS ONE,2014,9(8):e92189. |
| [13] | 何宝楠,李海涛,刘荣梅,等.苏云金芽胞杆菌V4菌株cry杀虫基因的鉴定、表达及杀虫活性分析[J].生物技术通报,2014(9):125-130. |
| [14] | 周昕,秦玉花,刘伟伟.《微生物与免疫学》实验教学的实践与思考[J].实验科学与技术,2012,S2:245-246. |
| [15] | 王国平,郑必强,章初龙,等.内生真菌ZJUF0986代谢的抗菌活性物质特性[J].植物保护学报,2008,35(2):127-131. |
| [16] | Hyakumachi M,Nishimura M,Arakawa T,et al.Bacillus thuringiensis suppresses bacterial wilt disease caused by Ralstonia solanacearum with systemic induction of defense-related gene expression in tomato[J].Microbes Environ,2013,28(1):128-134. |
| [17] | 祁红兵,刘铭,李红敬.产几丁质酶苏云金芽孢杆菌的筛选及其对甜菜夜蛾高毒菌株的增效活性[J].江苏农业科学,2003(6):61-63. |
| [18] | Thamthiankul S,Moar WJ,Miller ME,et al.Improving the insecticidal activity of Bacillus thuringiensis subsp.aizawai against Spodoptera exigua by chromosomal expression of a chitinase gene[J].Appl Microbiol Biotechnol,2004,65(2):183-192. |
| [19] | 刘东,陈月华,蔡峻,等.苏云金芽胞杆菌几丁质酶B特性及其杀虫抑真菌的作用[J].微生物学报,2009,49(2):180-185. |
| [20] | Noguera PA,Ibarra JE.Detection of new cry genes of Bacillus thuringiensis by use of a novel PCR primer system[J].Appl Environ Microbiol,2010,76(18):6150-6155. |
| [21] | 李长友,李国勋,张杰,等.苏云金芽胞杆菌菌株B-Hm-16的生物学特性及cry基因型鉴定[J].青岛农业大学学报:自然科学版,2007,24(1):1-4. |




