武夷菌素(Wuyiencin)是不吸水式链霉菌武夷变种(Streptomyces ahygroscopicus var.wuyiensis)产生的农用抗生素,主要用于防治作物真菌病害[1],如黄瓜白粉病,番茄叶霉、灰霉病等,具有广谱、高效、低毒的特点,在现代化生态农业和绿色食品生产中具有广阔的应用前景。目前,菌株效价较低已经成为限制武夷菌素产业化发展的障碍之一,因此,选育高产菌株、降低生产成本是武夷菌素研究的核心内容。
在武夷菌素育种方面,曾采用了原生质体融合[2]以及诱变育种的方法包括NTG、紫外诱变、低能碳离子注入和亚硝基胍诱变[3]及60Coγ-射线诱变[4]。虽然采用传统的育种方法已经使原始菌株效价提高了近1倍多,但由于传统的育种工作量大,具有不定向性,且菌株经过多次传代培养后易发生回复突变。因此,采用基因工程手段进行育种,克服传统育种的随机性和盲目性,因其具有目标明确、效率高、菌株稳定等优点,成为近年来研究的热点。
实验室前期从原始菌株CK-15中得到一个武夷菌素生物合成正调控基因wysR,将该基因克隆至具有强启动子psf的载体PSF14上,接合转移至原始菌株CK-15中,构建了过表达菌株ooR[5]。通过比较发现,该菌株较原始菌株的效价有显著提升。构建过表达菌株使用的质粒是一种整合型穿梭质粒载体,其转入链霉菌之后与基因组整合的位点是随机的,得到的转化子并不全都使抑菌活性得到大幅提高。因此,要想获得高效、优良的菌株必须有一个进一步的筛选过程。通过平皿琼脂块法初筛,摇瓶发酵复筛的方法从菌株单菌落中筛选高产菌株的方法简单可行且比较直观,廖晓珣等[6]从井冈霉素的吸水链霉菌井岗变种J1单菌落中经过平皿初筛、摇瓶复筛获得菌株J1-U-D,效价达25 874×10-6g/mL,比出发菌株提高29%。
本研究以武夷菌素wysR过表达菌株ooR为基础,通过琼脂块法初筛、摇瓶发酵复筛,以期得到高产、稳定的武夷菌素wysR基因过表达菌株;同时观察高产菌株在MS培养基平板不同时间菌丝孢子生长情况,检测菌株发酵过程中不同发酵时间菌丝体干重、发酵液糖含量和发酵液效价的变化情况,旨为改进武夷菌素发酵工艺和基因工程育种提供参考。 1 材料与方法 1.1 材料 1.1.1 供试菌株
武夷菌素原始菌株CK-15(Streptomyces anhygroscopicus var.wuyiensis CK-15);武夷菌素wysR基因过表达菌株ooR (St.wuyiensis ooR),该菌株是将原始菌株CK-15中得到的武夷菌素生物合成正调控基因wysR克隆至具有强启动子psf的载体PSF14上,重新接合转移至菌株CK-15中,构建的过表达菌株ooR,前期研究表明菌株ooR在MS培养基上长势良好[7];生物测定指示菌用红酵母(Rhodoiorula rubra),以上菌株均由中国农业科学院植物保护研究所农用抗生素组提供。 1.1.2 供试培养基
菌种培养采用MS培养基:20 g黄豆饼粉放入蒸馏水中煮30 min,用4层纱布过滤定容至1 000 mL,每100 mL分装入盛有2 g甘露醇和1.7 g琼脂粉的250 mL三角瓶中,121℃高温湿热灭菌30 min;生物测定用PDA培养基:配置见参考文献[8];56#发酵培养基(g/L):玉米粉30、黄豆饼粉20、葡萄糖20、硫酸铵4、碳酸钙3;可溶性发酵培养基(g/L):葡萄糖20、酵母粉20、氯化铵4、硫酸镁0.4。 1.2 方法 1.2.1 发酵液制备及生物活性测定 1.2.1.1 发酵液制备
采用MS培养基28℃恒温培养武夷菌素产生菌,培养5-7 d后用灭菌牙签将培养基划成1 cm2菌块至装有50 mL发酵培养基的250 mL三角瓶中,28℃、220 r/min摇床震荡培养,滤纸过滤即得发酵液。 1.2.1.2 生物活性测定
采用PDA培养基以红酵母为指示菌,管碟法[9]测定武夷菌素效价,武夷菌素效价标准曲线方程为:y=7.6932x-106.33,R2=0.977(x代表抑菌圈直径,y代表标准液浓度)。 1.2.2 武夷菌素高产菌株筛选 1.2.2.1 单孢子悬浮液的制备
在武夷菌素wysR基因过表达菌株的MS培养基表面加入10 mL无菌水,用灭菌牙签刮取培养基表面孢子,灭菌纱布过滤,将菌丝体和单个孢子分开,过滤液即为单孢子悬浮液。 1.2.2.2 琼脂块法初筛
单孢子悬浮液稀释后均匀涂布于MS培养基平板上,28℃恒温培养箱倒置培养3 d。用灭菌打孔器打出直径为5 mm的单菌落琼脂块,接种针挑取单菌落琼脂块置于含3%红酵母菌的PDA培养基表面,间隔一定距离摆放,带菌面朝上,28℃培养24 h,挑选抑菌圈直径较大的菌株转接到MS培养基,28℃恒温培养7 d。 1.2.2.3 摇瓶发酵复筛
待初筛获得的菌株在MS表面产生大量孢子,接种到发酵培养基,摇瓶发酵60 h,管碟法测效价。每个菌株重复3瓶,取平均值,以原始菌株为对照,筛选出几株较优菌株。 1.2.2.4 遗传稳定性实验
将经复筛选出的菌株,接种于MS平板培养基上进行传代培养5代,观察各代菌株生长状况,并对各代菌株进行摇瓶发酵实验,管碟法测效价,分析比较传代前后菌株产素能力的变化。 1.2.3 高产菌株生物特性研究 1.2.3.1 高产菌株形态特征和培养特征的观察
在MS培养基上培养过表达菌株W-273和原始菌株CK-15,每天观察记录菌株在MS培养基平板上的生长情况。并采用插片培养法[10]分别在光学显微镜和电子显微镜下观察菌丝和孢子生长情况及形态特征,光学显微镜镜检时用镊子小心拔出盖玻片,有菌的一面朝下放在载玻片上直接观察即可;电子显微镜镜检时先将盖玻片放入2%-4%戊二醛固定液中固定1-2 d,0.1 mol/L pH7.2 PBS缓冲液洗,用1% OsO4后固定1-2 h用重蒸水冲洗30 min,随后用30%、50%、70%、80%、90%、95%和100%乙醇梯度脱水,每级15-20 min,样品脱水后用醋酸异戊酯处理,CO2临界点干燥,干燥好的样品粘贴在样品台上,用离子溅射仪表面喷金,喷金后样品在扫描电镜下扫描,拍照并记录。每天取盖玻片在光学显微镜下观察菌丝和孢子生长情况,待产生大量孢子后在电子显微镜下观察孢子形态。 1.2.3.2 菌丝体干重测量
将过表达菌株W-273和原始菌株CK-15接种到纯液体发酵培养基,发酵培养8、16、24、32、40、48、56、64、72和80 h后,发酵液用事先称好重量的滤纸过滤,过滤完在80℃烘箱烘4 h后称重,称重重量减去滤纸重量即为菌丝体干重。 1.2.3.3 发酵液总糖含量
在56#发酵培养基中接种过表达菌株W-273和原始菌株CK-15,发酵培养8、16、24、32、40、48、56、64、72和80 h后采用DNS法[11]测定发酵液中总糖含量,以葡萄糖为标准品制定的标准曲线方程为y=0.642x+0.0406,R2=0.9966(x代表 520 nm吸光值,y代表葡萄糖含量)。 1.2.3.4 武夷菌素效价
在56#发酵培养基中接种过表达菌株W-273和原始菌株CK-15,发酵培养24、32、40、48、56、64、72和80 h后管碟法检测武夷菌素效价。 2 结果 2.1 武夷菌素高产菌株筛选 2.1.1 高产菌株筛选
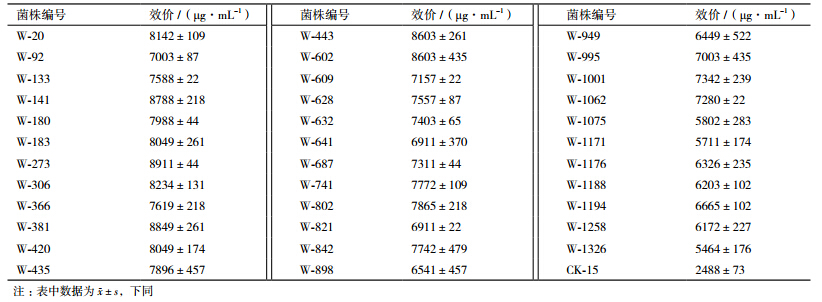
将单孢子悬浮液涂布于MS培养基28℃培养3 d后,产生的单菌落经琼脂块法初筛,从2 060株菌株中选育出35株抑菌圈直径相对较大菌株,摇瓶发酵复筛后管碟法测效价,结果见表 1,其中菌株W-20、W-141、W-273、W-306、W-381、W-443、W-602、W-802、W-995的效价最高,较菌株CK-15效价提高195%-258%,选定这9株菌株作为第一代菌株进行遗传稳定性测定。
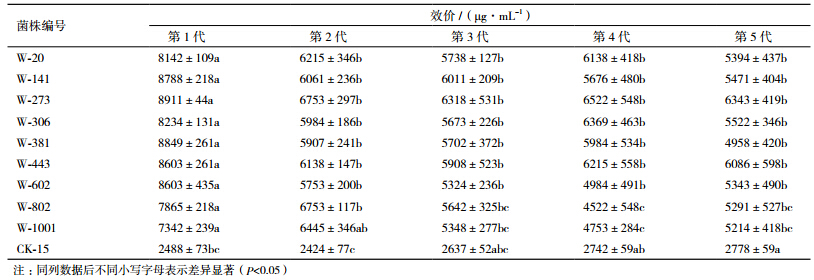
将筛选到的高产菌株再传代4次,共5代菌株,观察各代菌株生长状况,菌株W-381和W-1001分别传至第4代和第5代时菌株生长减慢、产孢时间推迟、产孢量减少,需培养7-8 d完成整个生长过程,其他菌株生长稳定。并分别对各代菌株进行摇瓶发酵,测定效价,结果见表 2。筛选到的菌株第一代效价均值可达到8 309 μg/mL,从第一代传到第二代后菌株效价下降明显,再传代后除菌株W-273和W-443外其他菌株效价均有不同程度的下降,菌株W-273和W-443传代稳定性较好,且W-273菌株效价较W-443菌株高,最终确定W-273菌株为筛选到的最优菌株,已将该菌株保存至中国普通微生物菌种保藏管理中心(保藏号为9604)。
将高产菌株W-273和原始菌株CK-15接种到MS培养基平板,观察生长状况及用插片法观察菌丝及孢子生长状况,由图 1可知,高产菌株W-273较原始菌株CK-15菌丝生长较快产孢量增加且产孢时间提前,高产菌株W-273生长3-4 d即可完成产孢,较原始菌株CK-15提前3-4 d。菌株W-273孢子比菌株CK-15孢子稍大,且W-273菌株孢子呈椭圆形或杆状,CK-15菌株孢子呈圆形(图 2)。
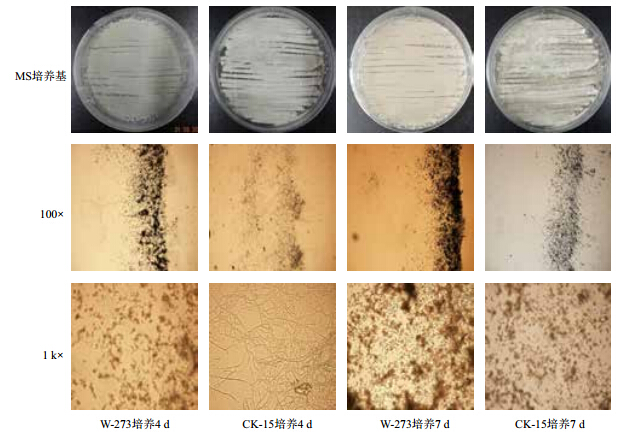 |
| 图 1 高产菌株 W-273 菌丝孢子观察结果 |
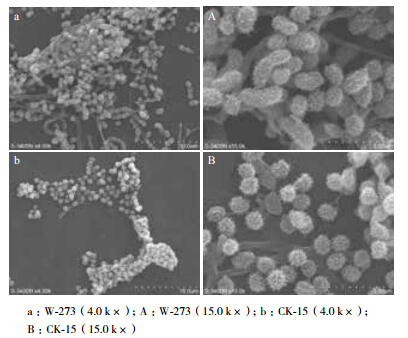 |
| 图 2 高产菌株 W-273 孢子电镜扫描图 |
将高产菌株W-273和原始菌株CK-15接种到可溶性发酵培养基56#发酵培养基发酵不同时间后,分别测量菌丝体干重、发酵液总糖含量以及武夷菌素效价。图 3显示,菌株W-273在8-24 h时菌丝体生长量最多,而菌株CK-15在16-24 h时菌丝体生长量最多,菌株W-273较CK-15菌丝大量生长时间提前约4-8 h。对应不同发酵时间发酵液总糖含量,发酵过程中菌株W-273消耗糖含量最多的两个时间段为发酵前期的8-16 h和24-32 h,菌株CK-15要推迟到16-24 h和32-40 h,这两个时间段可能分别为菌丝体生长最迅速的时段以及菌株开始产生抗生素的时段,两个时段W-273菌株较CK-15菌株约提前8 h。
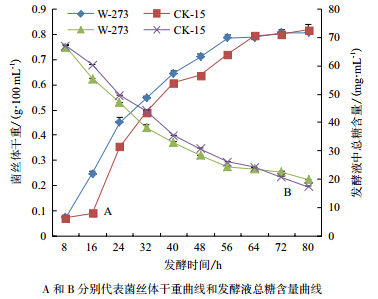 |
| 图 3 不同发酵时间菌株 W-273 菌丝体生长情况及发酵液总糖含量变化 |
如图 4所示,W-273发酵24 h后发酵液已经有较低的抑菌活性,对应的CK-15菌株发酵液要推迟至32 h,并且W-273菌株发酵最优时间为56 h,较CK-15菌株的64 h提前约8 h。过表达菌株W-273效价稳定在5 000-7 000 μg/mL,较野生菌株CK-15效价1 800-2 800 μg/mL提高79%-289%,W-273菌株发酵液抑菌活性明显增强(图 5)。
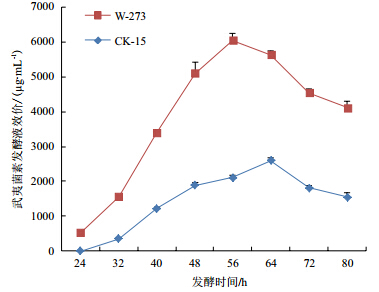 |
| 图 4 发酵过程中菌株 W-273 发酵不同时间效价变化 |
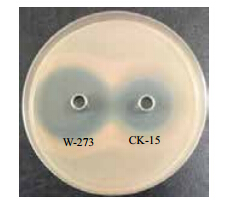 |
| 图 5 培养 3 d 后 W-273 菌株发酵液对红酵母的抑菌效果 |
近年来,基因工程技术在抗生素的改造及菌种选育工作中的应用越来越多[12],其中常用的方法包括改造代谢途径、改造抗生素生物合成基因簇、改造核糖体和原生质体融化技术。
生物合成基因簇携带编码调控因子的调控基因,调控因子是一类在转录水平调节基因表达的蛋白质,它们能特异性地结合到该基因簇中的核酸调控元件,激活或阻碍抗生素结构基因转录成mRNA。过量表达编码激动子基因和失活编码阻遏子的基因,是增加抗生素的最为快速有效的方法[13]。Anton等[14]通过增加纳他链霉菌中编码PAS/LuxR激动子pimM基因的拷贝数使匹马霉素产量提高了2.4倍。Martinz-Costa等[15]通过将变铅青链霉菌内编码LysR-type转录调节子的基因actVB-orf10失活,使放线菌紫素产量提高3.5-5倍。
武夷菌素生物合成基因簇中的wysR基因包含功能保守的PAS-LuxR结构域,研究表明PAS-LuxR调控子在不同的多烯类链霉菌中有着相同的调控方式,这些基因负责聚酮化合物链的构建,糖基的脱水与链接,ABC转运蛋白以及作为调控的靶基因[16]。Anton等[14]研究中报道了含有PAS-LuxR结构域的调控因子PimM是匹马霉素生物合成途径中的正调控因子。魏杰等[17]将纳他霉素生物合成基因簇中的基因PimM置于强启动子PermE之下进行整合性表达,构建过表达载体PBJPM,并接合转移至金褐链霉菌SYAU0709中,通过摇瓶发酵和HPLC检测分析发现,有些转化子的金褐霉素产量比野生型菌株提高3-4倍,说明PimM基因在金褐链霉菌中有促进金褐霉素合成的作用,并且遗传性能稳定。
前期刘彦彦等[5]将wysR基因克隆至具有强启动子psf的载体PSF14上,并接合转移至原始菌株CK-15中,构建了过表达菌株ooR,效价稳定在3 000-4 000 μg/mL。传统的诱变方法具有盲目性和随机性,突变率仅有1/103-1/106,并且突变株中多数为负向变异,正突变率低[18],导致育种工作量大,随机性强,效率低下。本实验通过琼脂块法及摇瓶发酵的方法筛选高产过表达菌株,最终从2 060株过表达菌株中筛选得到高产菌株W-273,较出发菌株ooR效价提高1倍。基因工程育种目标明确,正突变率显著提高,此次筛选的2 060株过表达菌株的抑菌效果较原始菌株均有显著的提高,工作量减小,育种效率显著提高。
通过MS培养基平板和插片法显微镜观察wysR基因过表达菌株W-273菌丝孢子生长情况,结合发酵过程中的生理生化指标包括菌丝体干重、发酵液糖含量和发酵液抑菌活性,比较其生物学特性。结果表明与原始菌株CK-15相比,W-273菌株生长迅速,产孢量增加且产孢时间提前;W-273菌株较CK-15菌株代谢旺盛,发酵前期菌丝体增长快,糖消耗量大,产素时间提前4-8 h,并且抗生素产量提高79%-289%,说明wysR基因可以正调控菌株的生长速率、产孢量及武夷菌素的生物合成,这一结论与刘彦彦[5]的结论是一致的。观察菌株孢子形态,W-273菌株孢子呈椭圆形或杆状,CK-15菌株孢子呈圆形;W-273菌株菌体形态的变化说明wysR不仅与武夷菌素的生物合成有关,而且可以影响菌体形态分化,这与天蓝色链霉菌的情况相类似,天蓝色链霉菌中bld、afs、abs等基因不仅可以调控抗生素的生物合成,而且可以影响菌体的生长[19],而基因影响菌体形态变化的分子机制有待进一步的研究。 4 结论
通过琼脂块法初筛以及摇瓶发酵复筛的方法从武夷菌素wysR基因过表达菌株单菌落中筛选出高产武夷菌素wysR基因过表达菌株W-273。研究W-273菌株的生物学特征,发现W-273菌株生长迅速,产孢量增加且产孢时间提前,W-273菌株产孢时间较菌株CK-15提前了3-4 d;电子显微镜观察W-273孢子呈椭圆形或杆状,CK-15菌株孢子呈圆形;通过摇瓶发酵表明W-273菌株较CK-15菌株代谢旺盛,抗生素产量提高79%-289%,且最佳发酵时间缩短4-8 h,W-273菌株可以满足工业生产需要。
| [1] | 韦日清,林德忻,陈志和.农用抗生素Bo-10产生菌的鉴定[J].微生物学报,1984,24(4):401-402. |
| [2] | 曾洪梅,张震霖,石义萍,等.原生质体融合提高农抗武夷菌素的效价[J].微生物学报,1995,35(5):375-380. |
| [3] | 付月灵,张克诚,石义萍,等.武夷菌素高产菌株的选育[J].中国生物防治,2007,23(2):195-197. |
| [4] | 程艳,张克诚,赵明富,等.应用60Coγ射线诱变选育武夷菌素高产菌的研究[J].中国农学通报,2010,26(2):234-237. |
| [5] | 刘彦彦.武夷菌素生物合成调控基因wysR和wysRⅢ的功能研究[D].北京:中国农业科学院,2014. |
| [6] | 廖晓珣,陶科,侯太平.井冈霉素产生菌的诱变选育及发酵条件优化[J].四川大学学报:自然科学版,2008,45(4):963-966. |
| [7] | Liu YY,Ryu H,Ge BB,et al.Improvement of Wuyiencin biosynthesis in Streptomyces wuyiensis CK-15 by identification of a key regulator,WysR[J].J Microbiol Biotechnol,2014,24(12):1644-1653. |
| [8] | 武哲,孙蕾,刘彦彦,等.生物农药武夷菌素对保护地番茄灰霉病的防治效果[J].中国农学通报,2013,25:173-178. |
| [9] | 马绪荣,苏德模.抗生素微生物检定法[M].北京:科学出版社,2001. |
| [10] | 阎逊初.放线菌的分类和鉴定[M].北京:科学出版社,1984. |
| [11] | 董林青,牛国文,刘志毅,等.应用不同方法测定发酵液中的糖含量[J].广东化工,2009,36(9):177-178,189. |
| [12] | 刘志恒.放线菌基因组与生物技术[J].微生物学通报,2004,31(1):140-143. |
| [13] | 孟雨菡,刘景晶,顾觉奋.基因工程方法用于抗生素增产的研究进展[J].国外医药:抗生素分册,2009,30(5):193-197,204. |
| [14] | Anton N,Santos-Aberturas J,Mendes MV,et al.PimM,a PAS domain positive regulator of pimaricin biosynthesis in Streptomyces natalensis[J].Microbiology,2007,153(Pt 9):3174-3183. |
| [15] | Martinz-Costa OH,Martin-Triana AJ,Martinez E,et al.An additional regulatory gene for actinorthodin production in Streptomyces lividans involves a LysR-type transcriptional regulator[J].J.Bacteriol,1999,181(14):.4353-4364. |
| [16] | Santos-Aberturas J,Payero TD,Vicente CM,et al.Functional conservation of PAS-LuxR transcriptional regulators in polyene macrolide biosynthesis[J].Metab Eng,2011,13(6):756-767. |
| [17] | 魏杰,孟宪军,李其久,等.基因PimM在金褐链霉菌SYAU0709中的表达[J].生物工程,2009,30(15):193-195. |
| [18] | 唐伟,孙军德,张翠霞.农用抗生素产生菌菌种选育的研究进展[J].微生物学杂志,2004,24(4):42-45. |
| [19] | Huang J,Shi J,Molle V,et al.Cross-regulation among disparate antibiotic biosynthetic pathways of Streptomyces coelicolor[J].Mol Microbiol,2005,58(5):1276-1287. |