漆酶(对苯二酚-氧化还原酶,laccase,EC 1.10.3.2)是一种含多铜的氧化还原酶,能够催化多种底物的氧化,如邻位和对位酚类、氨基苯酚、芳基二胺、多酚、聚胺和木质素等[1, 2, 3]。此外,它还可以耦合无机离子还原分子氧生成水。最早漆酶被发现于日本漆树的汁液中,目前研究发现漆酶广泛存在于植物、昆虫、真菌和细菌中[4, 5, 6]。部分漆酶已经广泛应用在工业过程中,如漂白、降解、脱色和制备生物电极等[1, 2, 3, 4, 5]。由于其具有宽范的底物特异性、催化反应没有过氧化物和有毒物质的生成,以及对环境无污染的特性[7],因而近年来得到了越来越多的关注,成为了环保应用酶的研究热点。
由于目前对真菌漆酶的研究较为深入,而产漆酶真菌的主要来源是担子菌亚门的白腐真菌,而对于丝状真菌研究较少。疣孢漆斑菌为半知菌的一种,其菌株具有生长周期短、生活史简单、易于遗传改造等优点,可为后续可大规模发酵提供良好的基础[8]。本研究利用一株高产漆酶的疣孢漆斑菌M.verrucaria GH-01获得漆酶,并对该酶进行纯化和酶学性质的研究,探索其在染料脱色应用中的可能性,旨在为拓展半知菌漆酶种类、研究漆酶催化性能以及后续该漆酶的应用奠定良好基础。 1 材料与方法 1.1 材料 1.1.1 供试菌株
疣孢漆斑菌GH-01(Myrothecium verrucaria GH-01):采自黑龙江凉水林区,经筛选和鉴定,保存于东北林业大学微生物实验室。 1.1.2 试剂和仪器
2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS),DEAE-Sepharose FF凝胶,SephadexG-75凝胶,蛋白质marker,其它试剂均为国产分析纯。紫外可见分光光度计、数显恒温水浴锅、台式离心机、梯度混合器、恒温振荡培养箱、稳压稳流电泳仪、涡旋混匀器、紫外检测仪、自动部分收集器等。 1.1.3 培养基
平板活化固体PDA培养基:马铃薯200 g,切成大约1 cm3的小块,沸水煮30 min,过滤取滤液补足至1 000 mL。加入蛋白胨30 g,葡萄糖40 g,MgSO4·7H2O 1.5 g,KH2PO4 3 g,加入20 g琼脂,121℃灭菌15 min。
发酵培养基:去皮马铃薯200 g,切成约1 cm 3的小块,在1 L水中煮沸30 min,过滤取滤液补足1 L。加入蛋白胨36 g,葡萄糖24 g,MgSO4 ·7H2O 1.8 g,KH2PO4 3.6 g,铜离子浓度0.2 mmol/L,把培养基分装到250 mL三角瓶中,121℃灭菌15 min。 1.2 方法 1.2.1 样品制备
在培养8 d的平板活化固体PDA培养基上用打孔器打6个直径为1 cm的菌饼,接种到装有100 mL发酵培养基中,28℃下恒温培养箱振中140 r/min振荡培养10 d作为发酵液。将发酵液样品在10 000 r/min条件下离心10 min,上清液即为粗酶液。 1.2.2 漆酶活力测定
漆酶酶活测定以ABTS为底物,利用紫外分光光度法测定。将2.95 mL 0.1 mol/L柠檬酸-磷酸氢二钠缓冲液(pH4.0)和1 mL 1 mmol/L的ABTS溶液组成的反应体系置于28℃水浴锅内,加入适当稀释的酶液50 μL (空白对照为经过高温灭活的酶液),反应3 min,利用紫外分光光度法测定420 nm处吸光度的变化值。每个样品取3次测量的平均值。漆酶活力的计算公式:

式中,△ A:吸光度的变化值;V:溶液的体积(L);ε420:消光系数(3.6×104 mol-1·cm-1·L);v:加入粗酶液的体积(mL);L:比色皿的光径(cm);t:反应时间(min);c:10-6 mol。 1.2.3 漆酶的分离纯化
将粗酶液上清逐渐加入硫酸铵,测其不同饱和度下的漆酶活力(在冰浴中进行)。选择最佳饱和度,收集沉淀。用10 mmol/L pH7.8磷酸氢二钠-柠檬酸缓冲液反复冲洗沉淀使其溶解。8 000 r/min下离心10 min,去除不溶杂质,收集上清液。将上清液置于透析袋中4℃透析过夜,聚乙二醇(PEG20000)适当浓缩。浓缩好的样品加入缓冲液平衡过的DEAE-Sepharose Fast Flow阴离子交换层析柱中。用缓冲液配制的0-1 mol/L NaCl溶液梯度洗脱。收集在280 nm处有吸收峰的溶液,测定其漆酶活力,将有酶活性的溶液按活力高低分别收集并适当浓缩。随后将样品加入缓冲液平衡过的SephadexG-75凝胶过滤柱中,用缓冲液洗脱,收集漆酶活力较高的部分。 1.2.4 蛋白质电泳
SDS-PAGE和Native-PAGE参照郭尧君[9]的方法。SDS-PAGE电泳采用5%浓缩胶和12%分离胶进行,凝胶用考马斯亮蓝R250染色。Native-PAGE采用5%浓缩胶和12%分离胶进行,用含有3 mmol/L ABTS的Na2HPO4-柠檬酸缓冲液对凝胶染色,观察绿色的条带。 1.2.5 漆酶的性质研究
测定温度对粗漆酶活性的影响:将含有漆酶的缓冲液在20-60℃下保温3 min后测定酶活力。测定温度对粗漆酶稳定性的影响:将酶液置于4-60℃下保温,每隔一段时间后取样,在30℃下测定酶活力。测定pH值对粗漆酶活性的影响:将底物溶解于pH3.0-8.0的磷酸氢二钠-柠檬酸缓冲液中测定漆酶活力。测定pH值对粗漆酶稳定性的影响:将酶液溶于pH3.0-8.0的磷酸氢二钠-柠檬酸缓冲液中,每隔一段时间取样,测定酶活力。 1.2.6 染料降解研究
染料降解反应在磷酸氢二钠-柠檬酸缓冲液(10 mmol/L pH8.0)中,温度28℃中进行,以加入高温灭活的漆酶为对照,用紫外分光光度计检测染料在其最大吸收波长处的吸光度变化。考察漆酶对偶氮类染料橙黄I、蒽醌类染料茜素红、三苯甲烷类染料碱性品红和杂环类染料亚甲基蓝等四类染料的降解脱色程度、染料浓度对脱色影响及漆酶含量对降解的影响。

式中,A0:脱色反应前溶液吸光值,A:脱色反应后溶液吸光值。所有脱色反应均重复3次取平均值。 2 结果 2.1 硫酸铵饱和度的确定
在0℃冰浴条件下,逐渐加入硫酸铵,饱和度从0-80%对M.verrucaria GH-01发酵上清液进行盐析,结果如图 1所示。随着硫酸铵的加入,蛋白被慢慢析出。当硫酸铵的饱和度达到65%时,发酵液上清的酶活为 49.8 U/L,上清液的相对酶活为最开始的2.8%,说明酶蛋白基本都被硫酸铵沉淀结合了。因此确定硫酸铵的饱和度为65%。
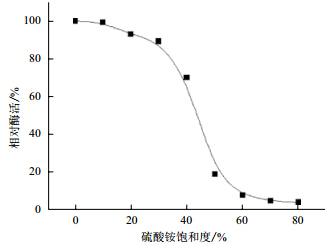 |
| 图 1 硫酸铵分级沉淀的结果 |
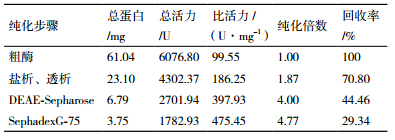
从发酵液上清的粗酶液到纯化最终获得的酶液,结果如表 1所示。最终获得8 mL液体样品,总酶活1 782.93 U,总蛋白3.75 mg,漆酶比活力475.45 U/mg,回收率29.34%,纯化倍数4.77。
将最终纯化得到的酶液进行SDS-PAGE和Native SDS-PAGE电泳,结果如图 2所示。SDS-PAGE电泳(图 2-A)显示,出现蓝色单一条带,说明了从M.verrucaria GH-01发酵上清液纯化后得到的漆酶为单体蛋白,目的蛋白分子量约为60 kD。通过对Native SDS-PAGE电泳的一块胶的不同处理,一半用考马斯亮蓝染色并脱色,另一半进入到含有ABTS的缓冲溶液中。结果(图 2-B)表明,纯化酶液的单一性和漆酶活性。至此获得M.verrucaria GH-01电泳纯单体蛋白。
 |
| 1 :蛋白质 marker ;2 :纯酶 ;3 :ABTS 染色过的纯酶 ;4 :考马斯亮蓝染色过的纯酶图 2 漆酶 SDS-PAGE(A) 和 Native-PAGE(B)电泳结果 |
在不同温度下测定M.verrucaria GH-01的漆酶活力,结果(图 3)显示,漆酶活性最适反应温度为40℃,在20-60℃下也表现了较高活性。温度对漆酶稳定性的影响如图 4所示,0℃保存条件下,漆酶保存3 h活力基本无变化;20、30℃条件下保存漆酶3 h,漆酶活力保持70%以上;40-60℃保存下的漆酶活力下降较快。综合考虑温度对漆酶活力及稳定性的影响,本实验后续对染料的降解实验,温度选择30℃。
 |
| 图 3 温度对粗漆酶活力的影响 |
 |
| 图 4 温度对漆酶稳定性的影响 |
不同pH值对粗漆酶活力的影响(图 5)显示,漆酶活性最适反应pH值为4.0,在pH值为3、7、8的条件下,酶活相对较低。pH值对漆酶稳定性的影响(图 6)显示,pH值为6.0的条件下,粗漆酶保存3 h活力保持在75%以上;pH值为3.0、4.0条件下保存粗漆酶3 h,酶活力粗漆酶活力下降较快,下降到5%,说明了此漆酶不耐酸。
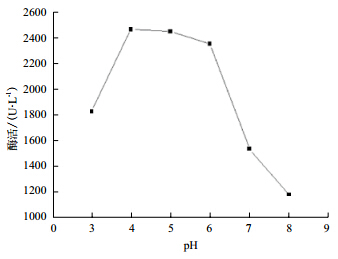 |
| 图 5 pH 值对粗漆酶活力的影响 |
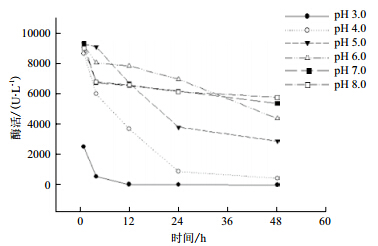 |
| 图 6 pH 值对漆酶稳定性的影响 |
4种染料橙黄I、亚甲基蓝、茜素红的染料浓度为50 mg/L,加入等量漆酶10 U,结果如图 7所示。漆酶对橙黄I和茜素红脱色程度较高,反应1 h后脱色率达到80%以上,对碱性品红脱色率较低在20%,而对亚甲基蓝脱色率最低。随着时间的变化,料橙黄I和亚甲基蓝变化幅度较小;而茜素红和碱性品红随时间变化,降解率有一定幅度的升高。
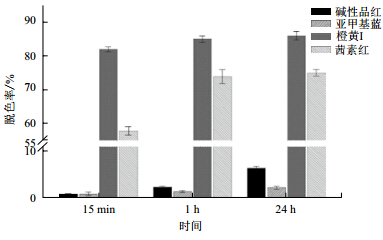 |
| 图 7 不同染料随时间的降解情况 |
分别配制含量为5-100 mg/L的4种不同染料,其中都加入含量为10 U的漆酶。染料的脱色情况(图 8)表明,脱色效率较好的橙黄I、茜素红以及脱色率较低的碱性品红都是在染料浓度为50 mg/L时脱色效率达到最高;而亚甲基蓝的浓度为10 mg/L和5 mg/L时脱色效率较好。
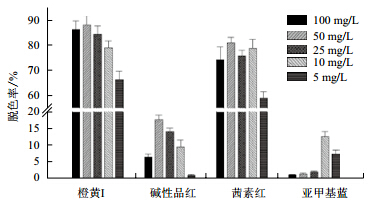 |
| 图 8 漆酶含量对不同的染料的降解情况 |
漆酶含量对橙黄Ⅰ的降解脱色影响,如图 9所示。虽然漆酶的含量不同,但经过24 h的降解脱色,脱色效率都达到80%以上。说明此漆酶对橙黄Ⅰ有很好的脱色效果。另外,随着漆酶的含量增加,其脱色效率有小幅上升。由此可见漆酶含量对橙黄Ⅰ的降解有一定的影响,但影响较小。
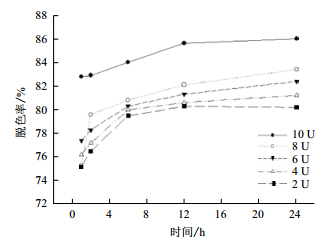 |
| 图 9 漆酶含量对橙黄Ⅰ的降解情况 |
虽然漆酶在动物、植物、微生物中等均能找到其存在的证据,但真菌漆酶由于其产酶量高和纯化技术相对容易,从而得到了最广泛的研究。在真菌漆酶的研究中又以子囊真菌(Ascomycetes)和担子真菌(Basidiomycetes)研究的最多,而半知菌研究的特别少。目前对半知菌漆酶的研究主要集中在产酶菌株的分离筛选和产酶条件水平上,如拟盘多毛孢属(Pestalotiopsis sp.)、新月弯孢(Curvularia lunata)和棘胞木霉(Trichoderma asperellum)等,但产酶水平与白腐真菌相比较低[9, 10, 11, 12]。本研究不仅拓展了漆酶蛋白来源而且其对染料的降解方面表现出了很好的应用价值。
从M.verrucaria GH-01发酵上清液中,通过硫酸铵分级沉淀、透析和离子交换柱层析纯化到了具有胞外漆酶活性的酶蛋白液,并通过SDS-PAGE和Native-PAGE证明了此酶为单体蛋白和具有漆酶活性。但从一些真菌中得到的漆酶,由于糖基含量的不同和自身结构差异,会使得其在分子质量存在较大差异,基本范围在50-130 kD之间;同时也会有同工漆酶的出现。Mimoz[13]就从Pleurotus eryngii的上清发酵液中纯化出性质不同的两种漆酶同工酶,它们的糖基含量和酶学性质等存在很大差异,而白蜡地层孔菌(Fomitella fraxinea)的两种同工酶Lac1和Lac2性质就很接近[14]。虽然漆酶的大小、性质及其结构都有一定的差距,但从一些漆酶的结晶分析中可知,其三级结构又有着一定的共性,大部分的漆酶催化中心都有4个Cu2+,他们在漆酶的催化反应中起着重要作用[15]。这也是值得我们去探索与研究的方面。
漆酶的酶学性质研究表明,我们所得的漆酶与大部分真菌漆酶的性质基本相符,其最适温度为40℃,30℃条件下保存粗漆酶3 h,其酶活力在70%以上;最适pH为4.0,并在低温及在碱性条件可以较好的维持漆酶的稳定性。染料在化工行业大量使用,但由于其一些染料自然条件下很难降解,需要特殊处理才能降解。而漆酶的一个重要应用就是对染料的降解。所得漆酶在对4种染料的脱色实验中,对橙黄I和茜素红降解程度较高,反应1 h后降解率即可达到80%以上,对碱性品红降解率较低在20%,漆酶对亚甲基蓝降解率最低;染料浓度为50 mg/L时,其中3种染料的脱色率都是最好的;漆酶对橙黄I脱色效果随着酶量的增加而逐渐显著。综上所述,该漆酶具有较好的应用前景和潜在的应用价值。 4 结论
对已经分离鉴定出的疣孢漆斑菌GH-01所产漆酶对其进行分离纯化,得到单体纯蛋白。该漆酶催化反应的最适温度为40℃,最适pH值为4.0。该漆酶在低温及碱性条件具有较好的稳定性。在对染料的脱色能力的研究中,该漆酶对橙黄Ⅰ和茜素红脱色效果较佳,对碱性品红和亚甲基蓝脱色能力较弱。当染料未被酶饱和时,随着漆酶浓度的增加,脱色率也会增加。在含10 U漆酶的体系中,对50 mg/L的染料降解效果相对最好。
| [1] | Thurston CF.The structure and function of fungal laccases[J].Microbiology,1994,140(1):19-26. |
| [2] | Xu F,Shin W,Brown SH,et al.A study of a series of recombinant fungal laccases and bilirubin oxidase that exhibit significant differences in redox potential,substrate specificity,and stability[J].Biochimica et Biophysica Acta (BBA)-Protein Structure and Molecular Enzymology,1996,1292(2):303-311. |
| [3] | Xu F.Oxidation of phenols,anilines,and benzenethiols by fungal laccases:correlation between activity and redox potentials as well as halide inhibition[J].Biochemistry,1996,35(23):7608-7614. |
| [4] | Gianfreda L,Xu F,Bollag JM.Laccases:a useful group of oxidoreductive enzymes[J].Bioremediation Journal,1999,3(1):1-26. |
| [5] | 孙东梅,蔡称心,邢巍,等.含铜氧化酶在活性炭上的固定及直接电化学[J].科学通报,2004,49(17):1722-1725. |
| [6] | Dekker RFH,Barbosa AM.The effect of aeration and veratryl alcohol on the production of two laccases by the ascomycete Botryosphaeria[J].Enzyme Microb Technol,2001(28):81-88. |
| [7] | 万云洋,杜予民.漆酶来源与应用[J].中国科技论文在线,2011(6):1-11. |
| [8] | 张素轩.半知菌分类的进展[J].南京林业大学学报:自然科学版,1980,1:95-108. |
| [9] | 郭尧君.蛋白质电泳实验技术[M].北京:科学出版社,1999:175-184. |
| [10] | Hao J,Song F,Huang F,et al.Production of laccase by a newly isolated deuteromycete fungus Pestalotiopsis sp.and its decolorization of azo dye[J].Journal of Industrial Microbiology&Biotechnology,2007,34(3):233-240. |
| [11] | 姜庆宏,赵敏.新月弯孢霉产漆酶培养条件的优化[J].农产品加工,2009(3):62-64. |
| [12] | Liu Z,Zhang D,Hua Z,et al.Improvement of laccase production and its properties by low-energy ion implantation[J].Bioprocess and Biosystems Engineering,2010,33(5):639-646. |
| [13] | Munoz C,Guillén F,Martínez AT,et al.Laccase isoenzymes of Pleurotus eryngii:characterization,catalytic properties,and participation in activation of molecular oxygen and Mn2+oxidation[J].Applied and Environmental Microbiology,1997,63(6):2166-2174. |
| [14] | Yaver DS,Xu F,Golightly EJ,et al.Purification,characterization,molecular cloning,and expression of two laccase genes from the white rot basidiomycete Trametes villosa[J].Applied and Environmental Microbiology,1996,62(3):834-841. |
| [15] | 万云洋,杜予民.漆酶结构与催化机理[J].化学通报,2007,70(9):662-670. |