樟子松(Pinus sylvestris L.var.mongolica)是欧洲赤松(P.sylvestrisL.)的一个地理变种,为松科松属高大常绿乔木,具有抗寒、抗旱、耐贫瘠、适应性强和较速生等优良特性,是我国"三北"重要的造林主要树种之一[1, 2]。近年来,在樟子松外生菌根真菌的筛选和鉴定中发现褐环乳牛肝菌(Suillusluteus (L.Fr) Gary,简称:SP.)与樟子松根系快速形成菌根,对樟子松幼苗的早期生长有明显的促进作用,是樟子松菌根化育苗首选的菌根真菌[3]。
外生菌根的形成及其功能改变真菌和植物的基因表达,从而产生新的蛋白质模式和高度协调的代谢相互作用。外生菌根改变C和N同化酶的生物合成和分布,这些变化的性质取决于植物和真菌的共生。这些变化影响N-同化途径的酶(如NADP-谷氨酸脱氢酶)糖酵解和磷酸戊糖途径,导致菌根的氨基酸和碳水化合物含量大幅改变。因此,了解真菌和宿主植物的生化途径和菌根功能的规律有助于了解外生菌根真菌共生对宿主植物代谢调节的影响。
异柠檬脱氢酶(isocitrate dehydrogenases,IDHs)在三羧酸(TCA)循环中催化异柠檬酸氧化脱羧生成α-酮戊二酸可为植物对氨的同化提供碳骨架,而NADPH可以维系细胞内的氧化还原平衡,帮助植物抵御氧化胁迫。目前IDH是国际上公认的研究蛋白质结构与功能关系、酶的催化与调节机制、蛋白质分子进化机制的最好模型之一[4]。根据辅酶特异性,IDH分为NAD-依赖型IDH和NADP-依赖型IDH[5]。目前为止,研究发现在生物体内NADP-依赖型异柠檬酸脱氢酶(NADP-IDH)有两种方式存在,其中一种位于线粒体基质中,另一种位于细胞浆中,包括叶绿体和过氧化物酶体[5, 6]。根据亚基组成,异柠檬酸脱氢酶可以分为两种,第一种是单体异柠檬酸脱氢酶,这种类型的酶占极少数,分子量在80-100 kD之间;第二种是同源二聚体异柠檬酸脱氢酶,这种类型的酶占大多数,亚基分子量在40-50 kD之间[7]。大多数真核生物异柠檬酸脱氢酶属于第二种类型,即同源二聚体[8]。目前国外关于IDH在裸子植物中的表达机制鲜有报道。国内关于樟子松外生菌根的研究大量集中于如何提高苗木质量,菌根真菌多样性、菌根共生体的接种效应、组培苗菌根化等研究方向,而对樟子松与外生菌根真菌共生代谢机制还没有相关报道。本研究分别从樟子松-褐环乳牛肝菌共生菌根组织、根组织及真菌纯培养菌丝中提取纯化IDH,并进行酶学性质研究,为深入了解樟子松IDH催化机制及共生真菌对樟子松IDH催化机制,功能和代谢的影响提供参考。 1 材料与方法 1.1 材料
供试樟子松根组织、外生菌根及褐环乳牛肝菌均为本实验室人工无菌培养和保存。通用蛋白裂解抽提试剂盒、BCA法蛋白定量试剂盒、透析袋(截留分子量6 000-8 000)均购自上海捷瑞生物工程有限公司,葡聚糖凝胶Sephadex G-75购自Pharmacia公司,其它试剂均为国产分析纯。 1.2 方法 1.2.1 粗酶液的提取及纯化
将样品液氮充分研磨后按通用蛋白裂解抽提试剂进行操作提取粗酶液,将上述粗酶液预冷至4℃,缓慢加入固体硫酸铵粉末至饱和度为25%,4℃静置1 h后,4℃ 14 000 r/min离心15 min,取上清液加入固体硫酸铵粉末至饱和度为30%,重复上述操作,每隔5%饱和度盐析一次,直到终浓度至70%饱和度为止。所有沉淀均用20 mmol/L PBS (pH7.4)缓冲液溶解,装入透析袋,在4℃,20 mmol/L PBS (pH7.4)缓冲液中透析。分级沉淀得到的蛋白液再用葡聚糖凝胶Sephadex G-75再次进行纯化。SDS-PAGE鉴定纯化后的纯度。 1.2.2 酶活性测定
蛋白浓度的测定使用上海捷瑞生物工程有限公司生产的BCA法蛋白定量试剂盒,以牛血清白蛋白(Bovine serum albumin,BSA)为标准蛋白,参照试剂盒操作手册按Bradford法[9]操作。采用分光光度法测定酶活性,IDH的酶活测定体系为20 mmol/L Tris-HCl、5 mmol/L MgCl2、5 mmol/L DL-isocitric acid trisodium或0.5 mmol/L DL-isocitric acid trisodium、0.5 mmol/L NADP+。在25℃下,使用紫外分光光度计检测反应过程中340 nm处光吸收值的变化。1个酶活力单位(U)是指在特定条件(25℃,其它为最适条件)下,在1 min内能转化1 μmoL底物的酶量。 1.2.3 酶动力学参数测定
保持反应液体系中其它组分的终浓度不变,分别取不同浓度的NADP+或底物异柠檬酸的终浓度,用紫外分光光度计,25℃下检测A340的变化,根据Lineweaver-Burk双倒数法计算各酶对NADP+的Km值并计算催化常数Kcat。 1.2.4 最适反应pH测定
在标准的反应体系中以Mn2+为激活剂,NADP+为辅酶,在20 mmol/L (pH6.0-10.0)的Tris-HCl缓冲液中,25℃下测定各酶活性;每个pH设置3个平行,统计结果并依据公式计算出酶活性,把酶活力最高点设为100%,以pH值为横坐标,以相对酶活力为纵坐标作图,求出最适pH。 1.2.5 酶最适温度的测定及热稳定性测定
在标准的反应体系中以Mn2+为激活剂,NADP+为辅酶,在25-55℃之间,以5℃为间隔,测定IDH酶活力。以温度为横坐标,以相对酶活力为纵坐标绘图,求出酶的最适反应温度。将IDH在25-60℃之间,每隔5℃水浴20 min后立即放在冰上冷却,测定酶残余活力,以温度为横坐标,以相对残余酶活力为纵坐标绘图,确定不同温度对酶活力的影响。 1.2.6 金属离子依赖性的测定
25℃条件下,无Mn2+为激活剂,维持标准的反应溶液体系中其他成分不变,在体系中分别加入终浓度为5 mmol/L的MgCl2、MnCl2、CoCl2、CaCl2、ZnSO4、CuCl2、NaCl和KCl测定IDH活力,实验独立重复3次,统计结果并依据公式计算3种来源的异柠檬酸脱氢酶的酶活性。在已含有终浓度为5 mmol/L MnCl2的标准反应溶液体系中再分别加入上述离子,确定各金属离子单独存在或同时存在时对IDH活力的影响。 2 结果 2.1 SDS-PAGE电泳检测
经多步纯化后,SDS-PAGE电泳(图 1)显示蛋白均为单一条带。菌根组织和真菌纯培养菌丝中的异柠檬酸脱氢酶亚基相对分子质量约46 kD左右,根组织中大小约45 kD左右。菌根和根组织IDH纯化结果对应的硫酸铵分级沉淀梯度范围是40%-45%,真菌纯培养菌丝IDH对应的沉淀梯度为35%-40%。
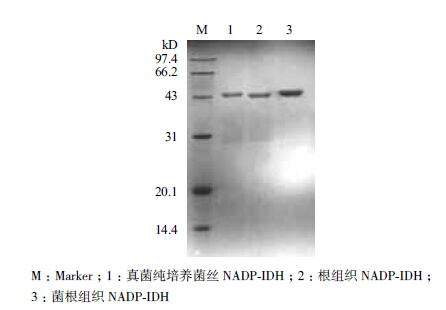 |
| 图 1 异柠檬酸脱氢酶的SDS-PAGE电泳图 |
由表 1可知,当以Mn2+为激活剂时,菌根组织、根组织和真菌中IDH对NADP+的Km分别为10.7 μmol/L、11.4 μmol/L和22.1 μmol/L。菌根组织中IDH对NADP+的亲和力分别高于根组织和真菌中IDH对NADP+的亲和力,由Kcat/Km比值得出菌根组织中IDH对NADP+催化速率高于根和真菌中的IDH。
由表 2可知,当以Mn2+为激活剂时,菌根组织中IDH对异柠檬酸的亲和力分别高于根组织和真菌中IDH对NADP+的亲和力,菌根组织中IDH对NADP+催化速率高于根和真菌中的IDH。菌根组织中的IDH对NADP+的亲和力高于对异柠檬酸的亲和力。
在pH6.0-10.0的缓冲液中测定酶的活力,结果见图 2,菌根组织、根组织及真菌纯培养菌丝NADP+-IDH的最适pH分别为8.2、8.0和7.5。菌根组织IDH、根组织IDH和真菌纯培养菌丝IDH的最适pH都略偏碱性。
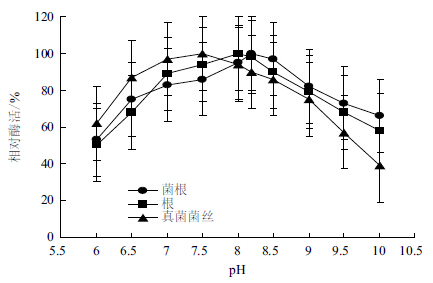 |
| 图 2 pH对异柠檬酸脱氢酶活力的影响 |
采用标准测定体系,在25-55℃条件下分别测定酶活力,结果见图 3。菌根组织和根组织IDH的最适反应温度为45℃,真菌纯培养菌丝IDH的最适反应温度为42℃。菌根组织IDH在35-50℃之间保持80%以上的活力,当温度大于50℃时,菌根组织IDH活力下降缓慢,而根组织和真菌IDH活力下降较快。
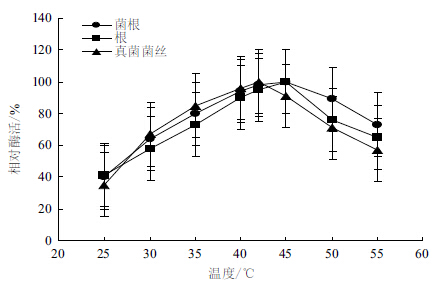 |
| 图 3 温度对3种异柠檬酸脱氢酶活力的影响 |
将3种IDH在25-60℃之间处理20 min,分别测定酶的残余活力,结果见图 4。菌根组织、根组织及真菌纯培养菌丝NADP+-IDH在25-35℃之间活力较为稳定,并在35℃时具有最大残余活力,随后酶活力显著下降。在55℃时菌根IDH和根IDH酶活丧失了约80%,而真菌纯培养菌丝IDH酶活下降了约90%。在40℃真菌纯培养菌丝IDH的酶活下降了约50%,根组织IDH的活力下降了40%,而菌根组织IDH只下降了10%。在25-40℃之间,菌根组织IDH的活力要比根组织IDH和真菌纯培养菌丝IDH的活力保持的较为稳定。
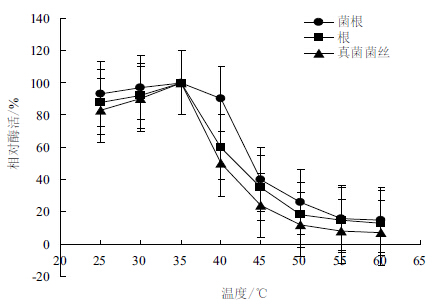 |
| 图 4 温度对异柠檬酸脱氢酶稳定性的影响 |
金属离子对异柠檬酸脱氢酶活性影响的结果见表 3。3种IDH均在Mn2+存在时酶活性最强,其次为Mg2+。Ca2+、Co2+、Cu2+和Zn2+都能使IDH活性损失80%-90%,其中Ca2+使真菌纯培养菌丝IDH完全失活。K+和Na+也是IDH的强抑制剂。当反应液中已经有Mn2+存在的情况下再加入K+或Na+时,NADP+-IDH的酶活能够完全恢复,Mn2+还可以部分恢复Co2+和Ca2+对菌根组织、根组织和真菌纯培养菌丝IDH的抑制作用,但不能恢复Cu2+、Zn2+对菌根组织、根组织和真菌纯培养菌丝IDH活性的影响。
异柠檬酸脱氢酶是起源古老的一大类酶家族,从原核生物的真细菌(Eubacteria)、古菌(Archaea)到真核生物的真菌、动物及植物都有分布。它是研究蛋白质结构与功能关系、酶的催化与调节机制、蛋白质分子进化机制的良好模型之一[10]。
在本研究中,SDS-PAGE电泳结果与对应序列碱基理论值大小相符,表明3种酶均为异柠檬酸脱氢酶。3种来源的异柠檬酸脱氢酶的最适pH分别为8.2、8.0和7.5,表明樟子松在形成外生菌根后耐碱性有所提高。最适温度分别为45℃、45℃和42℃。IDH在无离子存在下没有活性,金属离子依赖性表明3种来源的IDH是典型的二价金属阳离子依赖型异柠檬酸脱氢酶,Mn2+是异柠檬酸脱氢酶的最强激活剂,其次为Mg2+,因此IDH实际催化的底物是异柠檬酸与Mn2+或Mg2+形成复合物。酶动力学参数结果为NADP-IDH对NADP+的Km值分别为10.7 μmol/L、11.4 μmol/L和22.1 μmol/L,对底物异柠檬酸的Km值分别为71.7 μmol/L、79.3 μmol/L和87.8 μmol/L,表明菌根IDH对底物的亲和力都要高于根组织IDH和真菌纯培养菌丝IDH。由以上结果分析表明,外生菌根的形成促进了异柠檬酸脱氢酶的活性和稳定,这为在樟子松菌根系统中研究异柠檬酸脱氢酶基因功能、表达调控机制以及异柠檬酸脱氢酶与樟子松能量代谢之间的关系提供了有力的条件。本实验只对樟子松外生菌根中异柠檬酸脱氢酶做了一个初步的探讨,该酶的结构、功能、体内合成、运转、储存情况及表达等方面还有待于进一步研究。 4 结论
樟子松与褐环乳牛肝菌形成共生菌根之后,其菌根组织内异柠檬酸脱氢酶的蛋白含量、酶活力都得到了提高,这可能是由于樟子松形成外生菌根之后使其体内的异柠檬酸脱氢酶活性增强。
| [1] | 张玉花,采花,王一超,等.高效解磷钾细菌与褐环乳牛肝菌共接种对樟子松幼苗的促生效应[J].农产品加工,2014(12):41-43. |
| [2] | 邵明.简述樟子松壮苗培育技术[J].内蒙古林业,2014(4):24-25. |
| [3] | 张文泉,闫伟.外生菌根菌对樟子松苗木生长的影响[J].西北植物学报,2013,33(5):998-1003. |
| [4] | 许希晨,葛亚东,王敖,等.枯草杆菌及大肠杆菌异柠檬酸脱氢酶的酶学性质研究[J].激光生物学报,2010(6):374-396. |
| [5] | Domínguez-Martín MA,López-Lozano A,Jesús Diez,et al.Physiological regulation of isocitrate dehydrogenase and the role of 2-oxoglutarate in Prochlorococcus sp.strain PCC 9511[J].Plos One,2014(7). |
| [6] | 王鹏,赵旵军,翟羽佳.植物NADP+-依赖型异柠檬酸氢酶的分子进化及功能研究进展[J].生物学杂志,2009,26(3):45-48. |
| [7] | 郝兆丰,袁进成,刘颖慧.异柠檬酸脱氢酶在植物抗氧化胁迫中的作用[J].生物技术通报,2012(6):33-35. |
| [8] | Jin MM,Wang P,Li X,et al.Biochemical characterization of NADP+-dependent isocitrate dehydrogenase fromMicrocystis aeruginosa PCC 7806[J].Molecular Biology Reports,2013,40:2995-3002. |
| [9] | 吕华军,刘德辉,董元华,等.Bradford法测定土壤球囊霉素相关蛋白的影响因子[J].生态与农村环境学报,2011,27(5):93-97. |
| [10] | 苏蕊蕊.野油菜黄单胞菌8004异柠檬酸脱氢酶的酶学性质研究和辅酶特异性改造[D].芜湖:安徽师范大学,2012. |







