Vezf1(Vascular endothelial zinc finger 1)是最先在小鼠卵黄囊血岛中发现的一个血管内皮及其前体细胞特异表达的基因。Vezf1基因编码一个56 kD大小的蛋白质,由518个氨基酸组成,包含6个C2H2型(kruppel样)的锌指结构基序和C端富含脯氨酸的反式转录激活结构域[1]。锌指蛋白基因家族是最重要的转录因子基因家族,该家族的基因产物广泛参与细胞分化和胚胎发育,并与许多疾病的发生相关。C2H2型锌指是锌指蛋白家族中最普遍的类型,它们作为重要的转录调节因子参与许多生理过程[2]。Vezf1最初可以在发育至7.25 d的小鼠胚胎中胚层前部检测到,只限定在血管内皮及其前体细胞上表达,伴随胚胎发育初期的血管发生(Vasculogenesis)和血管新生(Angiogenesis)过程。因此,它可能是控制着某些内皮细胞特异性基因转录的关键转录因子,从而影响血管内皮细胞分化、心血管系统的发育和血管新生等重要生理过程[3]。
鸡胚是发育生物学重要的模式动物之一,几个世纪以来被广泛应用于发育、免疫、病毒及细胞生物学研究中[4]。与其他动物模型相比,它具有许多与生俱来的优势。首先,鸡胚可以非常方便地获得,并可以在其发育的任何阶段进行体外操作和直接观察,为研究提供了极大的便利;同时鸟类与哺乳动物进化距离相近,因而也是基因功能研究的理想体内模型[5]。鸡胚有多种体外培养体系,可以在无壳的体外环境下培养,进一步提高了它的可操作性[6]。另外,还可以利用鸡-鹌鹑嵌合体模型进行研究,在早期血管发育研究中具有得天独厚的优势[7]。通过鸡胚这一重要的模式生物,人们在发育生物学方面已经取得了许多重要发现。例如,B淋巴细胞的发现、成熟和分化机制[8],病毒的致瘤性[9],神经嵴细胞的迁移和分化等[10]。研究鸡胚中Vezf1基因的功能对于深化Vezf1基因在血管系统发育中功能的认识,以及在小鼠以外的其他模式动物中的功能与作用机制,具有重要的意义。
RNAi技术是目前在鸡胚中进行基因功能研究的重要手段之一。RCAS[Replication-Competent ASLV long terminal repeat (LTR) with a Splice acceptor]是目前在鸡胚中较为常用的基因沉默载体。它来源于禽类劳氏肉瘤病毒,是逆转录病毒载体的一种[11]。复制完全型的RCAS载体病毒可以在宿主细胞内自我复制而无需其他的辅助质粒,将RCAS质粒转染鸡成纤维细胞或DF1细胞,大量病毒颗粒包装后释放到培养液中,收集并浓缩后即可用于感染细胞和活体胚胎。由于可以在宿主细胞内自我复制并释放出大量病毒感染临近的处于分裂期的细胞,因此RCAS病毒与慢病毒载体相比特别适合于感染胚胎早期处于快速分裂期的细胞并造成胚胎大面积的感染,这更有利于在活体胚胎上的基因沉默实验[12]。
本研究首次构建鸡胚Vezf1基因RCAS病毒干扰载体,并在活体鸡胚体内对Vezf1基因实施沉默,检测基因沉默的效果,旨为在鸡胚中深入研究vezf1基因的功能和分子机制奠定基础。 1 材料与方法 1.1 材料 1.1.1 鸡胚与细胞株
所使用的SPF级种蛋购自济南斯帕法斯有限公司,DF1细胞系及原代鸡胚成纤维细胞为本室保存。 1.1.2 质粒、菌株和实验试剂
E.coli DH5α菌株为本室保存,RCAS、pRFPRNAi质粒为英国罗斯林研究所MJ.McGrew博士惠赠,引物合成(广州英骏生物技术有限公司),限制性内切酶和TurboFect转染试剂(Fermentas公司),T4 DNA连接酶(TaKaRa公司),反转录试剂盒、ReverTra Ace qPCR RT Kit和SYBR Green (TOYOBO公司),Trizol (Invitrogen公司),DIG探针制备试剂盒(SP6/T7)(Roche公司)。 1.2 方法 1.2.1 RCAS干扰载体的构建
使用GenScript siRNA Target Finder siRNA靶位点设计软件进行RNAi靶点筛选和引物设计。通过PCR的方法合成带有插入位点和发夹结构的RCAS干扰质粒DNA插入片段,PCR反应程序为:95℃ 2 min;95℃ 20 s,55℃ 20 s,72℃ 30 s,40个循环;72℃ 5 min;4℃保持。然后将目的片段胶回收,分别用NheⅠ和AflⅡ两种核酸内切酶对PCR扩增片段和pRFPRNAi质粒酶切后使用T4 DNA连接酶连接。经鉴定无误后再使用NotⅠ和ClaⅠ核酸内切酶将连接有插入序列的pRFPRNAi载体的基因沉默元件切下,连接到RCAS载体上[13]。将连接产物转化DH5α感受态细胞,从转化的平板上挑取DNA单克隆菌落,使用NotⅠ和ClaⅠ核酸内切酶双酶切验证质粒,并测序插入片段,确保获得正确克隆。根据miRNA30型发夹结构设计引物(表 1)。其中正义链靶位点5'端一个碱基设计成错配以模拟miRNA30的结构。
将DF1细胞接种于6 cm细胞培养皿中,在细胞密度达到约80%左右时根据TurboFect转染试剂说明书转染。72 h后观察绿色荧光阳性细胞达到总细胞数的90%以上时,收集病毒上清,并重新加入含有2% FBS的DMEM培养基继续培养,之后每24 h收集病毒1次,共收集3次。病毒上清使用0.45 μm滤器过滤后置于Beckman高速离心机,4℃,50 000×g,离心2.5 h。取出离心管,小心地倒掉上层液体,此时可见病毒聚集于管底呈白色,加入100 μL DMEM培养基,冰上轻摇1-2 h,待完全溶解后分装于-80℃冻存。取部分病毒使用梯度稀释法进行病毒滴度检测。 1.2.3 活体鸡胚病毒显微注射实验
SPF鸡种蛋的保存和使用参考Chapman等[14]的方法稍加改进。将种蛋取出用75%酒精擦拭表面,用眼科剪在种蛋底部的位置打一个刚能插入针头的小孔,用5 mL注射器缓慢抽除1-1.5 mL蛋清,小心避免卵黄囊破损。钝端朝上静置3-5 min。同时从-80℃冰箱中取出病毒,冰上解冻,加入1/10体积的亮绿;用眼科剪先在鸡蛋气室端上部打一个洞,再小心地剪开蛋壳,使胚胎刚好曝露在剪开的圆形窗口中,将鸡蛋置于体视显微镜下,用准备好的注射用毛细管吸取定量的病毒液,小心地注射到鸡胚的相应部位;用透明胶带将开口封严,避免胶带接触蛋清,放入孵化箱继续孵化;孵化至预定时间后,将鸡蛋取出,去除封口胶带,置于体视荧光显微镜下观察GFP的表达情况或将鸡胚小心的用眼科剪剪下置于倒置荧光显微镜下观察和拍照。 1.2.4 细胞和胚胎RNA 提取及qPCR检测实验
将本实验室保存的SPF 8日龄鸡胚成纤维细胞接种于6 cm细胞培养皿中,过夜贴壁后加入5 mL病毒上清液感染12 h,然后换成新鲜培养基继续培养。感染3 d后,在细胞培养皿中加入6 mL PBS清洗并重复一次,将PBS清洗液弃去后加入1 mL Trizol,轻轻吹打混匀,室温静置5 min;对于胚胎应先使用眼科剪将胚胎剪碎。RNA提取步骤按照Trizol说明书进行。然后使用ReverTra Ace qPCR RT Kit对上述提取的RNA进行反转录。
qPCR引物及内参基因GAPDH引物设计如下:cVezf1-F:5'-AGCAAGCCCGTCAAGAAGAACC-3',cVezf1-R:5'-GTGATGCCACCCTCGTGAGACC-3',cGAPDH-F:5'-TTTGGCATTGTGGAGGGTCTTA-3',cGAPDH-R:5'-TCTTGTAGTAGGGTCGCAGGTG-3'。qPCR的反应程序如下:95℃ 3 min;95℃ 10 s,62℃ 45 s,40个循环;熔解曲线55-95℃;结束反应。 1.2.5 鸡胚原位杂交实验
将胚胎在4%新鲜(或新解冻的)的多聚甲醛(PAF)中固定(使用PBS配制),4℃过夜;在PBT (PBS+0.1% Tween20)中分离胚胎,置于脱色摇床上轻摇5 min洗1次;胚胎经过一系列梯度的甲醇/PBT脱水,分别是25%、50%、75%和100%,在每个梯度下胚胎室温轻摇5 min,再用100%的甲醇洗5 min。此后胚胎可以在-20℃保存1个月。
首先用罗氏DIG探针制备试剂盒合成探针,具体方法见使用说明。胚胎原位杂交步骤如下:将胚胎梯度复水后用6%过氧化氢漂白1 h;蛋白酶K处理15 min;2 mg/mL甘氨酸洗10 min后用4% PFA和0.2%戊二醛室温处理20 min;加入RNA探针进行杂交反应70℃过夜。第2天使用10%热灭活山羊血清封闭后加入抗体4℃过夜。第3天使用TBST清洗胚胎,于4℃轻摇过夜。第4天加入NBT/BCIP反应混合液显色,之后用4% PFA/0.1%戊二醛后固定。 2 结果 2.1 鸡Vezf1基因RCAS沉默载体的构建
使用OligoW和OligoY引物与Vezf1451-F和Vezf1451-R引物PCR合成带有发夹结构的DNA插入片段长度为170 bp,PCR产物两端分别带有NheⅠ和AflⅡ酶切位点。用胶回收试剂盒回收PCR产物后,使用内切酶NheⅠ和AflⅡ分别酶切PCR产物和pRFPRNAi质粒,然后用T4 DNA连接酶连接并鉴定(图 1-A)。取连接成功的质粒用内切酶NotⅠ和ClaⅠ酶切,并将切下的较短片段用胶回收试剂盒回收,RCAS质粒也使用NotⅠ和ClaⅠ酶切后与上一步的酶切片段连接(图 1-B)。最后使用同样的内切酶验证载体构建成功,目的片段约900 bp (图 1-C),经测序显示RCAS-1451与设计序列相同无突变。
 |
| 图 1 RCAS-1451病毒载体构建及验证 |
分别将RCAS质粒和RCAS-1451质粒转染DF1细胞,包装的病毒具有自我复制能力可以在培养皿内形成反复感染,3 d后收集含有病毒的细胞培养上清液。使用含有RCAS和RCAS-1451病毒的细胞培养上清液感染从八日龄SPF鸡胚中原代分离的成纤维细胞。RCAS载体病毒自身表达GFP蛋白作为指示标记物,可以通过观测荧光表达分析病毒感染情况。使用病毒感染3 d后,细胞的感染率可以达到95%以上(图 2)。
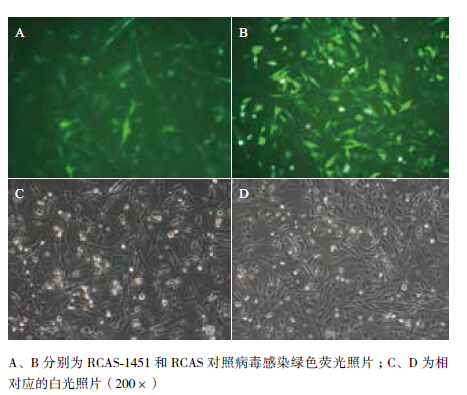 |
| 图 2 RCAS病毒感染SPF八日龄鸡胚成纤维细胞 |
提取被病毒感染的鸡成纤维细胞总RNA,反转录成cDNA后用qPCR法检测病毒对Vezf1基因的沉默效率。首先用标准曲线法检测了Vezf1和内参基因GAPDH基因qPCR引物的扩增效率,两者分别为99%和98%,符合采用2-ΔΔCt算法对qPCR检测引物扩增效率在95%-105%之间的要求。经qPCR检测RCAS-1451病毒干扰组的Vezf1基因相对表达量为正常对照组的28%(图 3)。
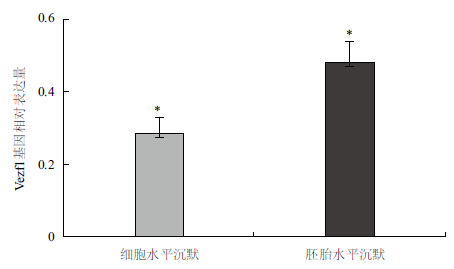 |
| 图 3 qPCR检测病毒在细胞和胚胎水平上对Vezf1基因的沉默效率(n=5,*P<0.05) |
为检测活体胚胎注射病毒的感染效果,在HH stage 1(孵化前期)鸡胚的胚胎下腔中注射1.5-2 μL病毒后于第3-4天在荧光体视显微镜下观察胚胎的感染情况。结果(图 4)显示,胚胎的头部、躯干部及脑泡等各部位均观察到明显的GFP表达,表明胚胎已成功被RCAS载体病毒感染。
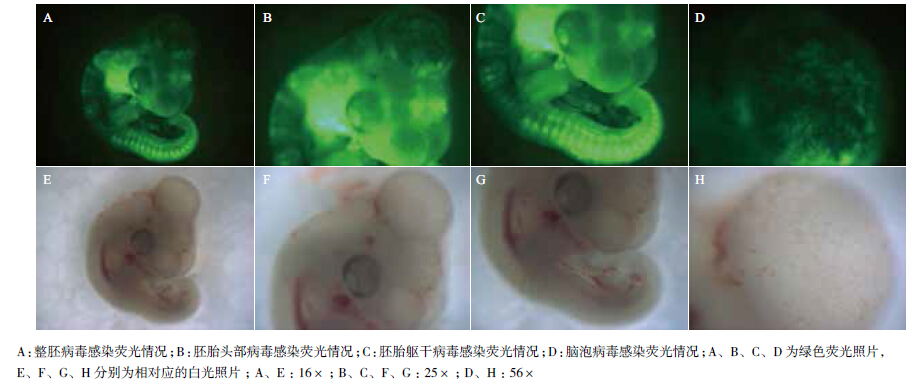 |
| 图 4 体视显微镜下观察胚胎感染效果 |
分别将RCAS-1451干扰病毒和RCAS对照病毒注射的胚胎取出并提取RNA,反转录为cDNA,qPCR检测干扰组病毒在活体胚胎水平上对Vezf1基因的沉默效果。对qPCR结果进行了统计,注射干扰组RCAS-1451病毒的胚胎与对照组相比Vezf1的表达水平平均降低了52%,比在细胞水平上检测的72%的抑制效率相比有所降低。
为了更直观地检验RCAS-1451病毒在活体鸡胚上对Vezf1基因的沉默效果,进一步使用原位杂交的方法进行了干扰病毒感染后基因表达情况的检测。首先,合成了针对Vezf1基因的反义链RNA探针,并另外合成正义链RNA探针作为阴性对照。分别用RCAS-1451病毒和RCAS对照组病毒感染胚胎,3 d后将胚胎取出,进行原位杂交实验,原位杂交显色的深浅可以显示基因在胚胎上的表达情况。结果(图 5)显示,使用RCAS-1451病毒感染的胚胎与RCAS感染的对照组胚胎相比,在Vezf1基因表达比较丰富的脑泡、眼部、前吻、肢芽等处Vezf1的表达都明显降低,而使用正义链探针的阴性对照组胚胎没有显色。以上结果表明,我们构建的RCAS干扰载体病毒在活体胚胎水平上有效沉默了Vezf1基因的表达。
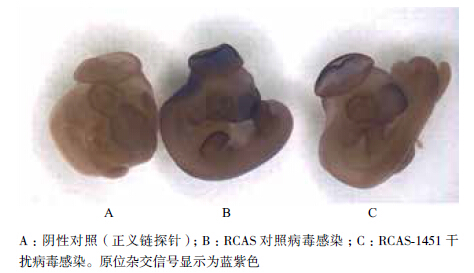 |
| 图 5 原位杂交法检测RCAS-1451病毒在活体鸡胚上对Vezf1基因的抑制情况 |
近年来,基因敲除技术逐渐成为研究基因功能必不可少的工具,但传统的基因敲除手段很难用于鸡胚而获得基因敲除或功能缺失的个体,利用RNAi进行基因沉默表达是理想的研究方法。目前在鸡胚导入基因干扰载体主要通过电穿孔法和病毒感染法。电穿孔转入技术可以快速在鸡胚导入基因表达构件[15, 16]。但该方法有许多缺点:首先,质粒的表达是瞬时的,一般电转后表达只能持续1 d左右然后就逐渐减弱[17];第二,作用范围局限,主要用于对具有管腔结构的组织感染[18];第三,电穿孔法易对胚胎造成损伤。利用病毒自然感染的特性导入基因干扰构件则可以克服电击导入法的许多不足。RCAS载体系统来源于鸡劳氏肉瘤病毒(RSV),对鸡胚和细胞具有较强的感染能力[19]。另外,与哺乳动物中常用的慢病毒载体系统相比RCAS病毒可以自我包装复制而无需其他辅助质粒,有利于病毒的包装和胚胎的大面积感染。目前,这方面的实验性的研究还甚为缺乏,偶见一些利用病毒感染实施鸡胚基因沉默的报道,但基本上都是针对特定部位进行感染[20, 21]。本研究首次使用RCAS载体病毒在活体胚胎水平对Vezf1基因实施沉默,并分别用qPCR和原位杂交法检测基因沉默效果,成功实施了基因沉默。 4 结论
本研究构建了鸡Vezf1基因的RCAS载体病毒,该RCAS载体病毒能够成功在细胞和胚胎水平上对Vezf1实施基因沉默表达。
| [1] | Koyano-Nakagawa N,Nishida J,et al.Molecular cloning of a novel human cDNA encoding a zinc finger protein that binds to the interleukin-3 promoter[J].Mol Cell Biol,1994,14(8):5099-5107. |
| [2] | Clark SP,Lewis CD,Felsenfeld G.Properties of BGP1,a poly (dG)-binding protein from chicken erythrocytes[J].Nucleic Acids Res,1990,18(17):5119-5126. |
| [3] | Xiong JW,Leahy A,Lee HH,et al.Vezf1:A Zn finger transcription factor restricted to endothelial cells and their precursors[J].Dev Biol,1999,206(2):123-141. |
| [4] | Stern CD.The chick;a great model system becomes even greater[J].Dev Cell,2005,8(1):9-17. |
| [5] | Bron R,Eickholt BJ,Vermeren M,et al.Functional knockdown of neuropilin-1 in the developing chick nervous system by siRNA hairpins phenocopies genetic ablation in the mouse[J].Dev Dyn,2004,230(2):299-308. |
| [6] | Perry MM.A complete culture system for the chick embryo[J].Nature,1988,331(6151):70-72. |
| [7] | Le Douarin N.A biological cell labeling technique and its use in expermental embryology[J].Dev Biol,1973,30(1):217-222. |
| [8] | Reynaud CA,Anquez V,Grimal H,et al.A hyperconversion mechanism generates the chicken light chain preimmunerepertoire[J].Cell,1987,48(3):379-388. |
| [9] | Kahn P,Nakamura K,Shin S,et al.Tumorigenicity of partial transformation mutants of Rous sarcoma virus[J].J Virol,1982,42(2):602-611. |
| [10] | Le Douarin NM.A Feulgen-positive nucleolus[J].Exp Cell Res,1973,77(1):459-468. |
| [11] | Hughes SH,Greenhouse JJ,Petropoulos CJ,et al.Adaptor plasmids simplify the insertion of foreign DNA into helper-independent retroviral vectors[J].J Virol,1987,61(10):3004-3012. |
| [12] | Gordon CT,Rodda FA,Farlie PG.The RCAS retroviral expression system in the study of skeletal development[J].Dev Dyn,2009,238(4):797-811. |
| [13] | Das RM,Van Hateren NJ,Howell GR,et al.A robust system for RNA interference in the chicken using a modified microRNA operon[J].Dev Biol,2006,294(2):554-563. |
| [14] | Chapman SC,Lawson A,Macarthur WC,et al.Ubiquitous GFP expression in transgenic chickens using a lentiviral vector[J].Development,2005,132(5):935-940. |
| [15] | Itasaki N,Bel-Vialar S,Krumlauf R.'Shocking'developments in chick embryology:electroporation and in ovo gene expression[J].Nat Cell Biol,1999,1(8):E203-E207. |
| [16] | Swartz M,Eberhart J,Mastick GS,et al.Sparking new frontiers:using in vivo electroporation for genetic manipulations[J].Dev Biol,2001,233(1):13-21. |
| [17] | Momose T,Tonegawa A,Takeuchi J,et al.Efficient targeting of gene expression in chick embryos by microelectroporation[J].Dev Growth Differ,1999,41(3):335-344. |
| [18] | Wilson NH,Stoeckli ET.In ovo electroporation of miRNAbased plasmids in the developing neural tube and assessment of phenotypes by DiI injection in open-book preparations[J].J Vis Exp,2012,4384(68):1-8. |
| [19] | Hughes SH.The RCAS vector system[J].Folia Biol (Praha),2004,50(3-4):107-119. |
| [20] | Logan M,Tabin C.Targeted gene misexpression in chick limb buds using avian replication-competent retroviruses[J].Methods,1998,14(4):407-420. |
| [21] | Zhu S,Zhu ED,et al.Wdr5 is required for chick skeletal development[J].J Bone Miner Res,2010,25(11):2504-2514. |





