2.中国农业科学院生物技术研究所,北京 100081
2. Biotechnology Research Institute,Chinese Academy of Agriculture of Science,Beijing 100081
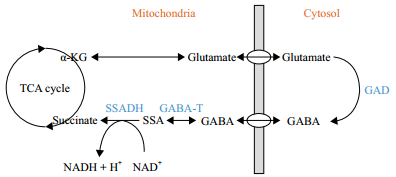
γ-氨基丁酸(γ-aminobutyric acid,GABA)代谢旁路是TCA循环的一个重要的旁路代谢途径,广泛存在于动植物及微生物中;该旁路起始于α-酮戊二酸,α-酮戊二酸经脱羧后转变为谷氨酸;而谷氨酸进入线粒体后在谷氨酸脱羧酶(Glutamic acid decarboxylase,GAD)作用下生成GABA;GABA经γ-氨基丁酸转氨酶(γ-aminobutyric acid transaminase,GABA-T)催化反应生成琥珀酸半醛(Succinic semi-aldehyde,SSA);而琥珀酸半醛在琥珀酸半醛脱氢酶SSADH作用后生成琥珀酸,直接回到TCA循环(图 1)[1, 2, 3, 4]。GABA途径与哺乳动物大脑神经系统功能显著相关[5, 6, 7, 8],该途径也出现在非神经元细胞、植物细胞、简单真核细胞和原核细胞中[9, 10, 11]。植物GABA途径可以增强其对生物和非生物逆境胁迫响应的能力[12]。
琥珀酸半醛脱氢酶(Succinic semialdehyde dehydrogenase,SSADH)是GABA代谢途径中的一个关键酶[10, 13, 14, 15]。目前对于SSADH的研究多集中于拟南芥;研究表明拟南芥SSADH基因对于增强拟南芥响应各种生物和非生物胁迫起着主要的作用。拟南芥SSADH基因的T-DNA插入突变导致植株矮小、叶片坏死以及对热和UV-B敏感并且导致突变体中H2O2的积累;由于突变体表皮毛细胞对光照敏感,所以突变体暴露在高光照条件下,H2O2迅速积累并导致细胞死亡[12, 14, 16, 17, 18];最新的研究表明拟南芥的SSADH基因还与拟南芥叶片的极性发育和伸长有关[19]。因此,有研究认为拟南芥SSADH基因的功能与防御环境胁迫,阻止活性氧自由基的积累有关。在水稻中SSADH(OsALDH5)基因在幼叶、幼根、茎和穗中的表达量低,但是在干旱胁迫下上调表达[20]。
SSADH基因是乙醛脱氢酶(aldehyde dehydro-genase,ALDH)超基因家族中的一员,属于第五亚家族(ALDH5),是一类NAD(P)+依赖的酶类[21, 22, 23, 24, 25];而AMP和ATP是SSADH酶的竞争性抑制剂;AMP和ATP进入反应中与SSADH结合,随即形成复合体,替代了NAD(P)+的位置,从而阻止反应的发生[10, 14, 15, 26]。
甜高粱(Sorghum bicolor L. Moench)是一种耐盐碱、耐贫瘠、耐旱的作物;作为一种常见的C4能源植物,甜高粱具有广阔的应用前景。甜高粱生物产量高,每公顷甜高粱可以获得籽粒2 250-4 500 kg,产糖大约75 t[27];抗逆性强、适应性广,以耐受各种恶劣的气候和土壤环境;用途广且产品多,可用于生产糖浆、粮食、乙醇、饲料以及造纸业,在不同区域和不同条件下可以生产多种产品,实现甜高粱原料的多级利用[28]。高粱本身具有许多优良的抗逆特性,然而GABA途径在高粱的抗逆特性中所发挥的作用还不明确;SSADH这个关键酶所发挥的作用未见报道。因此,本实验通过对甜高粱SbSSADH基因克隆、原核表达并测定其酶活,初步验证甜高粱SSADH蛋白的功能,旨在为甜高粱SbSSADH基因在甜高粱的抗逆研究奠定理论基础。
1 材料与方法 1.1 材料 1.1.1 植物品种甜高粱品种Keller,由本实验室保存,水培发芽。
1.1.2 菌株与载体pEASY-Blunt载体购自Trans Gene公司;pET-28a载体由中国农业科学院生物技术研究所林敏实验室惠赠;TOP10感受态细胞购自康为世纪生物科技有限公司;Rosetta感受态细胞为本实验室保存。
1.1.3 试剂Trizol溶液购自Invitrogen公司;反转录试剂盒购自Thermo Fisher公司;高保真聚合酶KOD plus购自TOYOBO公司;dNTP和限制性内切酶BamH I、Hind Ⅲ、Xba I购自TaKaRa公司;2×Taq Mix购自康为世纪生物科技有限公司;T4 Ligase购自Progema公司;IPTG购自北京普博欣生物科技有限公司;其余常规生化试剂购自国药集团化学试剂有限公司。
1.1.4 引物合成和测序由北京诺赛基因组研究中心公司完成。
1.2 方法 1.2.1 总RNA的提取和cDNA第1链的合成取100 mg甜高粱新鲜叶片液氮中研磨后,采用Trizol法提取总RNA[29]。按照Thermo Fisher公司的反转录试剂盒进行反转录反应;总反应体系20 μL。反应体系及过程:甜高粱总RNA 5 μL,Oligo dT Primer 1 μL、dNTP 1 μL、RNase free ddH2O 5 μL,65℃处理5 min,冰上放置2 min;再向上述体系中依次加入:5×M-MLV Buffer 4 μL、RNase inhibitor 1 μL、dNTP 2 μL、M-MLV 1 μL,42℃处理1 h,70℃处理5 min。反转录产物-20℃保存备用。
1.2.2 全长基因的获得根据从MaizeGDB和Gramene数据库获得的序列信息,以Primer Premier 5.0设计一对引物ssadh 1F和ssadh 1R。ssadh 1F:5'-ATGGCGATGGCGATGATGAC-3';ssadh 1R:5'-TCAACCCAAGTTTCCCATGC-3'。以反转录产物为模板,ssadh1F和ssadh 1R引物扩增获得目的片段;PCR扩增条件:94℃ 2 min;94℃ 15 s,55℃ 30 s,68℃ 2 min,35个循环;68℃ 5 min。PCR产物经电泳回收;连接pEASY-Blunt载体,并命名为SSADH-Blunt载体并测序。
1.2.3 表达载体引物设计及SSADH序列PCR扩增根据获得SSADH基因序列,以信号肽预测网站SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)预测SSADH基因信号肽,信号肽部分198 bp。用Primer Premier 5.0设计一对原核表达载体引物 PeSSADH 1F和PeSSADH 1R,该引物设计未带信号肽。PeSSADH 1F:5'-GGATCCGACGGGAAGA-CCATCGAGGT-3'和PeSSADH 1R 5'-AAGCTTTCAACCCAAGTTTCCCATGC-3',下划线分别为BamHⅠ和Hind Ⅲ酶切位点。以SSADH-Blunt质粒为模板,用引物PeSSADH 1F、PeSSADH 1R扩增PeSSADH基因片段。PCR扩增条件:94℃ 2 min;94℃ 15 s,56℃ 30 s,68℃ 2 min,35个循环;68℃ 5 min。PCR产物经1%琼脂糖凝胶电泳检测后回收目的片段。
1.2.4 原核表达载体pET-28(a)-SSADH的构建用BamHⅠ和Hind Ⅲ双酶切pET-28a vector和PeSSADH PCR扩增产物;双酶切产物经回收后用T4连接酶16℃连接过夜。将连接产物转化TOP10感受态。取200 μL转化菌液涂布于Kan+浓度为50 μg/mL的LB固体培养基上并37℃过夜培养。挑取单菌落进行PCR检测及酶切验证。将验证正确的质粒送测序对测序验证正确的重组质粒转化大肠杆菌Rosetta,并鉴定阳性克隆。
1.2.5 目的蛋白表达、纯化取验证正确的菌株于LB液体培养基中培养,培养至OD600=0.5时加入IPTG(终浓度为0.25 mmol/L)诱导表达8 h。50 mL体系培养菌液并收集表达菌株细胞,以15 mL的PBS缓冲液(含2 mmol/L的PMSF)重悬。然后超声破碎,离心收集上清液和沉淀。通过Ni-NTA柱纯化目的蛋白。用考马斯亮蓝G250测蛋白浓度,-80℃保存蛋白样品。
1.2.6 酶活的测定参考Hillel Fromm等的酶活测定方法,以琥珀酸半醛(SSA)和NADP为反应底物,以100 mmol/L的焦磷酸钾和100 mmol/L的β-巯基乙醇为反应缓冲液。加入酶液测定其10 min内A340nm的吸光度值的变化,并根据吸光度值的变化量计算酶活[26]。酶活计算公式:units/mL enzyme=(△A340nm Test-△A340nm Blank)×3/(6.22×0.1)及units/mg protein=(units/mL enzyme)/(mg protein/ mg enzyme)。
2 结果 2.1 甜高粱SSADH基因片段的获得以甜高粱叶片cDNA为模板,利用引物ssadh 1F和ssadh 1R PCR扩增目的片段,PCR产物大小为1.6 kb左右,符合预期设计片段大小(图 1)。测序结果显示,该片段大小1 584 bp,编码527个氨基酸,同时分析发现,N端有66个氨基酸是线粒体信号肽序列。与其他物种SSADH基因的核酸序列比对结果(图 2)表明,与玉米的SSADH基因相似性为 90.76%-95.33%,与甘蔗的SSADH基因相似性为97.6%,但是不同物种SSADH基因前端的信号肽序列差异较大。
 |
| 图 1 PeSSADH PCR产物电泳检查 |
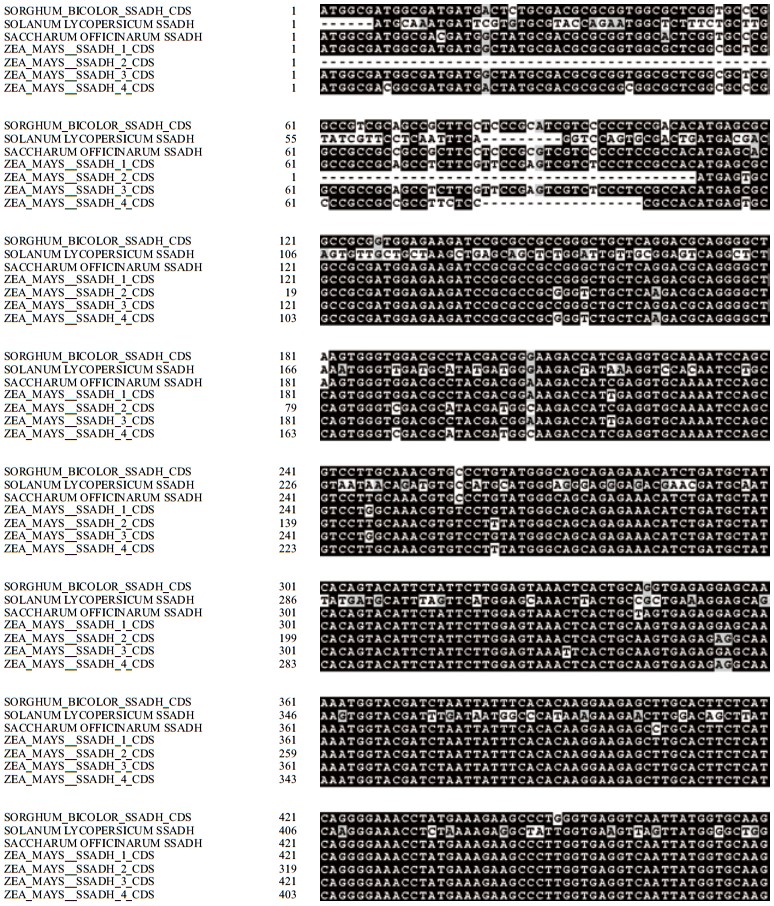 |
| 参比序列:高粱SSADH序列、番茄SSADH序列、甘蔗SSADH序列、玉米SSADH的4个同源序列 图 2 高粱SSADH基因cDNA序列与其他物种序列的比对结果 |
当以全长基因构建至pET-28a时,未诱导出目的蛋白;后将去除信号肽的SbSSADH基因(1 386 bp)连接至原核表达载体pET-28a,构建得到重组表达载体pET-28a-SSADH,质粒鉴定结果(图 3)显示,重组质粒用BamHⅠ和Hind Ⅲ双酶切鉴定,1%琼脂糖凝胶电泳显示可以得到1.4 kb片段。
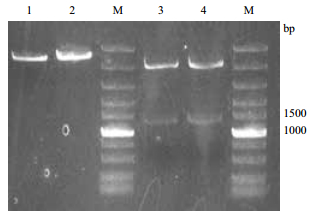 |
| 1:BamHⅠ单酶切;2:Xba Ⅰ 单酶切;M:DNA Marker;3,4:BamHⅠ、Hind Ⅲ双酶切 图 3 重组质粒酶切鉴定图 |
将重组质粒pET-28a-SSADH转化表达菌株Rosetta,经IPTG诱导目的蛋白表达。分别选取IPTG浓度为0.25、0.5、0.75和1 mmol/L四个梯度,诱导时间4、8、16和24 h四个时间点,SDS-PAGE检测目的蛋白的表达,结果(图 4)显示,在0.5 mmol/L的IPTG浓度、24℃诱导8 h的条件下目的蛋白表达达到峰值。
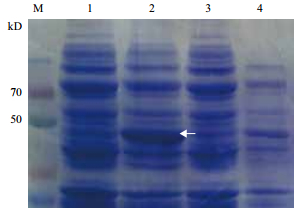 |
| M:蛋白质Marker;1-4:IPTG的浓度分别是0.25、0.5、0.75和1 mmol/L,诱导8 h后蛋白原核表达情况(图中箭头指示的是目的蛋白条带) 图 4 不同浓度IPTG诱导SSADH的表达情况 |
原核表达的蛋白融合了6个组氨酸标签His6,采用Ni-NTA柱亲和层析方法纯化可溶性蛋白中的目标蛋白,经SDS-PAGE检测。如图 4所示,经不同的咪唑洗脱后,在60 mmol/L和100 mmol/L可以获得洗脱的纯化蛋白,SDS-PAGE结果(图 5)显示,纯化的蛋白约在50 kD处,与理论值49.1 kD基本相符。利用考马斯亮蓝G250法测定表达的可溶性蛋白和纯化蛋白的浓度,分别为9.628 mg/mL和1.972 mg/mL。
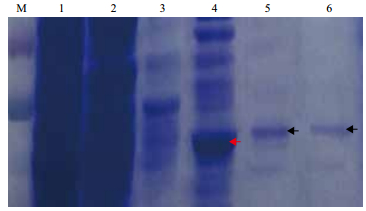 |
| M:蛋白质Marker;1:全菌破碎液:;2:破碎液上清;3:流穿液;4:40 mmol/L咪唑洗脱液;5:60 mmol/L咪唑洗脱液;6:100 mmol/L咪唑洗脱液 图 5 SDS-PAGE检测SSADH蛋白的表达及纯化情况 |
检测可溶性总蛋白和纯化蛋白的酶活,可溶性总蛋白和纯化蛋白均检测到琥珀酸半醛脱氢酶的活性,通过计算可以看出可溶性总蛋白的酶活是0.122 U/mL,根据蛋白浓度计算,酶活为0.013 3 U/mg蛋白;纯化蛋白的酶活是0.083 U/mL,与纯化蛋白的浓度相除,得到酶活为0.042 U/mg蛋白,为了进一步检测测量酶活的准确性,加入酶抑制剂AMP和ATP后琥珀酸半醛脱氢酶的酶活被完全抑制(图 6),进一步证明了纯化蛋白具有琥珀酸半醛脱氢酶的活性。
 |
| 图 6 重组SSADH蛋白酶反应动力学 |
GABA途径是TCA循环的一个重要支路,与动植物的生长发育密切相关。SSADH是其中的一个关键酶,催化琥珀酸半醛SSA形成琥珀酸并进入TCA循环。在动植物中,一旦缺乏SSADH会对生长发育造成很大的影响,研究表明,在小鼠中缺乏SSADH导致产生氧化应激、线粒体病变、低谷胱甘肽水平;而人缺乏SSADH导致智力发育障碍、语言能力低下、癫痫、共济失调、睡眠障碍、精神紊乱[30, 31, 32, 33, 34, 35, 36, 37]。目前,研究植物GABA代谢途径与植物抗逆的关系主要集中在谷氨酸脱羧酶GAD和γ-氨基丁酸转氨酶GABA-T,而对于SSADH与植物抗逆的研究还处于较为基础的阶段。目前关于SSADH的研究较多的是拟南芥;研究表明拟南芥的SSADH基因的T-DNA插入突变体表现为植株矮小、叶片坏死、叶面积指数下降且对热胁迫和UV-B敏感[10, 12, 15]。关于甜高粱SbSSADH基因的研究以及功能解析还未见报道。
本研究从甜高粱品种Keller中克隆得到SSADH基因,序列比对分析表明甜高粱SbSSADH基因与拟南芥、甘蔗、水稻和玉米等基因序列相似度达80%-95%,而截掉信号肽的部分的相似度高达95%,仅有个别碱基的差异,说明SSADH基因在高等植物中还是比较保守的。有文献[4]报道,真核生物蛋白在原核系统中表达时,由于信号肽的存在容易导致原核表达蛋白的失败,所以本实验选择表达的蛋白是去掉信号肽。前期研究表明SSADH蛋白在线粒体中发挥功能,我们根据蛋白结构预测SSADH蛋白的亚细胞定位信号也表明在线粒体中。我们分析了几种植物的信号肽序列,信号肽序列表现出了物种特异性:在单子叶植物中,包括玉米、高粱、甘蔗等的信号肽部分(G+C)的含量达到72.8%,而双子叶植物包括番茄、烟草信号肽部分(G+C)的含量仅有46.5%,明显低于单子叶植物,这种特殊的高(G+C)含量的结构是否与基因功能的发挥有一定的联系,目前还无相关的研究报道,有待进一步的深入研究。
4 结论本研究表达获得的可溶性总蛋白和纯化后的蛋白均表现出琥珀酸半醛脱氢酶的活性,并且纯化后的蛋白活性有大幅度的提高,加入AMP和ATP酶抑制剂后酶活完全被抑制,这与此前关于这一酶类的报道相吻合。
| [1] | Shelp BJ, Bozzo GG, Trobacher CP, et al. Strategies and tools for studying the metabolism and function of γ-aminobutyrate in plants. I. Pathway structure[J]. Botany, 2012, 90(8):651-668. |
| [2] | Van Cauwenberghe OR, Makhmoudova A, Mclean MD, et al. Plant pyruvate-dependent gamma-aminobutyrate transaminase:identification of an Arabidopsis cDNA and its expression in Escherichia coli[J]. Canadian Journal of Botany, 2002, 80(9):933-941. |
| [3] | Akihiro T, Koike S, Tani R, et al. Biochemical mechanism on GABA accumulation during fruit development in tomato[J]. Plant & Cell Physiology, 2008, 49(9):1378-1389. |
| [4] | Shimajiri Y, Ozaki K, Kainou K, et al. Differential subcellular localization, enzymatic properties and expression patterns of gamma-aminobutyric acid transaminases(GABA-Ts)in rice(Oryza sativa)[J]. Journal of Plant Physiology, 2013, 170(2):196-201. |
| [5] | Bouche N, Fromm H. GABA in plants:just a metabolite?[J]. Trends in Plant Science, 2004, 9(3):110-115. |
| [6] | Gibson K, Hoffmann G, Hodson A, et al. 4-Hydroxybutyric acid and the clinical phenotype of succinic semialdehyde dehydrogenase deficiency, an inborn error of GABA metabolism[J]. Neuropediatrics, 1998, 29(1):14-22. |
| [7] | Renault H. Fiat lux! Phylogeny and Bioinformatics shed light on GABA functions in plants[J]. Plantsignaling & Behavior, 2013, 8(6):DOI: 10. 4161/psb. 24274. |
| [8] | Gupta M, Greven R, Jansen EE, et al. Therapeutic intervention in mice deficient for succinate semialdehyde dehydrogenase(γ-hydroxybutyric aciduria)[J]. Journal of Pharmacology and Experimental Therapeutics, 2002, 302(1):180-187. |
| [9] | Lee B, Hong J, Yoo B, et al. Bovine brain succinic semialdehyde dehydrogenase:purification, kinetics and reactivity of lysyl residues connected with catalytic activity[J]. Molecules and Cells, 1995, 5:611-617. |
| [10] | Fait A, YellinN A, Fromm H. GABA shunt deficiencies and accumulation of reactive oxygen intermediates:insight from Arabidopsis mutants[J]. FEBS letters, 2005, 579(2):415-420. |
| [11] | Vergara R, Parada F, Prez FJ. Is GABA-shunt functional in endodormant grapevine buds under respiratory stress?[J]. Plant Growth Regulation, 2013, 71(3):253-260. |
| [12] | Bouche N, Fait A, Bouchez D, et al. Mitochondrial succinic-semialdehyde dehydrogenase of the gamma-aminobutyrate shunt is required to restrict levels of reactive oxygen intermediates in plants[J]. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(11):6843-6848. |
| [13] | Busch K, Piehler J, Fromm H. Plant succinic semialdehyde dehydrogenase:dissection of nucleotide binding by surface plasmon resonance and fluorescence spectroscopy[J]. Biochemistry, 2000, 39(33):10110-10117. |
| [14] | Baek NI, Choi SY, Papk JK, et al. Isolation and identification of succinic semialdehyde dehydrogenase inhibitory compound from the rhizome of Gastrodia elata Blume[J]. Archives of Pharmacal Research, 1999, 22(2):219-224. |
| [15] | Ludewig F, Hser A, Fromm H, et al. Mutants of GABA transaminase(POP2)suppress the severe phenotype of succinic semialdehyde dehydrogenase(ssadh)mutants in Arabidopsis[J]. PLoS One, 2008, 3(10):e3383. |
| [16] | Bouch N, Lacombe BT, Fromm H. GABA signaling:a conserved and ubiquitous mechanism[J]. Trends in Cell Biology, 2003, 13(12):607-610. |
| [17] | Kirch HH, Bartels D, Wei Y, et al. The ALDH gene superfamily of Arabidopsis[J]. Trends in Plant Science, 2004, 9(8):371-377. |
| [18] | Sophos NA, Vasiliou V. Aldehyde dehydrogenase gene superfamily:the 2002 update[J]. Chemico-Biological Interactions, 2003, 143-144:5-22. |
| [19] | Toyokura K, Watanabe K, Oiwaka A, et al. Succinic semialdehyde dehydrogenase is involved in the robust patterning of Arabidopsis leaves along the adaxial-abaxial axis[J]. Plant and Cell Physiology, 2011, 52(8):1340-1353. |
| [20] | Gao C, Han B. Evolutionary and expression study of the aldehyde dehydrogenase(ALDH)gene superfamily in rice(Oryza sativa)[J]. Gene, 2009, 431(1-2):86-94. |
| [21] | Brocker C, Vasiliou M, Carpenter S, et al. Aldehyde dehydrogenase(ALDH)superfamily in plants:gene nomenclature and comparative genomics[J]. Planta, 2013, 237(1):189-210. |
| [22] | Kotchoni SO, Jimenez-lopez JC, Kayode AP, et al. The soybean aldehyde dehydrogenase(ALDH)protein superfamily[J]. Gene, 2012, 495(2):128-133. |
| [23] | Yang SH, Niu XL, Luo D, et al. Functional characterization of an aldehyde dehydrogenase homologue in rice[J]. Journal of Integrative Agriculture, 2012, 11(9):1434-1444. |
| [24] | Zhang Y, Mao L, Wang H, et al. Genome-wide identification and analysis of grape aldehyde dehydrogenase(ALDH)gene superfamily[J]. PLoS One, 2012, 7(2):e32153. |
| [25] | Swenby NP, Picklo MJ. The conserved R166 residue of ALDH5A(succinic semialdehyde dehydrogenase)has multiple functional roles[J]. Chemico-Biological Interactions, 2009, 178(1):70-74. |
| [26] | Busch KB, Fromm H. Plant succinic semialdehyde dehydrogenase. Cloning, purification, localization in mitochondria, and regulation by adenine nucleotides[J]. Plant Physiology, 1999, 121(2):589-598. |
| [27] | 张丽敏, 刘智全, 陈冰嬬, 等. 我国能源甜高粱育种现状及应用前景[J]. 中国农业大学学报, 2012(6):76-82. |
| [28] | 刘公社, 周庆源, 宋松泉, 等. 能源植物甜高粱种质资源和分子生物学研究进展[J]. 植物学报, 2009(3):253-261. |
| [29] | 李淼淼, 南富波, 刘伟, 等. 改良Trizol 法从灌浆期小麦胚乳中提取高质量总RNA的研究[J]. 新疆农业科学, 2013, 50(8):1381-1385. |
| [30] | Gupta M, Greven R, Jansen EE, et al. Therapeutic intervention in mice deficient for succinate semialdehyde dehydrogenase(γ-hydroxybutyric aciduria)[J]. Journal of Pharmacology and Experimental Therapeutics, 2002, 302(1):180-187. |
| [31] | Lin CY, Weng WC, Lee WT. A novel mutation of ALDH5A1 gene associated with succinic semialdehyde dehydrogenase deficiency[J]. Journal of Child Neurology, 2014, 0883073814544365. |
| [32] | Niemi AK, Brown C, Moore T, et al. Evidence of redox imbalance in a patient with succinic semialdehyde dehydrogenase deficiency[J]. Molecular Genetics and Metabolism Reports, 2014, 1:129-132. |
| [33] | 邓小鹿, 尹飞, 向秋莲, 等. 琥珀酸半醛脱氢酶缺陷病[J]. 中国当代儿科杂志, 2011(9):740-742. |
| [34] | 姜淑贞, 舒剑波, 张玉琴, 等. 琥珀酸半醛脱氢酶缺陷病一家系ALDH5A1突变分析:proceedings of the中华医学会第十七次全国儿科学术大会[C]. 郑州, F, 2012. |
| [35] | 舒剑波, 姜淑贞, 孟英韬. 琥珀酸半醛脱氢酶缺陷症研究进展[J]. 继续医学教育, 2014(10):16-20. |
| [36] | 唐荣德. 琥珀酸半醛脱氢酶缺乏:一种先天性γ-氨基丁酸代谢病[J]. 国外医学临床生物化学与检验学分册, 1985(1):38. |
| [37] | 赵小朋, 柳国胜, 宋元宗. 琥珀酸半醛脱氢酶缺陷病一例[J]. 中华儿科杂志, 2003(9):83. |