2.河南牧业经济学院,郑州 450008
2. Henan University of Animal Husbandry and Economy,Zhengzhou 450008
目前,土壤的盐碱化是农业生产面临的一个严重问题,限制着全球农作物的产量,其中20%的灌溉区域和30%的干旱区域都受到土壤盐碱化的威胁[1]。有些植物在适应盐生环境时形成了对Na+的外排和区隔化的调节机理,使细胞质内保持较低的Na+浓度以适应盐生环境对植物生长和发育的影响,土壤中Na+过多会引起植物体内离子不平衡、水分亏缺和离子毒害,并且由于不恰当的灌溉和污水的任意排放盐碱化面积还在不断扩大,临海的耕种土地由于暴雨和风的影响盐碱化的速度更快,因此,剖析植物对高盐的应答机制、提高其抗盐能力在农业生产上有重要的理论和现实意义。植物的抗盐反应受许多基因的调控,是一个复杂的过程,尽管在过去10年间,通过各种筛选和克隆的方法已得到一系列与盐胁迫信号途径相关的基因,例如:SOS、HKT1或NHX1基因等,其中盐过度敏感(Salt overly sensitive,SOS)途径的重要生理功能是在盐胁迫下进行离子稳态调节和提高耐盐性[2, 3],但是仍需要鉴定新的盐胁迫反应基因,以期通过分子生物学手段提高农作物的抗盐能力。
拟南芥的AMP1(Altered meristem program)基因编码一个谷氨酸羧肽酶,定位在内质网膜上,参与一些信号分子的形成过程,AMP1对茎顶端分生组织的生长发育和调控植物激素的稳态方面有重要的作用,还可调节植物体内NO的含量,参与植物的抗旱反应过程[4, 5, 6]。敲除AMP1基因可使突变体中细胞分裂素的含量增加,导致CYCD3;1(cyclin D3)的表达量增加[7, 8, 9],但是,在野生型拟南芥中外施细胞分裂素或者过表达CYCD3;1都不能够模拟amp1突变体的表型,这暗示在amp1突变体中不仅仅是细胞分裂素的含量增加和CYCD3;1的表达量增加,或许是谷氨酸羧肽酶的缺失影响了植物体中一些小的信号分子,它们影响了植物的生长发育[3]。本研究利用拟南芥AMP1基因的缺失突变体,通过对该突变体amp1进行NaCl胁迫,观察植株的表型变化,进而检测其体内可溶性糖与脯氨酸含量、盐胁迫下游基因RD29A的表达量,以及离子含量等,探讨拟南芥AMP1基因在抗盐胁迫方面的生物学作用,旨在为利用生物工程手段提高植物的耐盐性提供基因资源。
1 材料与方法 1.1 材料本实验中所用的野生型拟南芥(Arabidopsis thaliana)和amp1突变体均为Col-0生态型背景。amp1突变体是由Abed Chaudhury博士(Commonwealth Scientific and Industrial Research Organization,Plant Industry,Canberra,Australia)赠送。
1.2 方法 1.2.1 培养方法在营养土中培养拟南芥的过程为:将4℃同步化处理2-3 d后的种子均匀地播种于营养土上,浇上水后移至正常光照下培养。培养皿中无菌培养拟南芥的过程为:要先对种子进行表面消毒,4℃同步化处理2-3 d后,均匀地种在含有0.8%(W/V)琼脂(Sigma)的1/2MS(Murashige and Skoog salts,Sigma M5519)的培养基上,放在培养间中培养。如果是NaCl处理时,把所需量的NaCl加在1/2 MS培养基上,灭菌,制成NaCl培养基,野生型和突变体在正常培养基上生长1周,再移到不同浓度的NaCl培养基上,观察表型。培养间的培养条件:温度为22℃,光照强度为100 μmol· m-2 ·s-1,光周期为16 h光照/8 h黑暗交替。
1.2.2 生理指标的测定两周大的生长在正常培养基上野生型拟南芥和amp1 突变体的幼苗,移到含有100 mmol/L NaCl 的培养基上处理12 h,测定野生型拟南芥和amp1 突变体在NaCl 处理下可溶性糖和脯氨酸的含量。可溶性糖含量测定,称取800 mg拟南芥放于大试管,加20 mL蒸馏水,沸水浴20 min,冷却后过滤至100 ml容量瓶,再加2 mL 5%硫酸锌溶液,2 mL 0.3N Ba(OH)2溶液定容至100 mL。取1 mL提取液加1 mL蒸馏水,加0.5 mL蒽酮-乙酸乙酯,再加5 mL浓H2SO4,沸水10 min后,测定620 nm处的吸光值[10]。脯氨酸含量测定,称取拟南芥约0.15g,加 5 mL 3%磺基水杨酸研磨,再转移至试管中沸水浴浸提10 min,冷至室温。取2 mL提取液,加2 mL 冰乙酸,2 mL 2.5%酸性茚三酮,沸水浴显色 60 min,冷却至室温后加4 mL 甲苯,振荡萃取。取甲苯层测OD520,以甲苯做空白对照[11]。植株TBARS(Thiobarbituric acd-reactive substances)含量的测定按照描述[12, 13]。离子含量的测定是用在1/2MS培养基上生长10 d的野生型和突变体材料,移到含有NaCl的培养基上处理,在指定时间取材,在60℃的烘箱里处理1周使材料干燥。干燥的材料用HNO3消化。再用MS-ICP(Agilent 7500C)测定材料中K+和Na+的含量[14]。
1.2.3 实时荧光定量PCR 对在培养基上生长1周的野生型和amp1突变体材料转移到含有NaCl的培养基上进行盐处理,在相应的时间取材。利用TRIZOL试剂(Sigma,USA)提取总的RNA,用AMV 反转录酶(TaKaLa,Dalian)合成第一条cDNA。利用 Agilent Strata-gene 荧光定量 PCR 仪 Mx3005P(美国)进行实时荧光定量 PCR 实验,荧光染料试剂盒采用 SYBR Premix Ex Taq(TaKaRa,日本),以稀释10倍的植物cNDA为模板。每20 μL PCR 反应体系中含 1×SYBR PremixEx Taq,上下游引物各 0.2 μmol/L,以及 2 μL 稀释的cDNA。实验重复3次。使用 UBQ10(polyubiquitin 10)作为内参对目标基因进行相对定量。
2 结果 2.1 amp1突变体具有强的抗高盐胁迫能力为了验证AMP1基因在抗盐反应中作用,在1/2 MS培养基中加入不同浓度的NaCl,把野生型和amp1突变体种在含有NaCl的培养基上,发现两者的萌发率并没有明显的区别,但是当我们把在1/2 MS培养基上生长1周的野生型和amp1突变体幼苗移到添加有不同浓度NaCl的培养基上后,生长1周后发现野生型根生长受到的抑制程度远比突变体的高。我们在处理后的第7天测量了野生型和突变体的根长,并计算了它们的相对根长(相对根长是处理条件下的根长与在正常培养基上生长1周的根长的比值),发现在正常生长条件下,野生型的根比突变体的长,但是在NaCl的处理下,野生型根生长受到明显的抑制,而突变体的根生长受到的抑制并不明显。例如,在50 mmol/L NaCl处理下,野生型的根被抑制29.6%,而突变体的根只被抑制13.6%(图 1)。另外,我们把含有自身启动子的AMP1基因转入amp1突变体,该突变体即恢复为野生型的表型,这表明amp1突变体的抗盐能力是由于AMP1基因缺失导致的。
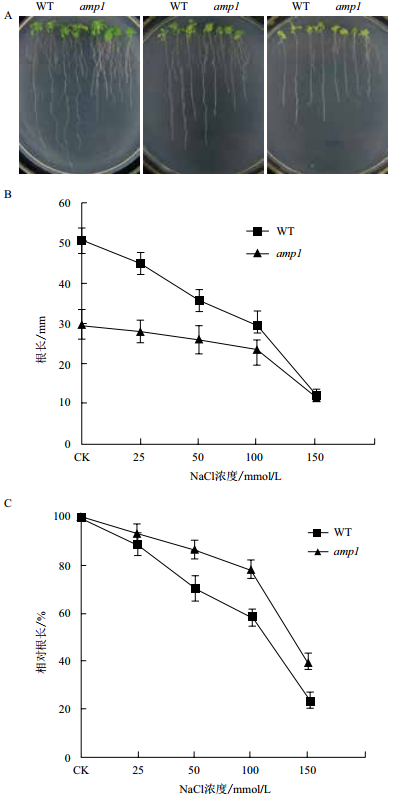 |
| 图 1 amp1突变体在NaCl处理下的表型(A)、根长(B)及相对根长(C) |
高盐环境可以对植物造成渗透胁迫,因此,测定植物体在胁迫条件下可溶性糖和脯氨酸的含量,在一定程度上可以判断植物对高盐胁迫的抵抗能力[15, 16]。图 2显示,正常生长条件下amp1突变体中可溶性糖含量与野生型中的区别并不明显,NaCl处理后amp1突变体和野生型中可溶性糖含量均有所提高,但此时突变体中可溶性糖的含量是野生型的 1.28倍,脯氨酸的含量在正常生长条件下amp1突变体中与野生型中区别并不明显,NaCl处理后amp1突变体和野生型中脯氨酸含量都有所提高,但此时突变体中的脯氨酸是野生型的 1.16倍,因此,在高盐胁迫条件下amp1突变体中可溶性糖和脯氨酸都高于野生型。盐胁迫条件下,amp1突变体中可溶性糖和脯氨酸的快速积累可能与可溶性糖和脯氨酸积累相关基因的表达更活跃有关。基于可溶性糖和脯氨酸在植物抵抗盐胁迫中的特殊作用,amp1突变体中高含量的可溶性糖和脯氨酸是突变体抗高盐胁迫的一个原因。
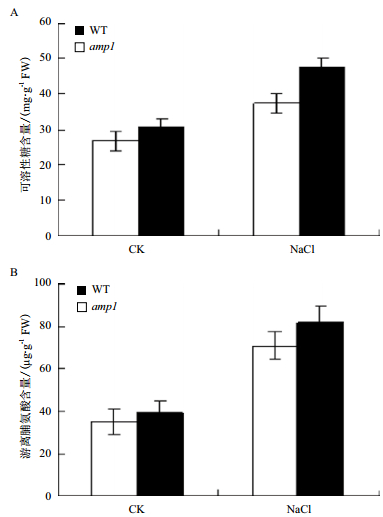 |
| 图 2 野生型拟南芥和amp1突变体在NaCl处理下可溶性糖(A)和脯氨酸(B)的含量 |
为了进一步探讨amp1突变体抗盐的分子机制,选择了一个盐胁迫反应的下游基因RD29A和一个质膜ATP酶[17],对它们的表达量进行分析(图 3)。用实时荧光定量PCR检测表明RD29A的表达量在突变体和野生型中都受高盐胁迫的诱导,但是在突变体中的诱导表达量和时间都明显比野生型的高和早。例如,在高盐处理6 h时,RD29A的表达量在野生型中增至1.3倍,在amp1突变体中增至1.6倍;在高盐处理12 h时,RD29A的表达量在amp1突变体中增至2.3倍,而在野生型中只增至1.5倍。这些结果表明AMP1基因负调控RD29A的表达,导致amp1突变体的强抗盐能力。AHA3是一个质膜ATP酶,定位在质膜上,高盐诱导其表达量的升高,参与Na+的外排过程[18]。我们发现AHA3的表达量在突变体和野生型中都受高盐胁迫的诱导,但是在突变体中的诱导表达量和时间都明显比野生型的高和早。例如,在高盐处理6 h时,AHA3的表达量在野生型中增至1.5倍,在amp1突变体中增至1.8倍;在高盐处理12 h时,AHA3的表达量在amp1突变体中增至2倍,而在野生型中只增至1.7倍。在高盐胁迫条件下离子含量的稳态对植物正常的生长至关重要,我们检测了在高盐胁迫条件下植物体内Na+和K+含量的变化。在正常生长条件下野生型和突变体中的Na+ /K+比率并没有明显的区别,但是在100 mmol/L的NaCl的处理2 d后,amp1突变体中Na+/K+比率明显低于野生型。这些结果表明AMP1负调控AHA3基因的表达,降低突变体中Na+的含量。
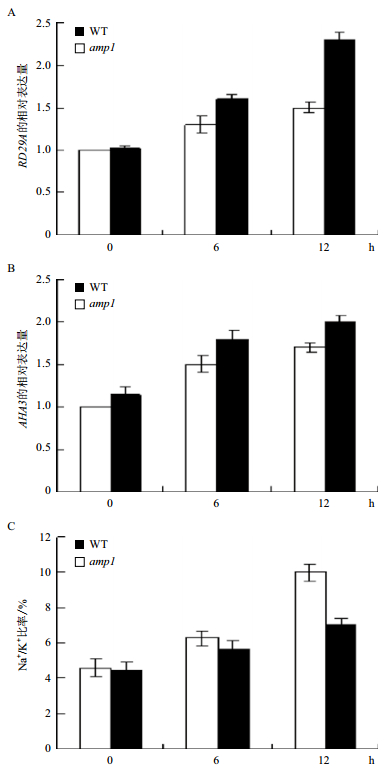 |
| 图 3 野生型拟南芥与amp1突变体在NaCl处理下RD29A(A)、AHA3(B)表达量及Na+/K+比率(C) |
为了验证NaCl胁迫条件下amp1突变体抗氧化能力的强弱,我们检测了在不同条件下野生型和amp1突变体中TBARS的含量(图 4)。实验表明在正常生长条件下amp1突变体中TBARS的含量就比野生型中的区别不明显,NaCl胁迫能使拟南芥植株中TBARS的含量升高,但amp1突变体中TBARS含量远低于野生型的,结果表明amp1突变体中过氧化物的积累比野生型中的少,AMP1参与了植物非生物盐胁迫介导的氧化胁迫应答反应。为了进一步探讨amp1突变体中活性氧积累较少的原因,用实时荧光定量PCR检测了与抗氧化防御系统相关基因表达水平的变化。ZAT10和ZAT12是一类含有C2H2锌指结构的转录因子,参与植物的抗氧化反应过程[20]。我们发现在正常生长条件下,amp1突变体中ZAT10和ZAT12比野生型中的高(图 4),在高盐胁迫条件下,amp1突变体中ZAT10和ZAT12也比野生型中的高。例如,在高盐处理6 h时,ZAT10和ZAT12的表达量在野生型中分别增至1.5和1.2倍,在amp1突变体中分别增至2.1和1.8倍。这些结果表明拟南芥中AMP1通过调节ZAT10/12的表达水平进而调控对NaCl的应答反应。
 |
| 图 4 野生型拟南芥与amp1突变体在NaCl处理下TBARS含量(A)、ZAT10(B)及ZAT12(C)表达量 |
在世界范围内,高盐是一种非常重要的环境胁迫因子,它限制农作物产量,影响植物的生长和发育。高盐不仅能对细胞产生毒害,影响植物体的离子平衡,还可以造成氧化和渗透胁迫[21]。为了克服这种限制因素,提高农作物的产量,研究植物的抗盐反应机制显得至关重要,因此鉴定新的抗盐胁迫相关基因对通过分子生物学手段提高植物的抗盐能力至关重要,本研究第一次发现了AMP1基因在拟南芥的抗盐过程中起着重要的负调控作用。
研究证明,在逆境条件下包括高盐胁迫植物会积累一些渗透调节物质,如可溶性糖和脯氨酸,用于平衡渗透压对胞质的损伤,调节细胞膜的稳定性[22, 23, 24]。我们发现在高盐胁迫下amp1突变体积累可溶性糖和脯氨酸的含量高于野生型,这些降低了突变体细胞的水势,对抗高盐条件下形成的渗透胁迫对植物的损伤。许多非生物胁迫可以诱导过氧化物的产生,对植物体造成氧化胁迫,损伤DNA和蛋白质分子,抑制植物正常的生长和发育[25]。在植物的抗氧化反应过程中ZAT10/12扮演着重要的作用,可诱导cAPX1、cAPX2和FDS1的表达,参与植物的抗盐反应过程,抑制过氧化物对植物产生的毒害[26]。TBARS的分析结果表明在盐胁迫下amp1突变体中积累了较少的ROS,可能是由于ZAT10/12在amp1突变体中的高表达,提高了amp1突变体的抗盐能力。有研究表明在植物体中过表达ZAT10能够提高抗盐能力[26]。在高盐胁迫条件下,除了降低植物体内过氧化物的水平,保持植物体内离子的稳态对植物的抗盐能力也是至关重要的,植物可以通过提高Na+的外排和向液泡的运输两个途径降低Na+对植物的毒害。我们的结果证明AMP1的缺失能够促进Na+的外排,AMP1负调控AHA3基因的表达,降低突变体中Na+的含量。以上的结果表明在拟南芥中AMP1介导了抗盐胁迫的信号传导过程,AMP1缺失调控了抗盐基因的表达,积累了较多的可溶性糖和脯氨酸,还调控了抗氧化基因和下游基因RD29A、AHA3的高表达,降低Na+的含量,提高突变体的抗盐能力。
4 结论本研究证明AMP1参与了拟南芥抗高盐胁迫的反应过程,其缺失突变体amp1强的抗高盐胁迫能力与其ZAT10/12介导的抗氧化防御能力和维持植物体内Na+的平衡能力正相关。另外,amp1突变体体内高含量的可溶性糖和脯氨酸也增强了其抗高盐胁迫的能力。
本研究发现AMP1在拟南芥的盐胁迫反应过程中起到一个负调控作用。amp1突变体对盐胁迫不敏感的机制与以下三方面有关:(1)在盐胁迫下amp1突变体中可溶性糖类和脯氨酸的含量升高,降低细胞的渗透势对抗高盐引起的渗透胁迫;(2)在盐胁迫下amp1突变体中RD29A以及AHA3的高表达,后者可促进Na+的外排;(3)amp1突变体在盐胁迫下的过氧化物的积累少,降低氧化胁迫对细胞的损伤。这些都提高了突变体的抗盐能力。
| [1] | Munns R. Comparative physiology of salt and water stress[J]. Plant Cell Environ, 2002, 25(2):239-250. |
| [2] | Zhuang JL, Shi H. Physiological and molecular mechanism of plant salt tolerance[J]. Photosynth Res, 2013, 115:1-22. |
| [3] | Zhang X, Lu G, Long W, et al. Recent progress in drought and salt tolerance studies in Brassica crops[J]. Breed Sci, 2014, 64(1):60-73. |
| [4] | Liu WZ, Kong DD, Gu XX, et al. Cytokinins can act as suppressors of nitric oxide in Arabidopsis[J]. Proc Natl Acad Sci U S A, 2013, 110(4):1548-1553. |
| [5] | Shi Y, Wang Z, Meng P, et al. The glutamate carboxypeptidase AMP1 mediates abscisic acid and abiotic stress responses in Arabidopsis[J]. New Phytol, 2013, 199(1):135-150. |
| [6] | Chaudhury AM, Letham S, Craig S, et al. amp1—a mutant with high cytokinin levels and altered embryonic pattern, faster vegetative growth, constitutive photomorphogenesis and precocious flowering[J]. Plant J, 1993, 4:907-916. |
| [7] | Chin-Atkins AN, Craig S, Hocart CH, et al. Increased endogenous cytokinin in the Arabidopsis amp1 mutant corresponds with de-etiolation responses[J]. Planta, 1996, 198(4):549-556. |
| [8] | Nogué F, Grandjean O, Craig S, et al. Higher levels of cell proliferation rate and cyclin CycD3 expression in the Arabidopsis amp1 mutant[J]. Plant Growth Regul, 2000, 32(2-3):275-283. |
| [9] | Ariel F, Brault-Hernandez M, Laffont C, et al. Two direct targets of cytokinin signaling regulate symbiotic nodulation in Medicago truncatula[J]. Plant Cell, 2012, 24:3838-3852. |
| [10] | Ristic Z, Ashworth EN. Ultrastructural evidence that intracellular ice formation and possibly cavitation are the sources of freezing injury in supercooling wood tissue of Cornus florida L[J]. Plant Physiol, 1993, 103:753-761. |
| [11] | Shi HT, Ye TT, Chen FF, et al. Manipulation of arginase expression modulate abiotic stress tolerance in Arabidopsis:effent on arginine metabolism and ROS accumulation[J]. L Exp Bot, 2013, 64:1367-1397. |
| [12] | Han Y, Zhang J, Chen X, et al. Carbon monoxide alleviates cadmium-induced oxidative damage by modulating glutathione metabolism in the roots of edicagosativa[J]. New Phytol, 2008, 177:155-166. |
| [13] | Xie Y, Ling T, Han Y, et al. Carbon monoxide enhances salt tolerance by nitric oxide-mediated maintenance of ion homeostasis and up-regulation of antioxidant defence in wheat seedling roots[J]. Plant Cell Environ, 2008, 31:1864-1881. |
| [14] | Shi H, Xiong L, Stevenson B, et al. The Arabidopsis salt overly sensitive 4 mutants uncover a critical role for vitamin B6 in plant salt tolerance[J]. The Plant Cell, 2002, 14:575-588. |
| [15] | Han Y, Zhang J, Chen X, et al. Carbon monoxide alleviates cadmium-induced oxidative damage by modulating glutathione metabolism in the roots of Medicago sativa[J]. New Phytol, 2008, 177:155-166. |
| [16] | Lv WT, Lin B, Zhang M, et al. Proline accumulation is inhibitory to Arabidopsis seedlings during heat stress[J]. Plant Physiol, 2011, 156:1921-1933. |
| [17] | Kim K, Jang YJ, Lee SM, et al. Alleviation of salt stress by enterobacter sp. EJ01 in tomato and arabidopsis is accompanied by up-regulation of conserved salinity responsive factors in plants[J]. Mol Cells, 2014, 37(2):109-117. |
| [18] | Visnovitz T, Solti A, Csikó G, et al. Plasma membrane H+-ATPase gene expression, protein level and activity in growing and non-growing regions of barley(Hordeum vulgare)leaves[J]. Physiol Plant, 2012, 144:382-393. |
| [19] | Suzuki N, Koussevitzky S, Mittler R, et al. ROS and redox signalling in the response of plants to abiotic stress[J]. Plant, Cell & Environment, 2012, 35:259-270. |
| [20] | Mittler R, Kim Y, Song L, et al. Gain- and loss-of-function mutations in Zat10 enhance the tolerance of plants to abiotic stress[J]. FEBS Lett, 2006, 580:6537-6542. |
| [21] | Zhu JK. Plant salt tolerance[J]. Trends Plant Sci, 2001, 6, 66-71. |
| [22] | Zhang S, Qi Y, Liu M, et al. SUMOE3 ligase AtMMS21 regulates drought tolerance in Arabidopsis thaliana[J]. J Integr Plant Biol, 2013, 55:83-95. |
| [23] | Shi HT, Li RJ, Cai W, et al. Increasing nitric oxide content in Arabidopsis thaliana by expressing rat neuronal nitric oxide synthase resulted in enhanced stress tolerance[J]. Plant Cell Physiol, 2012, 53:344-357. |
| [24] | Shi HT, Ye TT, Chen FF, et al. Manipulation of arginase expression modulate abiotic stress tolerance in Arabidopsis:effect on arginine metabolism and ROS accumulation[J], J Exp Bot, 2013, 64:1367-1379. |
| [25] | Asada K. Production and scavenging of reactive oxygen species in chloroplasts and their functions[J]. Plant Physiol, 2006, 141:391-396. |
| [26] | Miller G, Shulaev V, Mittler R. Reactive oxygen signaling and abiotic stress[J]. Physiol Plant, 2008, 133:481-489. |



