宽叶缬草(Valeriana officinalis L.var. latifolia Miq)是败酱科(Valerianaceae)缬草属(Valeriana Linn)植物,具有安心神、祛风湿、行气血、止痛的功效,主治心神不安、心悸失眠、血狂、脏躁、风湿痹痛、脘腹胀痛、痛经、经闭、跌打损伤等作用[1, 2]。贵州地区山多,气候温和,山阴多潮湿,具有得天独厚的区域优势和自然条件,是缬草生长最好的地理环境[3]。贵州缬草产业的主打产品就是缬草油,宽叶缬草油利用价值高,用途广,国外已有大面积栽培宽叶缬草[4, 5]。近年来,由于野生宽叶缬草供不应求,引种栽培成为市场上宽叶缬草的主要来源之一,但是,贵州缬草自人工栽培以来,普遍存在品种退化、产油率降低的问题。在前期的黔产宽叶缬草RAPD遗传多样性的分析研究中,发现贵州省不同地域栽培的宽叶缬草与野生宽叶缬草基因组DNA之间具有明显的差异,统计分析也表明黔产宽叶缬草的变异与地域有关,地域差异和生长环境的不同,可能导致栽培宽叶缬草的遗传信息发生了改变,最终导致其基因变异。
反向简单重复序列区间多态性分子标记(Inter-simple sequence repeat,ISSR)是一种在微卫星技术基础上创建起来的简单序列重复区间扩增多态性DNA分子标记[6]。ISSR分子标记产物的多态性远比SSR、RFLP、RAPD丰富,可以提供更加丰富的基因组信息,且精确度高、检测非常方便、所需DNA模板的量少、操作简单、稳定性较高等优点,被广泛适用于不同物种遗传多样性与亲缘关系的研究[7, 8]。为了保证引种栽培宽叶缬草的最佳质量,探讨其不同产地栽培与野生宽叶缬草遗传相似性,为宽叶缬草资源开发和人工种植提供有参考价值的实验依据,本研究就ISSR分子标记的反应体系进行优化与分析,旨在找到最佳适用于黔产宽叶缬草的ISSR反应体系,为分析黔产宽叶缬草种质资源的遗传多样性和亲缘关系奠定基础。
1 材料与方法 1.1 材料试验所用宽叶缬草由贵州省江口苗药生物科技有限公司提供,经贵阳医学院覃容贵教授鉴定为败酱科缬草属植物宽叶缬草。
DNAsecure新型植物基因组DNA提取试剂盒、DNA Marker DL2000,北京天根生化科技有限公司提供;Taq DNA聚合酶、dNTPs、Mg2+、GoldViewⅠ核酸染色剂、50×TAE缓冲液等,北京索莱宝公司提供;ISSR引物参照加拿大哥伦比亚大学(UBC)公布的引物序列,上海生工合成。
DYY-6C电泳仪,北京市六一仪器厂;BIOMATE 3S核酸蛋白分析仪,美国thermo Fisher Scientific;S1000PCR扩增仪,美国BIO-RAD;凝胶成像仪,香港Gene Company Limited。
1.2 方法 1.2.1 基因组DNA的提取及检测以宽叶缬草嫩叶为材料,采用试剂盒法提取基因组DNA;核酸蛋白分析仪检测纯度及浓度;0.8%琼脂糖电泳检测完整性;提取原液-20℃保存,用于PCR反应体系的优化试验。
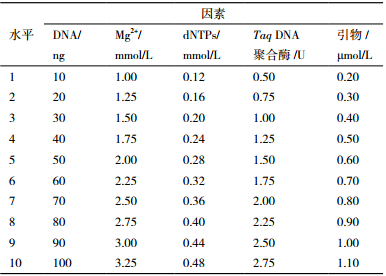
1.2.2 单因素试验参考相关文献[9, 10],确定宽叶缬草初始ISSR反应体系:总体积25 μL,包含2.5 μL 10×Taq Buffer,1.5 mmol/L Mg2+,0.24 mmol/L dNTPs,0.5 μmol/L引物,1.25U Taq DNA聚合酶,60 ng DNA 模板,ddH2O补齐;单因素试验时,采用变化单一因素,其他因素不变的方法,以确定该因素对ISSR结果的影响[11],每个因素设置10个梯度浓度水平,见表 1。PCR反应程序:94℃预变性5 min;然后按94℃变性30 s,55.6℃退火45 s,72℃延伸1.5 min,进行35个循环;最后72℃延伸10 min;4℃保存。选择预试验中扩增效果较好的引物UBC807,对宽叶缬草基因组 DNA 进行ISSR扩增,PCR产物于1.8%琼脂糖凝胶上,100 V恒压电泳1 h,凝胶成像系统观察并拍照。
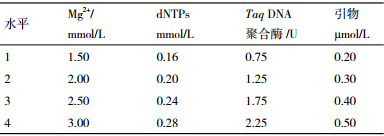
根据单因素试验结果,确定因素Mg2+、dNTPs、引物、Taq DNA聚合酶为正交试验因子,并选择各因素有效的扩增范围,采用L16(45)正交试验设计,以直观法、极差法及方差法相结合的统计分析方式(表 2)考察各因素间的相互作用对反应体系的影响,确定宽叶缬草最佳ISSR反应体系。反应体系与扩增程序沿用单因素试验所用条件。
以最佳ISSR反应体系,引物Tm±5℃的梯度扩增模式[12],自动生成以引物Tm值为中心的10个梯度退火温度,从中确定最佳退火温度。在对引物退火温度筛选的同时,从50条候选ISSR引物中筛选出稳定的、多态性好的宽叶缬草ISSR引物。
1.2.5 反应体系稳定性检测以最佳ISSR反应体系为基础,采用UBC807引物对9份不同地区的宽叶缬草样品进行扩增,检测反应体系的稳定性。
2 结果 2.1 基因组DNA的质量检测核酸蛋白分析仪检测所提宽叶缬草基因组DNA,OD260/280比值在1.70-1.90之间,纯度较好,浓度在50.00-85.00 μg/mL之间;琼脂糖电泳检测结果(图 1)显示,DNA的主带清晰明亮,无降解现象,点样孔无杂质,即基因组DNA的完整性较好。结果说明所提样本DNA可用于ISSR体系的构建及后续的试验。
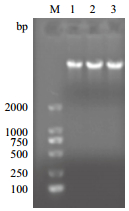 |
| 图 1 DNA检测电泳图 |
模板DNA的浓度设置在10-100 ng/25 μL,共10个梯度,从图 2可观察,所扩增出的条带在清晰度与条带数上达到一致,并无明显的变化,即模板DNA的浓度在10-100 ng/25 μL之间时,对宽叶缬草ISSR反应体系无明显影响,故DNA模版浓度的大小在正交试验中不予作为考察对象。
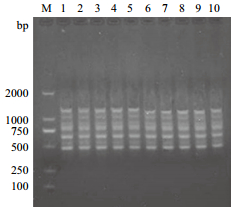 |
| 图 2 DNA浓度对ISSR反应体系的影响 |
由图 3可知,在Mg2+浓度小于1.75 mmol/L时,所扩增的条带数较少;Mg2+浓度在1.75-2.5 mmol/L时,大部分扩增条带稳定、清晰、明亮;在Mg2+浓度大于2.75 mmol/L时,扩增条带变少,且不稳定,不清晰。Mg2+作为ISSR反应中的一个主要因素,不仅会影响Taq DNA聚合酶的活性,还能与反应体系中的dNTPs、模板DNA及引物结合,影响引物与模板的结合率,同时Mg2+浓度太高或太低都可能导致扩增不完全或无扩增。由结果可知,宽叶缬草ISSR反应体系中Mg2+的浓度在1.75-2.5 mmol/L时为最佳扩增浓度范围。
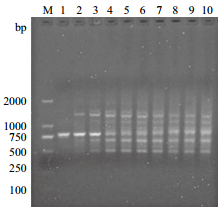 |
| 图 3 Mg2+浓度对ISSR反应体系的影响 |
对dNTPs的10个不同浓度分别进行了PCR扩增,如图 4所示,dNTPs在低浓度为0.12、0.16 mmol/L时,PCR的产率低,条带亮度不足;而dNTPs的浓度在0.20-0.28 mmol/L时,条带明亮,清晰且稳定;当dNTPs的浓度较高为0.32-0.48 mmol/L时,未得到有效扩增,条带少,甚至无条带。dNTPs是ISSR扩增的原料,其浓度直接影响扩增产物的生成,dNTPs浓度不足时,DNA合成速率低,dNTPs过早耗尽而使产物单链化,扩增效果差;dNTPs浓度过高时,容易与Mg2+结合而降低游离Mg2+浓度,从而影响Taq DNA聚合酶的活性。dNTPs的浓度过低或过高都不能得到有效的扩增。因此,dNTPs的浓度在0.20-0.28 mmol/L为宽叶缬草ISSR反应的有效扩增浓度。
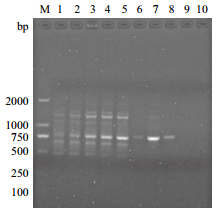 |
| 图 4 dNTP浓度对ISSR反应体系的影响 |
对ISSR的Taq DNA聚合酶浓度这一单因子进行试验,结果(图 5)显示,当Taq DNA聚合酶的浓度在0.5 U/25 μL时,扩增出的条带弱且少;当浓度为0.75-1.750 U时,扩增条带数增加,条带清晰;Taq DNA聚合酶的浓度继续增大时,扩增条带变得模糊,不易区分。Taq DNA聚合酶是ISSR反应的关键因素,用量过多时会引起非特异性扩增,有时甚至会出现比较重的背景,影响扩增结果,用量过少导致扩增产物减少;同时,它还受Mg2+浓度及dNTPs浓度大小的综合影响。故本试验将0.75-1.750 U/25 μL Taq DNA聚合酶浓度定为宽叶缬草ISSR反应体系的有效扩增浓度。
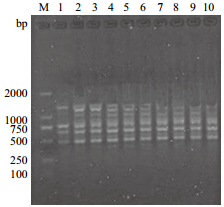 |
| 图 5 Taq DNA聚合酶浓度对ISSR反应体系的影响 |
由图 6可知,当引物浓度为0.20-0.40 μmol/L间时,为有效扩增,扩增条带多且清晰,反之,当引物浓度过高时,扩增条带不稳定,条带变模糊。实验在确保PCR产率的前提下,确定较低引物浓度0.20-0.40 μmol/L为有效扩增引物浓度,其结果稳定,重现性较好。
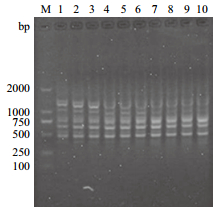 |
| 图 6 引物浓度对ISSR反应体系的影响 |
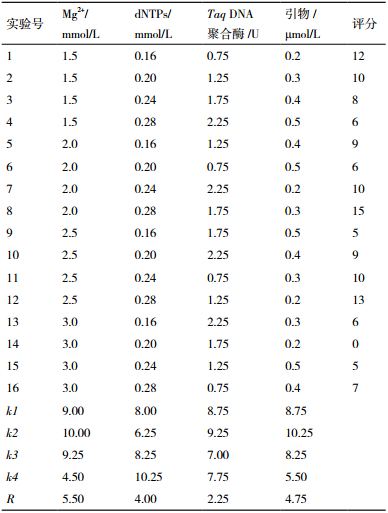
根据5因素4水平正交设计,共有16个试验组合,PCR扩增结果见图 3,16个组合间存在明显差异,14号组合效果最差,没有扩增出条带;6号、9号和15号组合扩增出少量条带,但部分条带带型不完整,不易识别,清晰度差;2号,3号、4号、5号、7号、10号、11号、13号以及16号组合扩增条带数相对多,但条带清晰度不高,其中2号、7号和13号组合的背景弥散严重;1号、8号和12号组合扩增效果相近,扩增出的条带数最多,清晰,宜于区分,但又以8号组合效果最好,条带较其余组合明亮。综合以上分析,确定选用8号为最佳组合,即25 μL总体积,包含2.5 μL 10×Taq Buffer,2.0 mmol/L Mg2+,0.28 mmol/L dNTPs,1.75 U Taq DNA聚合酶,0.3 μmol/L引物,60 ng DNA 模板,ddH2O补齐。
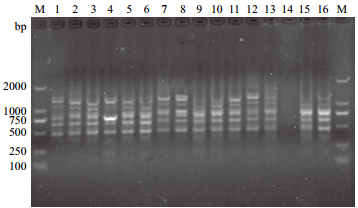 |
| 图 7 正交试验PCR扩增结果 |
在对L16(45)正交试验的16个组合进行直观观察时,并根据扩增条带的多少及强弱、清晰度及背景强度4个指标进行计分,每项4分共计16分。对统计结果进行极差分析,极差用R值表示,R值越大,反应因素对体系的影响就越大。根据表 3的R值判断4个因素对黔产宽叶缬草ISSR反应体系的影响大小顺序为:Mg2+ >引物>dNTPs>Taq DNA聚合酶;最佳因素水平组合为:Mg2+ k2(2.0 mmol/L)、dNTPs k4(0.28 mmol/L)、Taq DNA聚合酶k2(1.25 U)、引物k2(0.3 μmol/L)。
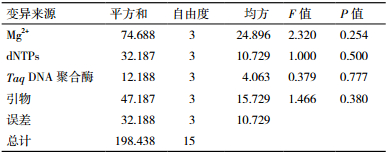
实验数据用SPSS17.0进行方差分析,表 4所示,由F值大小可知影响宽叶缬草ISSR反应体系的大小次序为:Mg2+ >引物>dNTPs>Taq DNA聚合酶,与极差分析的结果相一致,其中Taq DNA聚合酶的浓度大小对反应体系的影响最小。在α=0.05水平各因素水平间的差异对扩增结果没有达到显著水平。
综合直观分析、极差分析与方差分析的结果,确定宽叶缬草ISSR最佳反应体系组合为正交试验8号:2.0 mmol/L Mg2+,0.28 mmol/L dNTPs,0.3 μmol/L引物,1.75 U Taq DNA聚合酶。
2.4 退火温度及引物的筛选50个候选ISSR引物以10个梯度Tm±5℃退火温度进行扩增。结果(表 5)表明,不同退火温度的扩增带型间具有差异,选择重复性好、扩增条带清晰的退火温度为最佳退火温度。
通过对9份不同产地宽叶缬草样品进行扩增,结果(图 8)显示,9份样品均得到有效扩增,扩增所得条带清晰,即所建立的黔产宽叶缬草ISSR反应体系稳定。
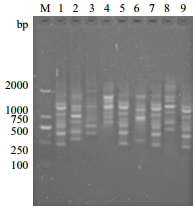 |
| 图 8 9份不同产地宽叶缬草样品扩增结果 |
ISSR分子标记技术建立在PCR的基础上,受模板DNA、Taq DNA 聚合酶、引物、Mg2+和dNTPs5个因素的影响[13, 14]。任伟等[11]通过单因素试验确定了朝鲜碱茅的最佳ISSR扩增反应体系,但ISSR反应体系是一个因素间相互效应的组合,仅通过单因素试验直观确定最佳反应体系,具有一定的不稳定性。包蕊等[15]、欧立军等[16]、代文娟等[17]利用正交设计分别确定了华扁穗草、天门冬及广西火桐的ISSR最佳反应体系,正交设计可以使各因素快速的组合,确定最佳反应体系,但在因素水平的选取上存在一定的不确定性。本研究采用单因素试验,首先确定各个因素的有效扩增浓度范围,再通过正交试验确定因素最佳水平组合,这种单因素试验与正交试验相结合的方法,不仅可以克服正交试验因素水平的难以确定问题,还可以避免单因素试验顾此失彼的缺点,明确、均衡、综合性的确定各个试验因素,以最有效的方式在最短的时间内找到最优的试验水平组合。目前,两面针[14]、锁阳[18]、阳春砂[19]等多种药用植物利用单因素与正交设计相结合的方法,优化得到准确稳定的ISSR反应体系。
本次实验中,尽管正交设计的各因素的水平都是基于单因素的有效扩增浓度范围内,但不同的组合对宽叶缬草的ISSR扩增结果影响也是比较大的,通过对扩增谱图的直观分析以及统计学的极差分析与方差分析,使分析结果相对以往的PCR反应体系优化更科学、完善。极差分析中所确立的最佳ISSR反应体系组合,与直观分析中所确立的最佳水平组合仅Taq DNA聚合酶的浓度不一致,但极差分析与方差分析的结果显示,Taq DNA聚合酶浓度并不是反应体系的主要影响因素。方差分析结果显示,各个影响因素的P值都大于0.05,说明各影响因素在水平范围内对反应体系都存在不显著影响,这可能是因为通过单因素试验确立了各因素有效扩增的浓度范围的原因。
ISSR分子标记适用于物种的遗传多样性分析,但不同的物种其ISSR体系也有一定的差异。单因素试验结果表明,模板DNA浓度大小对黔产宽叶缬草ISSR的扩增影响不明显,DNA的浓度对扩增的效果不显著,这与吴鸣谦[20]建立的拟茎点霉最佳ISSR反应体系的结论相似。本研究同时也发现,黔产宽叶缬草ISSR扩增的因素影响大小依次是:Mg2+ >引物>dNTPs>Taq DNA聚合酶,而在节瓜[9]的ISSR体系研究中,认为因素dNTPs是影响最大的因子;而薰衣草[21]的ISSR优化体系的相对影响程度从大到小依次为:Mg2+、dNTPs、引物和 DNA 浓度。基于研究结果,表明优化黔产宽叶缬草的ISSR反应体系是十分必要的,不仅建立了专属于黔产宽叶缬草ISSR反应体系,同时也为同种、其他来源的宽叶缬草的相关研究提供实验依据。
在进行某物种的ISSR分子标记研究时,一个稳定、有效的扩增体系是基础,而适合该物种的ISSR引物就是研究的前提[16, 22]。在筛选引物的工作中,退火温度能明显地影响扩增条带的特异性[23],甚至是条带的有无,不同引物有着各自的退火温度,因此,对不同引物退火温度的优化筛选是一项非常必要的工作,也是引物筛选的必要前提。本研究以优化的最佳ISSR反应体系对50条候选引物的退火温度进行一一筛选,以确保每一条引物扩增条带稳定,重现性好并且清晰,同时通过ISSR体系的验证试验,为应用ISSR分子标记技术进行黔产宽叶缬草的遗传多样性研究奠定技术基础。
4 结论在单因素实验中,确立了模板DNA、Mg2+、dNTPs、引物、Taq DNA聚合酶这5个主要影响黔产宽叶缬草ISSR扩增的有效浓度范围,并在此基础上通过正交设计实验得到适合宽叶缬草的ISSR反应体系:总体积25 μL,包含2.5 μL 10×Taq Buffer,2.0 mmol/L Mg2+,0.28 mmol/L dNTPs,0.3 μmol/L引物,1.75 U Taq DNA聚合酶,60 ng DNA 模板,ddH2O补齐。所建立的ISSR反应体系适用于黔产宽叶缬草的ISSR扩增。
| [1] | 段雪云, 方颖, 周颖, 等. 缬草属植物综合研究概况[J]. 中国药师, 2008, 11(7):793-796. |
| [2] | 王有为, 陈倩. 中国宽叶缬草药用功效研究概况[J]. 亚太传统医药, 2005(3):69-71. |
| [3] | 孙庆文, 罗迎春. 贵州民族常用天然药物. 第1卷[M]. 贵阳:贵州科技出版社, 2013:217-218. |
| [4] | 王立群, 熊义涛, 陶福华, 等. 宽叶缬草挥发油成分分析[J]. 中药材, 1999, 22(6):298-299. |
| [5] | 陈建华, 申会建, 聂长明, 等. 宽叶缬草[J]. 中国林副特产, 1993, 1(24):43-44. |
| [6] | 李晓伟, 李震宇, 何盼, 等. 基于正交设计优化款冬花反向简单重复序列区间多态性分子标记(ISSR)反应体系[J]. 中国药学杂志, 2013, 48(24):2107-2112. |
| [7] | 任风呜, 胡开治, 刘燕琴, 等. 传统中药金钱草ISSR-PCR反应体系的正交优化研究[J]. 中国中药杂志, 2014, 39(12):2233-2238. |
| [8] | 李言, 崔翠菊, 罗世菊, 等. 海带属配子体DNA提取及ISSR-PCR体系优化[J]. 农学学报, 2014, 4(11):80-84. |
| [9] | 赵芹, 谢大森, 罗少波, 等. 节瓜ISSR-PCR反应体系的建立与正交优化[J]. 生物技术通报, 2014(9):89-96. |
| [10] | 史艳财, 邹蓉, 孔德鑫, 等. 战骨 ISSR-PCR反应条件的筛选与优化[J]. 种子, 2011, 30(7):31-34. |
| [11] | 任伟, 徐安凯, 徐博, 等. 朝鲜碱茅ISSR-PCR反应体系的建立与优化[J]. 生物技术通报, 2012(6):59-65. |
| [12] | 李胡, 周天华, 赵桦. 开口箭ISSR-PCR实验反应体系条件的优化[J]. 中国实验方剂学杂志, 2013, 19(13):149-153. |
| [13] | 原晓龙, 周军, 陶磅, 等. 草莓ISSR-PCR体系的建立和优化[J]. 西南农业学报, 2014, 27(5):2106-2110. |
| [14] | 张蕾, 严萍, 韩正洲, 等. 两面针ISSR-PCR反应体系的建立及优化[J]. 广州中医药大学学报, 2012, 29(1):70-74. |
| [15] | 包蕊, 胡延萍, 王莉, 等. 华扁穗草ISSR-PCR反应体系优化及引物筛选[J]. 中国草地学报, 2014, 36(6):46-52. |
| [16] | 欧立军, 颜旺, 廖亚西, 等. 天门冬ISSR分子标记技术的建立与体系优化[J]. 中草药, 2011, 42(2):353-357. |
| [17] | 代文娟, 骆文华, 马虎生, 等. 正交设计优化广西火桐 ISSR-PCR 反应体系[J]. 生物技术通报, 2013(8):76-82. |
| [18] | 李伟, 刘广达, 陈青, 等. 锁阳ISSR-PCR 反应体系的优化研究[J]. 生物技术通报, 2012(8):135-140. |
| [19] | 黄琼林, 杨锦芬, 严萍, 等. 阳春砂ISSR-PCR反应体系的建立和优化[J]. 时珍国医国药, 2010, 21(10):2478-2480. |
| [20] | 吴鸣谦, 闫淑珍, 陈双林. 拟茎点霉 ISSR-PCR 反应体系的优化[J]. 生物技术通报, 2012(3):123-127. |
| [21] | 权俊萍, 贾晓鹰, 戴丽娜, 等. 薰衣草高质量DNA提取及ISSR-PCR多重化体系的建立[J]. 生物技术通报, 2012(5):151-157. |
| [22] | 张香东, 刘庚, 常素慧, 等. 水蛭ISSR-PCR反应体系的建立及优化[J]. 中草药, 2013, 44(2):215-218. |
| [23] | 徐婧, 万定荣, 杨光忠. 阔叶十大功劳ISSR-PCR反应体系的建立与优化[J]. 华中师范大学学报:自然科学版, 2012, 46(2):184-189. |