2.贵州烟叶复烤有限责任公司铜仁复烤厂,铜仁 554300
2. Tongren Factory of Guizhou Tobacco Leaf Redrying Co.,Ltd,Tongren 554300
烟草制品作为特殊消费品,公众对转基因烟草比其他转基因作物更加敏感,烟草作为转基因研究的模式植物,国内外很多科研单位已成功培育抗虫、抗病等多种表现优异的转基因烟草[1],这些实验材料一旦发生不规范释放和利用,将对消费者利益和我国烟草制品的国际形象造成重大影响。
国际上对烟草转基因检测的遗传元件主要为35S启动子(烟草花叶病毒CaMV 35S启动子)、NOS终止子(农杆菌的胭脂碱合成酶基因终止子)、NPT II筛选标记基因(来自大肠杆菌,编码新霉素磷酸转移酶,卡那霉素抗性的标记基因)[1, 2],我们在对烟草转基因研究中常用遗传元件的筛查中[1],统计出这3种元件在烟草转基因研究中的使用频率为90%,属于高频使用外源基因元件,在我国,GB/T24310-2009 《烟草及烟草制品 转基因检测方法》[3]将这3种遗传元件作为转基因烟草检测中共有序列标志。因此,在检测烟叶中是否含有转基因成分时,可先行检测35S、NOS、NPT II基因是否存在来确定烟叶中是否含转基因成分。而NR基因为烟草内源基因硝酸还原酶,在PCR检测中用以评价DNA提取质量的可用性[4]。
在转基因检测方法中,PCR方法以其灵敏度高而得到广泛认可,定性PCR技术是转基因检测中最成熟的技术之一,并且多数国家将该方法制定为标准检验方法,但是,大多数定性PCR检测采用单一PCR技术,需分别对每个靶标进行检测,花费时间较多[5]。多重PCR方法是单一PCR方法的改进,该技术在一次PCR反应中同时加入多对引物,只需一次PCR反应便能同时检测两种以上靶标序列,较单一PCR更为快捷和经济[6],在病毒检测、细菌检测、转基因检测中得到广泛应用[7]。高玉龙等[8]曾提出用于转基因烟草检测的多重PCR方法,但该方法是将35S与NR,NPT II与NOS分别进行二重PCR检测,并未在同一反应内同时实现4种基因成分的检测。本实验以烤后烟叶为供试材料,旨在建立通过一个PCR反应内便能同时检测烟草内源基因NR、外源基因35S启动子、NOS终止子及NPT II筛选标记基因的多重PCR方法。
1 材料与方法 1.1 材料 1.1.1 供试材料转基因阳性烤后烟叶,非转基因烤后烟叶由本实验室研制提供,其中转基因阳性烟叶为T3代Southern检测单拷贝阳性植株,含NPT II、35S、NOS三种已知转基因成分。烤后烟叶DNA提取参照GB/T 24310-2009 《烟草及烟草制品 转基因检测方法》[3],DNA浓度统一调至100 ng/μL后,转基因烟叶DNA与非转基因烟叶DNA按1∶99(V/V)比例混合,制成转基因含量为1%的供试DNA。
1.1.2 试剂rTaqTM(货号R001A,内含A试剂:dN-TP mixture,浓度为各2.5 mmol/L,B试剂:10×PCR buffer,Mg2+浓度为15 mmol/L,C试剂:rTaq酶,5 U/μL)、100 bp DNA Ladder Marker、6×Loading Buffer为TaKaRa公司产品,核酸染料GelRedTM 10 000×in water为BIOTIUM公司产品。
1.2 方法 1.2.1 引物设计参照国标[3]引物在NCBI中检索基因原序列,通过Primer Premier V5.0设计引物,用软件中的Multiplex/Nested Primers功能,筛选出引物间干扰最小的引物组合,再利用Olige 6.0对设计引物Tm值进行评估,确定最终引物序列,引物由上海捷瑞生物工程有限公司合成。
单一PCR反应体系为:10×PCR buffer 2 μL(Mg2+终浓度1.50 mmol/L),dNTP 1 μL(dNTP终浓度125 μmol/L),上下游引物各1 μmol/L,DNA模板1 μL,rTaq酶0.2 μL,ddH2O补足20 μL。PCR反应条件为:94℃预变性5 min;94℃变性30,65℃退火45 s,72℃延伸45 s,35个循环;72℃延伸5 min。PCR产物加5 μL 6×Loading Buffer,取8 μL经2%琼脂糖凝胶电泳检测。
1.2.3 多重PCR体系反应体系建立及优化以上述单一PCR体系为初始反应体系,将4对引物稀释成相等摩尔浓度后预先按1∶1∶1∶1(V/V)混合,对Mg2+、dNTP、rTaq酶和混合引物浓度进行优化,Mg2+浓度:0.75、1.50、2.25、3.00、3.75和4.50 mmol/L;dNTP浓度:100、125、150、175、200、225、250和275 μmol/L;rTaq酶浓度:1.0、1.5、2.0、2.5和3.0 U;混合引物浓度:0.50、0.75、1.00、1.25、1.50、1.75和2.00 μmol/L。反应体系均为20 μL。PCR产物加5 μL 6×Loading Buffer,取8 μL经2%琼脂糖凝胶电泳检测。
1.2.4 多重PCR反应条件优化根据1.2.3优化的反应体系,分别对退火温度和循环数进行优化。退火温度梯度:57.5、60.0、62.5、65.0和67.5℃;循环数:27、29、31、33和35个循环。反应体系均为20 μL。PCR产物加5 μL 6×Loading Buffer,取8 μL经2%琼脂糖凝胶电泳检测。
1.2.5 多重PCR检测限确定根据1.2.3及1.2.4优化后的多重PCR反应体系及条件,按1.1.1将转基因烟叶DNA及非转基因烟叶DNA混合为转基因成分含量分别为0.9%、0.7%、0.5%、0.3%和0.1%的DNA样品,确定多重PCR的检测限。
2 结果 2.1 单一PCR及引物特异性验证对转基因及非转基因烟叶内源基因NR的扩增结果(图 1)显示,在137 bp处有明显的特异性扩增条带,说明提取的烟叶DNA模板可用于PCR检测。对外源基因NPT II、35S、NOS的扩增结果可知,转基因烟叶分别在约490 bp、345 bp和199 bp处出现明显的特异性扩增条带,而非转基因烟叶未见扩增条带,且空白对照均无条带,说明本实验设计的引物具有较好的特异性,符合PCR检测需要,可用于下步的多重PCR检测试验。
 |
| M:100 bp Ladder DNA Marker,;1-3、4-6、7-9、10-12分别为NPT II筛选标记基因、35S启动子、NOS终止子、NR基因的单一PCR产物,其中1、4、7、10为转基因含量1%烤后烟叶DNA,2、5、8、11为非转基因烤后烟叶DNA对照,3、6、9、12为空白对照 图 1 单一PCR扩增结果 |
在加入不同浓度的Mg2+后,转基因烟叶多重PCR反应扩增结果(图 2)显示,泳道2中,在Mg2+浓度为1.5 mmol/L时,4个基因的扩增条件亮度较为一致且清晰可见,而泳道1及泳道6中,Mg2+分别为0.75 mmol/L及4.5 mmol/L时,反应条带非常很弱,基本不可见,而其他泳道中不同Mg2+浓度的扩增效果均没有泳道2理想,说明10×PCR buffer中Mg2+对多重PCR反应影响显著,在Mg2+浓度为1.5 mmol/L时扩增效果最佳。图 3结果所示,在泳道1-7中,不同dNTP浓度的扩增条带亮度均较为一致,无显著的非特异性扩增条带,但是,当dNTP浓度达到275 μmol/L时,NPT II及NR基因特异扩增条带可见,但35S及NOS反应条带亮度明显很弱。图 4及图 5中,rTaq酶浓度及混合引物浓度在一定范围内的变化并未对结果有显著影响,但rTaq酶浓度偏高时,在约600 bp处有非特异性扩增条带出现。
 |
| M:100 bp Ladder DNA Marker;1-6:Mg2+浓度分别为0.75、1.50、2.25、3.00、3.75和4.50 mmol/L 图 2 多重PCR中不同Mg2+浓度扩增结果 |
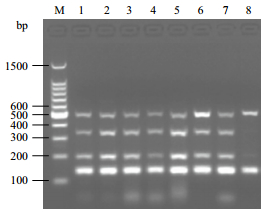 |
| M:100 bp Ladder DNA Marker;1-8:dNTP浓度分别为100、125、150、175、200、225、250和275 μmol/ 图 3 多重PCR中不同dNTP浓度扩增结果 |
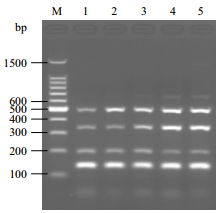 |
| M:100 bp Ladder DNA Marker;1-5:rTaq酶浓度分别为1.0、1.5、2.0、2.5和3.0 U 图 4 多重PCR中不同rTaq酶浓度扩增结果 |
 |
| M:100 bp Ladder DNA Marker;1-7:混合引物浓度分别为0.50、0.75、1.00、1.25、1.50、1.75和2.00 μmol/L 图 5 多重PCR中不同混合引物浓度扩增结果 |
综合以上因素、实验成本及单一PCR扩增结果,优化后的反应体系为4对引物预先稀释成相等摩尔浓度后按1∶1∶1∶1(V/V)混合,在反应中加入Mg2+ 1.5 μmol/L、dNTP 125 mol/L、rTaq 1 U、混合引物1 μmol/L。
2.3 不同反应条件对多重PCR的影响图 6中,退火温度为65℃时扩增效果最佳,而65℃以下退火温度的扩增效果均不理想,部分条带不清晰,而退火温度为67.5℃时,35S及NOS的特异性扩增条件不可见,这是由于在较高退火温度条件下这两对引物的Tm值较低所致。图 7中,35个循环的反应条件为最佳循环数。
 |
| M:100 bp Ladder DNA Marker;1-5:退火温度分别为57.5、60.0、62.5、65.0和67.5℃ 图 6 多重PCR中不同退火温度扩增结果 |
 |
| M:100 bp Ladder DNA Marker;1-5:循环数分别为27、29、31、33和35个循环 图 7 多重PCR中不同循环数扩增结果 |
根据2.2及2.3的多重PCR优化结果,最终确定该反应的最优条件为:体系中加入Mg2+ 1.5 mmol/L、dNTP 125 μmol/L、rTaq酶 1 U、混合引物1 μmol/L,DNA 100 ng。反应条件为:退火温度为65℃,循环数35个。为确定本体系的检测限,设置了转基因含量分别为0.9%、0.7%、0.5%、0.3%和0.1%的多重PCR检测,图 8中结果所示,在转基因烟叶含量为0.9%的反应体系中,烟草内源基因NR及3个外源基因均得到有效扩增,但在0.7%含量以下时,外源基因目的条带并不明显。因此,该多重PCR反应体系检测限为0.9%。在本体系中,若内源基因NR得不到有效扩增,则表明所提取的烤后烟叶DNA可能含有PCR反应抑制物,即外源基因无特异扩增条带时也不能说明该样品便是转基因阴性的。
 |
| M:100 bp Ladder DNA Marker;1-5:烟叶转基因成分含量分别为0.9%、0.7%、0.5%、0.3%和0.1%;6:非转基因烟叶 图 8 多重PCR中转基因含量检测限扩增结果 |
多重PCR是在同一体系中加入多对引物进行扩增,不同引物浓度及比例、Mg2+、dNTP等都会对PCR结果造成不同程序的影响,因此设计引物时要充分考虑各引物扩增片段大小、相互干扰、退火退度等,在选择引物时需用分子生物学软件进行筛选,同时需要对反应体系及条件进行优化[9],由于烤后烟叶DNA降解严重,DNA提取质量是PCR检测的关键[10],否则会得到假阴性结果,因此用多重PCR检测烤后烟叶转基因成分时,有必要对内源基因同时进行PCR扩增,我们选择了烟草内源硝酸还原酶基因NR作为内源参照基因[3],以判断所提取DNA是否适于PCR反应。
本实验所建立的多重PCR体系为定性检测,在烤后烟叶转基因检测中具有较好的复重性和稳定性,检测极限为0.9%,而在有关多重定性PCR检测转基因作物的报道中[11, 12],仅对所测靶标进行定性检测,并未明确提出其检测限,在提到检测限的文献中,邱良焱等[5]所建立的多重PCR体系检测限为0.9%,Guo等[13]检测限为80个拷贝,烟草的基因组约10 pg DNA[14],按此推算,本实验检测灵敏度为90个拷贝,与其他学者的检测极限基本相符。
值得指出的是,使用不同的阳性对照材料对检测极限会有不同极限值,本实验中所使用的转基因阳性烟叶为T3代,Southern检测为单拷贝的材料,但在严格的外源转基因检测中,用于定量的阳性植物材料应是拷贝数单一且稳定,不显示等位基因变化的DNA序列来作为阳性对照[15],因此,在目前尚未有烤后烟叶转基因PCR检测标准物质的情况下,本实验中的检测极限还需多家单位进行协同实验。
4 结论以烤后烟叶为材料,建立了在一个PCR反应管内便能同时检测烟草内源基因NR、外源基因35S启动子、NOS终止子及NPT II筛选标记基因的多重PCR方法,初步建立的体系检测限为0.9%(V/V),为烤后烟叶转基因成分筛查提供了技术支撑。
| [1] | 余婧, 张孝廉, 赵丹等. 烟草转基因研究常用遗传元件筛查策略[J]. 中国烟草学报, 2014, 20(1):78-83. |
| [2] | Bindler G, Dorlhac de Borne F, Gadani F, et al. Report of the task force genetically modified tobacco:detection methods[R]. Paris, France:CORESTA Bulletin 1999-4, Cooperation Centre for Scientific Research Relative to Tobacco, 1999. |
| [3] | 中国国家标准化管理委员会. GB/T 24310-2009 烟草及烟草制品转基因检测方法[S]. 北京:中国标准出版社, 2009. |
| [4] | 万秀清, 颜培强, 李丽杰, 等. 转基因烟草定性检测方法的研究[J]. 中国烟草学报, 2005, 11(2):24-27. |
| [5] | 邱良焱, 肖有玉, 刘佳, 等. 多重PCR法检测转 Bar、Bt 基因双抗稻米[J]. 食品科学, 2013, 34(6):139-142. |
| [6] | 魏霜, 陈贞, 芦春斌, 等. 多重 PCR 检测转基因水稻的转基因成分[J]. 食品科学, 2012, 33(12):159-162. |
| [7] | 陈浩东, 刘方, 王为, 等. 棉花多重 PCR技术及其对杂交棉纯度鉴定的初步研究[J]. 棉花学报, 2011, 23(1):22-27. |
| [8] | 高玉龙, 焦芳婵, 徐照丽, 等. 多重 PCR在烟草转基因检测中的应用[J]. 生物技术通, 2008(2):140-142. |
| [9] | Yang L, Wang CC, Wang LH, et al. An efficient multiplex PCR assay for early detection of Agrobacterium tumefaciens in transgenic plant materials[J]. Turkish Journal of Agriculture and Forestry, 2013, 37:157-162. |
| [10] | 郭兆奎, 万秀清, 魏继承, 等. 适于 PCR分析的烤后烟叶DNA提取方法的研究[J]. 中国烟草科学, 1999, 4:5-8. |
| [11] | 陈贞, 芦春斌, 杨梦婕, 等. 多重 PCR检测转基因菜籽粕中的转基因成分[J]. 植物检疫, 2011, 25(3):35-38. |
| [12] | 魏霜, 陈贞, 芦春斌, 等. 多重 PCR检测转基因水稻的转基因成分[J]. 食品科学, 2012, 33(12):159-162. |
| [13] | Guo J, Chen L, Liu X, et al. A multiplex degenerate PCR analytical approach targeting to eight genes for screening GMOs[J]. Food Chemistry, 2012, 132(3):1566-1573. |
| [14] | 郭兆奎, 魏继承, 于颜华, 等. 烟草转基因检测标准及PCR反应体系的研究[J]. 中国烟草学报, 2000, 6(3):18-22. |
| [15] | 余笑波, 崔海峰, 俞晓平, 等. 水稻淀粉分支酶基因(RBE4)作为转基因水稻基体标准物质的内标准基因的研究[J]. 农业生物技术学报, 2012, 20(11):1234-1243. |





