由于神经元具有不可再生性,因此由神经退行性疾病、神经遗传疾病和外伤导致的神经细胞受损一直难以得到有效的治疗。随着胚胎干细胞(Embryonic stem cells,ESCs)体外分化和神经诱导方法的建立,细胞替换治疗受损神经元的设想成为可能。目前,ESCs神经诱导方法多采用小分子化合物诱导法、细胞因子诱导法及选择培养基诱导法[1, 2, 3, 4]。然而,利用ESCs诱导分化产生的神经元进行细胞替换治疗存在异体排斥效应及伦理方面的问题[5]。为此,人们一直努力探索体外产生神经元的新途径。
2006年,Takahashi和Yamanaka[6]发现在小鼠胚胎或成体成纤维细胞中过表达Oct3/4、Sox2、Klf4和c-Myc四种转录因子(下文简称为iPSCs重编程因子组)能使成纤维细胞重编程为诱导型多能干细胞(Induced pluripotent stem cells,iPSCs)。时隔一年,Takahashi等[7]将相同的4种转录因子转入人成体成纤维细胞中,成功实现了人成纤维细胞向iPSCs的转变。伴随着iPSC技术的诞生,体细胞命运重编程已发展成为无论对于基础研究还是临床工作都具有较大发展潜力的一个新领域。
在基础研究和细胞替换治疗研究方面,iPSC技术与传统的ESC技术相比存在诸多优势。首先,由于iPSC相关研究无需破坏早期胚胎,因此iPSCs的应用避免了伦理问题。其次,iPSCs具有个体唯一的遗传信息。该特点使人们能通过制备病人自身的iPSCs来研究导致疾病的遗传变异,而不必通过建立动物模型来研究疾病[8, 9, 10]。此外,利用病人自身的iPSCs进行细胞替代治疗不存在异体排斥问题。
虽然iPSC技术在再生医学领域仍颇具发展潜力,但在深入研究过程中该技术逐步显现出诸如iPSCs转换效率低下、存在致瘤性风险等诸多应用局限。基于Takahashi和Yamanaka的iPSC技术,科学家们寻找到一种比现有iPSC技术更高效、更安全、更快速的细胞重编程策略-体细胞直接重编程。
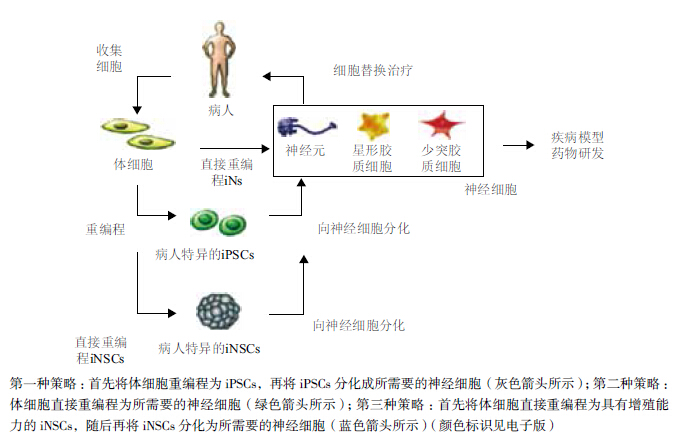
体细胞直接重编程也称为诱导转分化,即一种已分化细胞类型直接转换为另一种已分化细胞类型而不经过iPSCs阶段(图 1)。近年来,体细胞直接重编程技术已被证明能快速,且高效地诱导产生诱导型神经元(Induced neurons,iNs)和诱导型神经干细胞(Induced neural stem cells,iNSCs)。Caiazzo证明患有帕金森症病人的成纤维细胞能直接重编程为iNs[11],而无需先将病人的成纤维细胞重编程为iPSCs,再将iPSCs分化为神经元[12]。在此,我们将回顾体细胞直接重编程为iNs,以及iNSCs的最新进展并探讨iNs和iNSCs在临床应用上的各自优势、局限性及应用前景。 1 体细胞直接重编程为神经元
体细胞直接重编程为神经元是通过在体细胞中强制表达特定重编程因子,介导细胞命运直接转换的过程。整个重编程过程避开iPSCs阶段,细胞类型之间的转换不涉及细胞分裂,并且在细胞类型转换过程中不产生中间相[13](图 1)。目前,人们联合使用诸如Brn2等神经源性转录因子、microRNA(miRNA)以及包括HDAC抑制剂在内的化合物,已经成功实现了诱导转分化,而且其效率远远高于体细胞重编程为iPSC的效率。
2010年初,Vierbuchen等[13]发现使用携带多种神经特异性转录因子的病毒载体感染小鼠皮肤成纤维细胞,并在细胞中过表达这些因子就能实现小鼠皮肤成纤维细胞向iNs的诱导转分化。Vierbuchen实验了多种转录调控因子组合并最终确定了能将小鼠皮肤成纤维细胞直接重编程为iNs的3种转录调控因子-Brn2、Ascl1和Mytl1(下文简称为BAM因子)。这些iNs具有启动重复、连串动作电位的能力并能在体外与大脑皮层神经细胞形成有功能的突触联接。当iNs与星形胶质细胞共培养时,iNs显示出兴奋性突触后电流,且大多数细胞是谷氨酸能神经元(兴奋性神经元)。Vierbuchen的研究意义在于:(1)证明了不同类型的终末分化细胞之间能够实现直接转换。(2)证明了像皮肤成纤维细胞等易于取材的细胞能够被直接重编程为功能性神经元。这对于体细胞直接重编程为各种神经元亚型,优化体细胞向神经元的诱导转分化方法等后续研究具有重要的参考价值。
时隔一年,Marro[15]研究发现BAM因子不仅能使小鼠皮肤成纤维细胞直接重编程为iNs,还可以使终末分化的肝实质细胞直接重编程为iNs。然而,在肝实质细胞中过表达BAM因子诱导转分化产生的iNs仍残留着少量源自供体细胞的表观遗传记忆[15]。
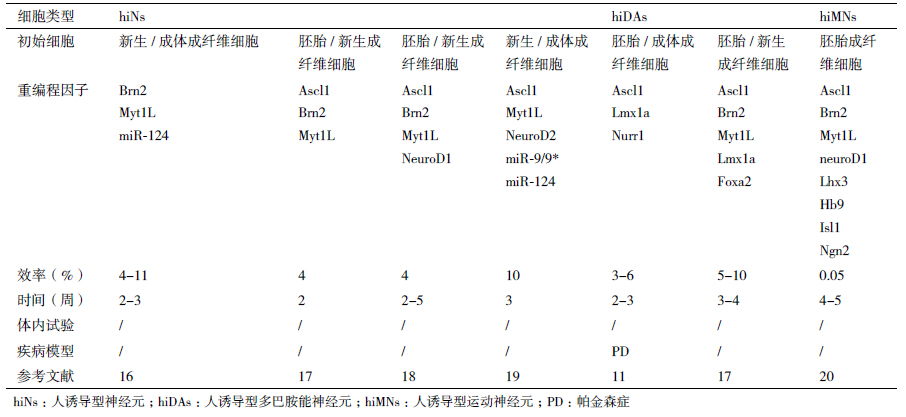
在Vierbuchen成功实现小鼠皮肤成纤维细胞诱导转分化为iNs之后,多个研究团队就接连纷纷发表各自的人iNs直接重编程方法[11, 16, 17, 18, 19, 20](表 1)。这其中除了Pfisterer[17]在胚胎和新生人成纤维细胞中过表达BAM因子即可重编程产生成熟人iNs之外,其他各研究团队均需在完整或部分的BAM因子基础上添加诸如neuroD1/2的神经特异性转录因子[18]或miRNAs[16, 19]才能实现人体细胞向iNs的诱导转分化。此外,如果组合使用原有的人iNs重编程因子和神经元亚型特异性转录因子,并在体细胞中过表达这些转录因子,体细胞就能被直接重编程为多巴胺能神经元[11, 17]和运动神经元[20]等神经元亚型。
从表 1中我们发现iNs重编程因子不仅局限于转录因子,miRNAs也能够参与体细胞向iNs的诱导转分化。2010年,Maisel等[21]在比对人骨髓间充质干细胞(bone-marrow-derived human mesenchymal stem cells,hMSCs)和由hMSCs转换产生的类神经干细胞(hMSCs-derived NSC-like cells,hmNSCs)的转录物组后发现miRNA-124a在神经外胚层分化过程中起着重要的调控作用,这说明miRNAs可调控目的基因的转录活性,从而影响细胞重编程和细胞命运决定。在体细胞诱导转分化为神经元的过程中,重编程转录因子通常起着转录激活的作用,而目前已知的一些特定的miRNAs主要通过抑制多种基因表达来促进诱导转分化过程。例如,2011年,Yoo等[19]发现miR-124和miR-9/9*协同促进体细胞诱导转分化为神经元,这两种miRNAs在成熟神经元中高表达。如果在新生和成体人成纤维细胞中过表达miR-9/9*、miR-124并转入Ascl1、Myt1l和NeuroD2转录因子,就能实现高效地将人成纤维细胞重编程为iNs。同年,Ambasudhan发现在体细胞转变为iNs的重编程过程中并非必须要转录因子Ascl1的参与,只需在新生和成体人成纤维细胞中过表达miR-124、Brn2和Myt1l三种因子就可使其诱导转分化为iNs[16]。2013年,Xue等[22]在成纤维细胞中过表达miRNA-124a,成功实现成纤维细胞向iNs的诱导转化二无需使用携带外源基因的病毒载体感染细胞。
从上述研究成果中(表 1),我们可以归纳出一些关于人体细胞直接重编程为神经元的共同特点:(1)从转录因子转入体细胞开始计算,在一个较短的时间内就能实现体细胞向神经元的诱导转分化(表达各种神经元标志物),但是需要花费较长时间(通常需要几周时间)才能获得功能性成熟神经元。(2)在直接重编程过程中不涉及细胞分裂。(3)当使用胚胎或新生人体细胞直接重编程为神经元时,其成功重编程为人iNs的效率基本与小鼠体细胞直接重编程为神经元的效率一致(4%-10%),但是成体人体细胞直接重编程为神经元的效率要比使用胚胎或新生人体细胞直接重编程的效率低很多。(3)同样,使用胚胎和新生人体细胞重编程产生的人iNs,其生长、成熟为功能性神经元的速度比成体体细胞重编程产生的人iNs快很多。
体细胞直接重编程为iNs的主要优势在于能够快速、简便地重编程出神经元而无需通过iPSC途径再分化为神经元。但是,由于iNs不能再增殖,该特性使得一次直接重编程所获得的细胞量无法满足基础研究和临床应用。此外,相比具有分化潜能的神经细胞,iNs更难以在体外进行纯化和培养或向体内移植。为了克服这些障碍,研究者们将目光投向了体细胞直接重编程为iNSCs。 2 体细胞直接重编程为神经干细胞
研究者们发现在体细胞中过表达Oct3/4、Sox2、Klf4和c-Myc四种转录因子到最终获得iPSCs是一个包含有多个细胞分化阶段的连续过程,在重编程的最初阶段,体细胞被外源转录因子激活,进入不稳定的、具有细胞命运可塑性的特殊状态。如果此时给予这些命运未知的细胞适当的维持多能干细胞生存及生长的环境条件,这些细胞就会被诱导成iPSCs[23, 24, 25, 26]。Kim等[27]利用上述研究成果,在小鼠成纤维细胞中短时过表达iPSCs重编程因子组(3-6 d)并在细胞进入不稳定状态的时候将其置于适合神经干细胞(NSCs)生长的培养基中培养(8-9 d),最终成功获得iNSCs而无需经过iPSCs阶段。这些iNSCs表达NSCs特异标志物Sox1和Pax6而且能在体外自发分化为成熟神经元和星形胶质细胞。然而使用该方法诱导产生的iNSCs在体外传代3-5次后就丧失了自我更新能力,而且无法分化成少突胶质细胞,这表明该方法诱导产生的iNSCs只具备部分神经干细胞分化潜能。此外,iNSCs在集落形成实验中表现出巨大的不均一性。例如,一些细胞共表达成神经细胞标志物DCX和多巴胺能神经元标志物TH,甚至有一小部分iNSCs呈多能性相关的干细胞标志物SSEA-1阳性。此现象表明,虽然在整个重编程过程中并没有检测到多能性干细胞的存在,但是在体细胞中短时过表达iPSCs重编程因子仍有可能使细胞经历一种不易察觉的多能性状态。再者,适合NSCs生长的培养条件无法完全抑制非神经前体细胞的形成,因为培养基中的生长因子能支持包括神经干细胞在内的多种具有分化潜能细胞的生长和增殖。
由于使用Kim重编程策略诱导产生的iNSCs存在诸多局限,Their[28]和Han[29]分别对Kim的重编程方法进行了改进。Thier基于野生型NSCs内源表达iPSCs重编程因子组中的3种因子(c-Myc,Klf4和Sox2)的发现,假设在成纤维细胞中过表达上述三种转录因子,并控制Oct4短时表达有可能在避免激活内源Oct4的前提下,将成纤维细胞直接重编程为iNSCs。为了研究该假设的可行性,Thier利用四环素依赖的慢病毒载体将编码Oct4的基因转入小鼠胚胎成纤维细胞(Mouse embryonic fibroblasts,MEFs)中,并控制Oct4仅在重编程的最初5 d表达。与此同时,携带有c-Myc、Klf4,以及Sox2基因的逆转录病毒感染细胞。诱导19 d后,成纤维细胞诱导转分化为iNSCs。该方法获得的iNSCs可在体外扩增传代50代以上仍保持着和野生型NSCs相似的细胞形态和生长速率。此外,iNSCs在体外和体内环境中均能分化产生星形胶质细胞(GFAP+)、少突胶质细胞(O4+)以及神经元(Tuj1+、NeuN+、MAP2+),该结果表明iNSCs具有多向分化潜能。Thier在对iNSCs的基因表达情况进行分析后发现iNSCs的基因表达特征同野生型NSCs非常相似,并且外源基因都已被沉默。然而,iNSCs表达的某些基因与MEFs相似,而且这些基因在野生型NSCs中并不表达。上述现象说明,虽然MEFs已完全被诱导转分化为iNSCs,但是iNSCs仍然保留着某些供体细胞的表观遗传记忆。Han则组合使用多能干细胞和神经干细胞的转录因子,即Brn4/Pou3f4、Sox2、Klf4、c-Myc和E47/Tcf3转录因子组成功地将小鼠成纤维细胞诱导转分化为iNSCs。该方法诱导产生的iNSCs具有与野生型NSCs相似的细胞形态、自我更新能力及基因表达特征。值得一提的是,iNSCs可在体外扩增传代130代以上而且移植到免疫抑制小鼠体内不会形成畸胎瘤,这充分说明了使用该重编程方法获得的iNSCs不含有多能干细胞。通过Thier以及Han的重编程方法获得的iNSCs均能在适当的体外培养条件下分化产生多种具备自发启动动作电位并能形成功能性突触联接的神经元亚型(GABA能神经元、谷氨酸能神经元、胆碱能神经元和多巴胺能神经元)。
上述3种体细胞直接重编程为iNSCs的方法均涉及在体细胞中过表达致癌基因-c-Myc,这使得iNSCs存在激活内源致癌基因继而诱发肿瘤的风险。为了最大程度降低iNSCs的致瘤风险,Lujan等[30]实验了多种转录因子组合并最终确定了Sox2、FoxG1和Brn2转录因子组。在小鼠成纤维细胞中过表达上述转录因子组能诱导转分化产生iNSCs。iNSCs具有分化成神经元、少突胶质细胞和星形胶质细胞的分化潜能,并且在经过多次传代后仍能分化产生成熟神经元(Tuj-1+/MAP2+)。这项研究表明,在体细胞中过表达合适的神经特异性转录因子组是能实现体细胞向iNSCs诱导转分化而无需iPSCs重编程因子的参与。从临床应用的角度来看,相比通过体细胞过表达含有c-Myc的转录因子组诱导获得的iNSCs,该方法获得的iNSCs,其致瘤风险被大大降低了,不过Lujan的研究报告中并没有提及iNSCs能否在体内环境中分化产生神经元和星形胶质细胞。
Ring等[31]进一步证明只需过表达Sox2一种转录因子即可将小鼠或人成纤维细胞直接重编程为iNSCs。使用该重编程方法获得的人和鼠iNSCs均表达Sox2、Nestin、Sox1等神经干细胞标志物,不表达Oct4、Nanog等多能干细胞相关基因。鼠iNSCs在体内具有存活能力并能分化成NeuN+神经元、GFAP+星形胶质细胞和O4+少突胶质细胞。人iNSCs具备和野生型NSCs相似的细胞形态和自我更新能力,且能在合适的体外诱导环境下分化成神经元、星形胶质细胞和少突胶质细胞。但由于Ring的重编程策略依赖于逆转录病毒感染系统,因而该方法无法解决外源基因整合到细胞基因组的问题。 3 展望
继iPSCs被发现之后,体细胞直接重编程为iNs为重编程研究翻开了新的篇章。与体细胞重编程为iPSCs形成鲜明对比,体细胞直接重编程为iNs是两个已分化细胞系之间的直接转换,无需经过多能细胞阶段,也不涉及细胞增殖。体细胞直接重编程iNs为细胞命运决定相关研究、药物研发和细胞替换治疗提供了新的研究途径和应用方法。紧随iNs的研究步伐,体细胞直接重编程成为iNSCs成为推动重编程研究的又一动力。由于iNSCs能在体外扩增并能进一步分化为多种神经系统细胞,因此iNSCs在细胞替代治疗方面有多种优势。
然而,目前体细胞直接重编程为iNs和iNSCs多采用病毒转染方法,而病毒载体的使用存在病毒基因整合到初始细胞的基因组并导致细胞基因发生变异的可能性,故而探索合适的非整合转染方法对于iNs和iNSCs能否应用于临床起关键作用。近年来,陆续报道了一些基于非整合转染系统的重编程研究,这些转染系统包括非整合腺病毒[32]、基于oriP/EBNA1游离型载体[33]、piggyBac转座系统[34]、瞬时转染重编程质粒[35]、Cre重组酶切除病毒[36]以及重组蛋白[37, 38]等,但是上述非整合转染系统在实际应用中或多或少存在各种局限,DNA转染方法存在不可预知的基因突变风险,而重组蛋白则存在重编程不完全或启动重编程进程不够灵敏的问题。此外,相比病毒感染的重编程方法,某些技术显示出非常低的重编程效率。
2010年,Warren等[39]证明在多种体细胞(如胚胎和成体成纤维细胞)中导入合成的编码iPSCs重编程因子的mRNA能够实现体细胞向iPSCs的高效诱导转分化。通过mRNA诱导转分化产生的iPSCs在分子生物学水平上的表型和hESCs非常相似,并且具备三胚层分化能力[39]。由于mRNA在细胞内具有快速降解的特性,因此基于mRNA转染系统的重编程方法比基于病毒感染系统的经典重编程方法更为安全。我们据此推测该技术将来可以应用于体细胞诱导转分化为iNSCs和iNs。
在多个研究团队热衷于研发各种非整合重编程方法的同时,另外一些研究团队正致力于研究使用小分子化合物替代重编程因子中的部分转录因子,来减少对使用病毒载体的依赖并提高重编程效率,最终实现小分子化合物直接替代重编程因子并完全摆脱对病毒载体的依赖。例如,已证明在重编程转录调控因子组中加入HDAC抑制剂丙戊酸能提高重编程效率[40, 41]。Anokye-Danso等[42]证明在成纤维细胞中表达miR302/367簇的同时合并使用丙戊酸,能介导HDAC2的抑制,最终大幅提高成纤维细胞去分化的效率。
无论是使用合成mRNAs、转录因子、小分子化合物进行体细胞重编程还是运用非整合转基因系统重编程细胞,所有这些细胞命运重编程的新方法都是为了排除外源基因整合进入基因组的风险,以促进基础研究向临床应用转化。
综上所述,作为新兴技术,未来体细胞直接重编程的研究重点可能转向提高重编程效率,开发适合临床应用的重编程方法以及研发更安全的重编程因子导入系统方面。为此,未来体细胞直接重编程技术仍将是研究热点。
| [1] | Bain G,Kitchens D,Yao M,et al.Embryonic stem cells express neuronal properties in vitro[J].Dev Biol,1995,168:342-357. |
| [2] | Kawasaki H,Mizuseki K,Nishikawa S,et al.Induction of midbrain dopaminergic neurons from ES cells by stromal cell-derived inducing activity[J].Neuron,2000,28(1):31-40. |
| [3] | Lee SH,Lumelsky N,Studer L,et al.Efficient generation of midbrain and hindbrain neurons from mouse embryonic stem cells[J].Nat Biotechnol,2000,18(6):675-679. |
| [4] | Okabe S,Forsberq-Nilsson K,Spiro AC,et al.Development of neuronal precursor cells and functional postmitotic neurons from embryonic stem cells in vitro[J].Mech Dev,1996,59:89-102. |
| [5] | Cohen CB.Ethical and policy issues surrounding the donation of cryopreserved and fresh embryos for human embryonic stem cell research[J].Stem Cell Rev,2009,5(2):116-122. |
| [6] | Takahashi K,Yamanaka S.Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J].Cell,2006,126(4):663-676. |
| [7] | Takahashi K,Tanabe K,Ohnuki M,et al.Induction of pluripotent stem cells from adult human fibroblasts by defined factors[J].Cell,2007,131(5):861-872. |
| [8] | Park IH,Arora N,Huo H,et al.Disease-specific induced pluripotent stem cells[J].Cell,2008,134(5):877-886. |
| [9] | Urbach A,Bar-Nur O,Daley GQ,et al.Differential modeling of fragile X syndrome by human embryonic stem cells and induced pluripotent stem cells[J].Cell Stem Cell,2010,6(5):407-411. |
| [10] | Marchetto MC,Carromeu C,Acab A,et al.A model for neural development and treatment of Rett syndrome using human induced pluripotent stem cells[J].Cell,2010,143(4):527-539. |
| [11] | Caiazzo M,Dell'Anno MT,Dvoretskova E,et al.Direct generation of functional dopaminergic neurons from mouse and human fibroblasts[J].Nature,2011,476:224-227. |
| [12] | Dimos JT,Rodolfa KT,Niakan KK,et al.Induced pluripotent stem cells generated from patients with ALS can be differentiated into motor neurons[J].Science,2008,321(5893):1218-1221. |
| [13] | Vierbuchen T,Ostermeier A,Pang ZP,et al.Direct conversion of fibroblasts to functional neurons by defined factors[J].Nature,2010,463:1035-1041. |
| [14] | Hermann A,Storch A.Induced neural stem cells(iNSCs)in neurodegenerative diseases[J].J Neural Transm,2013,120(Suppl 1):S19-S25. |
| [15] | Marro S,Pang ZP,Yang N,et al.Direct lineage conversion of terminally differentiated hepatocytes to functional neurons[J].Cell Stem Cell,2011,9:374-382. |
| [16] | Ambasudhan R,Talantova M,Coleman R,et al.Direct reprogramming of adult human fibroblasts to functional neurons under defined conditions[J].Cell Stem Cell,2011,9:113-118. |
| [17] | Pfisterer U,Kirkeby A,Torper O,et al.Direct conversion of human fibroblasts to dopaminergic neurons[J].Proc Natl Acad Sci USA,2011,108:10343-10348. |
| [18] | Pang ZP,Yang N,Vierbuchen T,et al.Induction of human neuronal and miR-124a as important regulators[J].Exp Cell Res,2010,316(17):2760-2778. |
| [22] | Xue Y,Ouyang K,Huang J,et al.Direct conversion of fibroblasts to neurons by reprogramming PTB-regulated microRNA circuits[J].Cell,2013,152(1-2):82-96. |
| [23] | Brambrink T,Foreman R,Welstead GG,et al.Sequential expression of pluripotency markers during direct reprogramming of mouse somatic cells[J].Cell Stem Cell,2008,27(2)151-159. |
| [24] | Hanna J,Saha K,Pando B,et al.Direct cell reprogramming is a stochastic process amenable to acceleration[J].Nature,2009,462(7273)595-601. |
| [25] | Stadtfeld M,Maherali N,Breault D.T,et al.Defining molecular cornerstones during fibroblast to iPS cell reprogramming in mouse[J].Cell Stem Cell,2008,2(3)230-240. |
| [26] | Stadtfeld M,Nagaya M,Utikal J,et al.Induced pluripotent stem cells generated without viral integration[J].Science,2008b,322(5903)945-949. |
| [27] | Kim J,Efe JA,Zhu S,et al.Direct reprogramming of mouse fibroblasts to neural progenitors[J].Proc Natl Acad Sci USA,2011,108(19)7838-7843. |
| [28] | Thier M,Wörsdörfer P,Lakes YB,et al.Direct conversion of fibroblasts into stably expandable neural stem cells[J].Cell Stem Cell,2012,10(4)473-479. |
| [29] | Han DW,Tapia N,Hermann A,et al.Direct reprogramming of fibroblasts into neural stem cells by defined factors[J].Cell Stem Cell,2012,10(4)465-472. |
| [30] | Lujan E,Chanda S,Ahlenius H,et al.Direct conversion of mouse fibroblasts to self-renewing,tripotent neural precursor cells[J].Proc Natl Acad Sci USA,2012,109(7)2527-2532. |
| [31] | Ring KL,Tong LM,Balestra ME,et al.Direct reprogramming of mouse and human fibroblasts into multipotent neural stem cells with a single factor[J].Cell Stem Cell,2012,11(1)100-109. |
| [32] | Stadtfeld M,Nagaya M,Utikal J,et al.Induced pluripotent stem cells generated without viral integration[J].Science,2008,322(5903):945-949. |
| [33] | Yu J,Hu K,Smuga-Otto K,et al.Human induced pluripotent stem cells free of vector and transgene sequences[J].Science,2009,324(5928):797-801. |
| [34] | Kaji K,Norrby K,Paca A,et al.Virus-free induction of pluripotency and subsequent excision of reprogramming factors[J].Nature,2009,458(7239):771-775. |
| [35] | Okita K,Nakagawa M,Hyenjong H,et al.Generation of mouse induced pluripotent stem cells without viral vectors[J].Science,2008,322(5903):949-953. |
| [36] | Soldner F,Hockemeyer D,Beard C,et al.Parkinson's disease patient-derived induced pluripotent stem cells free of viral reprogramming factors[J].Cell,2009,136(5):964-977. |
| [37] | Zhou H,Wu S,Joo JY,et al.Generation of induced pluripotent stem cells using recombinant proteins[J].Cell Stem Cell,2009,4(5):381-384. |
| [38] | Kim D,Kim CH,Moon JI,et al.Generation of human induced pluripotent stem cells by direct delivery of reprogramming proteins[J].Cell Stem Cell,2009,4(6):472-476. |
| [39] | Warren L,Manos PD,Ahfeldt T,et al.Highly efficient reprogramming to pluripotency and directed differentiation of human cells with synthetic modified mRNA[J].Cell Stem Cell,2010,7(5):618-630. |
| [40] | Chen S,Zhang Q,Wu X,et al.Dedifferentiation of lineagecommitted cells by a small molecule[J].J Am Chem Soc,2004,126(2):410-411. |
| [41] | Huangfu D,Maehr R,Guo W,et al.Induction of pluripotent stem cells by defined factors is greatly improved by small-molecule compounds[J].Nat Biotechnol,2008,26(7):795-797. |
| [42] | Anokye-Danso F,Trivedi CM,Juhr D,et al.Highly efficient miRNA-mediated reprogramming of mouse and human somatic cells to pluripotency[J].Cell Stem Cell,2011,8(4):376-388. |