2. 遵义医学院附属医院输血科,遵义 563003
2. Department of Blood Transfusion,Affiliated Hospital of Zunyi Medical College,Zunyi 563003
肺炎链球菌(Streptococcus pneumoniae,S.pn)是引起细菌性肺炎、中耳炎、脑膜炎等疾病的一种常见致病菌。其在婴幼儿及老年人中具有较高的发病率与死亡率,全世界每年约有160万人死于与S.pn感染相关的疾病[1]。毒力因子在肺炎链球菌致病过程中扮演着较为重要的角色,针对不同的感染局部微环境,其可通过自身转录因子调控荚膜多糖、磷壁酸等重要毒力因子的表达,以利于其建立感染及适应宿主局部微环境[2]。因此,研究肺炎链球菌毒力基因的转录调控机制,对于了解肺炎链球菌逃避宿主防御、建立感染的分子机制有重要意义。
Mga蛋白是A群链球菌中一种重要的转录因子,可调节多种重要毒力基因的表达[3]。SPD1587蛋白是肺炎链球菌中的一种与Mga蛋白结构相似的转录因子。研究显示,其在肺炎链球菌鼻咽部定植及肺部感染中发挥着重要作用[4]。但其调控毒力基因表达的具体分子机制目前还了解较少,为了能更深入研究SPD1587蛋白在肺炎链球菌转录调控过程中的生物学功能,本研究拟对SPD1587蛋白进行原核表达、纯化及晶体生长,以期为下一步的蛋白晶体衍射、结构解析及功能研究奠定基础。 1 材料与方法 1.1 材料 1.1.1 菌株与质粒
肺炎链球菌D39菌株、大肠杆菌DH5α菌株、BL21(DE3)菌株、PET28a质粒均为本室保存。 1.1.2 试剂
细菌基因组DNA提取试剂盒购自北京天根生化科技有限公司;Primer star 高保真DNA聚合酶,限制性内切酶BamH I、Xho I,T4 DNA连接酶购自大连宝生物工程有限公司;His Bind Column(Ni-NTA)树脂、DEAE阴离子交换柱购自美 国GE公司;蛋白晶体筛选试剂盒Crystal Screen Kit I&Ⅱ及PEG screen I&Ⅱ购自美国Hampton Research公司。 1.2 方法 1.2.1 生物信息学分析
采用NCBI保守结构域在线分析软件(Conserved Domain Search Service),分析SPD1587蛋白结构域以预测其可能的生物学功能。 1.2.2 SPD1587蛋白原核表达载体构建
以肺炎链球菌D39菌株基因组DNA为模板,以上游引物:5'-CGCGGATCCATGAGAGATTTATTATCT -3'(下划线为BamH I酶切位点),下游引物:5'-CCGCTCGAGTTACTCATCTAATCGAAT -3'(下划线为Xho I酶切位点)扩增spd1587基因。扩增产物和PET28a质粒经BamH I,Xho I双酶切后进行连接构建PET28a-spd1587重组表达质粒,转化入大肠杆菌DH5α菌株,在含50 mg/L卡那霉素的LB平板上筛选阳性克隆,提取质粒后行双酶切鉴定后,送南京金斯瑞生物科技有限公司进行测序鉴定。 1.2.3 SPD1587蛋白表达及纯化
将鉴定正确的PET28a-spd1587表达质粒转入大肠杆菌BL21(DE3)表达菌中,接种于LB培养液(含50 mg/L卡那霉素)中,37℃培养至光密度A600=0.5-0.6时,加入0.2 mmol/L的IPTG,25℃诱导8 h,12 000×g离心10 min收集菌体,超声破菌后SDS-PAGE鉴定蛋白表达形式。破菌液经12 000×g离心10 min收集上清液,用His Bind Column(Ni-NTA)对蛋白进行亲和层析纯化,并进一步利用DEAE阴离子交换柱对蛋白进行纯化,后行SDS-PAGE电泳鉴定蛋白纯度,纯化的蛋白经脱盐、超滤浓缩后分装,-80℃保存备用。 1.2.4 SPD1587蛋白的晶体生长
以5 mmol/L Tris-HCl缓冲液(含50 mmol/L NaCl,pH8.0)稀释蛋白浓度为20 mg/mL,用Crystal screen Ⅰ和Ⅱ、PEGⅠ和Ⅱ试剂盒以悬滴气相扩散法行晶体初筛,池液200 µL,将1 µL母液与1 µL SPD1587蛋白混合后加样于硅化处理的玻片上,用凡士林封板,在20℃恒温条件下进行晶体生长。 2 结果 2.1 生物信息学分析
保守结构域分析(图 1)显示,该蛋白拥有与Mga蛋白结构相似的2个DNA结合的HTH结构域和1个具有转录调控功能的 PRD结构域。
 |
| 图 1 SPD1587 蛋白保守结构域分析 |
挑选阳性克隆经菌液PCR鉴定正确后,提取重组质粒经双酶切鉴定,能够获得1 483 bp大小的酶切产物(图 2),经测序鉴定插入序列与GenBank中肺炎链球菌D39菌株的spd1587基因序列完全相同(图 3)。
 |
| 图 2 PET28a-spd1587 重组表达质粒双酶切鉴定 |
 |
| 图 3 PET28a-spd1587 原核表达质粒测序图 |
含PET28a-spd1587重组表达质粒的大肠杆菌BL21(DE3)表达菌,经IPTG诱导后SPD1587重组蛋白主要以可溶形式表达,分子量约为59 kD,与预期结果相符,经Ni-NTA亲和纯化后,获得了纯度较好的目的蛋白(图 4)。
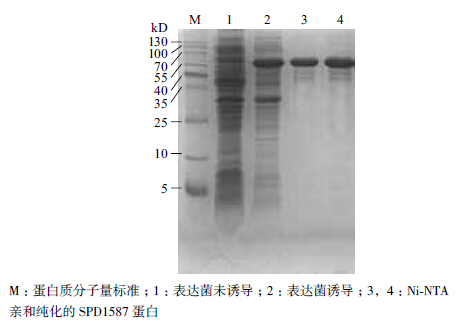 |
| 图 4 重组蛋白SPD1587 的SDS-PAGE 电泳图 |
以DEAE阴离子交换层析进一步对SPD1587蛋白进行纯化,从层析图谱上可见一个较大的洗脱峰(图 5-A),收集该洗脱峰处的蛋白行SDS-PAGE分析,SPD1587蛋白纯度达到了预期要求(图 5-B),可用于后续晶体生长。
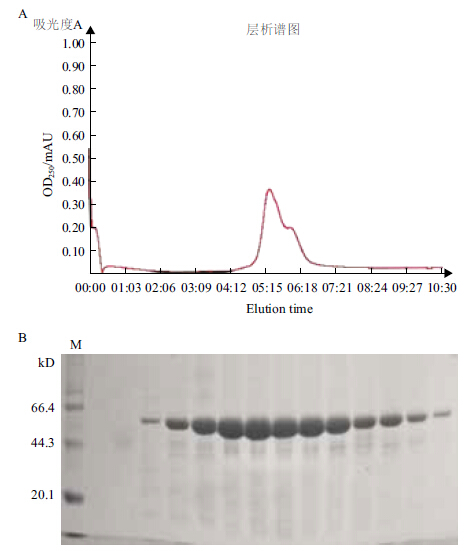 |
| 图 5 阴离子交换层析(A)及SPD1587 蛋白SDS-PAGE电泳图(B) |
SPD1587蛋白在20℃条件下生长后,在多种条件下培养出了大小不一、呈长棒状、欠规则的方形晶体(图 6-A),挑取晶体行SDS-PAGE电泳,结果(图 6-B)显示其分子量大小与SPD1587蛋白相符,提示生长的晶体为SPD1587蛋白结晶而成。
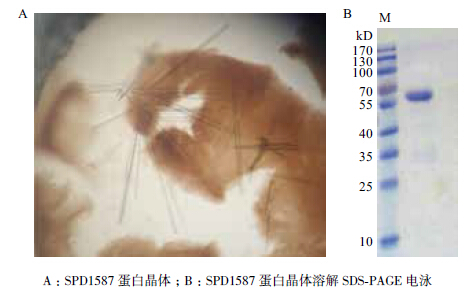 |
| 图 6 SPD1587 蛋白晶体(A)及SDS-PAGE(B) |
肺炎链球菌通常定植于健康人群的鼻咽部但并不致病,当宿主免疫力低下时,其会侵入肺、血液等部位,引起肺炎、败血症等严重疾病[5]。从鼻咽部迁移侵袭到肺的过程中,肺炎链球菌会调节相应毒力基因的表达,可呈现出透明型和不透明型细菌形态间的转换[6]。不透明菌株较透明菌株在定植、生物被膜形成及上皮细胞粘附等能力上显著减弱,但抗吞噬能力更强,可利于建立系统感染[7]。近年来肺炎链球菌的毒力基因调控网络的研究成为其致病分子机制领域的一个热点。鉴定出毒力基因相关的调控网络将有助于设计新的抗菌药物靶点从而抑制毒力基因的表达。目前,仍然有许多重要毒力基因的调控机制尚不清楚。
Mga蛋白是A群链球菌中一种重要的转录因子,与细菌毒力基因的表达调控密切相关[8]。最近研究发现,当Mga蛋白201位的组氨酸突变为精氨酸后,会显著增强细菌的毒力,这与此突变可显著增加mga基因表达,从而上调其他54种毒力相关基因表达有关[9]。SPD1587蛋白具有与Mga蛋白相似的DNA结合HTH结构域和转录调控功能域,它在不同血清型肺炎链球菌间高度保守,提示其可能在调控毒力基因表达过程中发挥着重要作用。利用基因芯片筛选发现SPD1587蛋白可抑制肺炎链球菌rlrA致病岛中多种毒力基因的表达[10],但目前rlrA致病岛仅存在于较少血清型肺炎链球菌中[11],提示在不同血清型肺炎链球菌中或不同生长环境下,SPD1587基因的调控网络可能存在差异。
目前,SPD1587蛋白的三维结构尚未被解析,而蛋白结构解析对于弄清其转录调控过程中的DNA结合方式、调控功能具有重要意义。因此,为开展对SPD1587蛋白晶体结构解析的工作,本研究对其进行了原核表达、纯化及晶体生长研究。采用大肠杆菌表达系统,本研究获得了以可溶形式表达的SPD1587蛋白。经Ni柱亲和纯化以及DEAE纯化后,得到了纯度较高的目的蛋白用于晶体培养,并成功培养出来质量较好的蛋白晶体,为下一步的蛋白晶体优化、X射线衍射及结构解析奠定了很好的工作基础。 4 结论
成功在大肠杆菌中表达出可溶形式的SPD1587蛋白,经Ni柱亲和纯化以及DEAE纯化后,得到了纯度较高的目的蛋白用于晶体生长,最终获得了质量较好的蛋白晶体。
| [1] | Isaacman DJ, McIntosh ED, Reinert RR. Burden of invasive pneumococcal disease and serotype distribution among Streptococcus pneumoniae isolates in young children in Europe:impact of the 7-valent pneumococcal conjugate vaccine and considerations for future conjugate vaccines[J]. Int J Infect Dis, 2010, 14(3):e197-209. |
| [2] | Chan WT, Nieto C, Harikrishna JA, et al. Genetic regulation of the yefM-yoeB toxin-antitoxin locus of Streptococcus pneumoniae[J]. J Bacteriol, 2011, 193(18):4612-4625. |
| [3] | Hondorp ER, Hou SC, Hause LL, et al. PTS phosphorylation of Mga modulates regulon expression and virulence in the group A streptococcus[J]. Mol Microbiol, 2013, 88(6):1176-1193. |
| [4] | Solano-Collado V, Lurz R, Espinosa M, et al. The pneumococcal MgaSpn virulence transcriptional regulator generates multimeric complexes on linear double-stranded DNA[J]. Nucleic Acids Res, 2013, 41(14):6975-6991. |
| [5] | Simell B, Auranen K, Käyhty H, et al. The fundamental link between pneumococcal carriage and disease[J]. Expert Rev Vaccines, 2012, 11(7):841-855. |
| [6] | Arai J, Hotomi M, Hollingshead SK, et al. Streptococcus pneumoniae isolates from middle ear fluid and nasopharynx of children with acute otitis media exhibit phase variation[J]. J Clin Microbiol, 2011, 49(4):1646-1649. |
| [7] | Wren JT, Blevins LK, Pang B, et al. Influenza A virus alters pneumococcal nasal colonization and middle ear infection independently of phase variation[J]. Infect Immun, 2014, 82(11):4802-4812. |
| [8] | Sanson M, Makthal N, Gavagan M, et al. Phosphorylation events in the multiple gene regulator of group A streptococcus(Mga)significantly influences global gene expression and virulence[J]. Infect Immun, 2015, pii:IAI. 03023-14. |
| [9] | Sanson M, O'Neill BE, Kachroo P, et al. A naturally occurring single amino acid replacement in multiple gene regulator of group A Streptococcus significantly increases virulence[J]. Am J Pathol, 2015, 185(2):462-471. |
| [10] | Hemsley C, Joyce E, Hava DL, et al. MgrA, an orthologue of Mga, Acts as a transcriptional repressor of the genes within the rlrA pathogenicity islet in Streptococcus pneumoniae[J]. J Bacteriol, 2003, 185(22):6640-6647. |
| [11] | Solano-Collado V, Espinosa M, Bravo A. Activator role of the pneumococcal Mga-like virulence transcriptional regulator[J]. J Bacteriol, 2012, 194(16):4197-4207. |




