幽门螺杆菌(Helicobacter pylori,H. pylori)被公认是消化性溃疡、慢性活动性胃炎、胃黏膜相关淋巴组织(MALT)淋巴瘤的主要致病因素,与胃癌的发生存在密切关联性[1, 2, 3],已被世界卫生组织定为Ⅰ类致癌因子[4]。H. pylori感染呈现全球分布特点,据有关报道显示,世界人口平均感染率已超过50%,发展中国家的H. pylori感染率更高,我国的感染率达到61%[5]。目前对于抗H. pylori感染方法主要采用的是药物治疗法,但都存在一定的局限性[6],因此开发抗H. pylori感染疫苗产品成为研究热点。
尿素酶B亚单位(UreB)作为疫苗的有效抗原蛋白,具有无毒、免疫效果好等特点,已被相关实验所证实[7, 8, 9]。目前关于ureB克隆表达及纯化的方法已有报道,主要采用细菌培养的方法获取大量H. pylori,利用基因工程技术克隆ureB基因,构建表达质粒,并使用亲和层析及多级纯化相结合的方法获得较高纯度的UreB蛋白[10, 11, 12],但利用离子交换层析技术进行一步纯化,来获得高纯度UreB蛋白的相关信息未见报道。
本研究以pET11c-LTB-ureB质粒为模板,设计引物,克隆ureB基因,构建重组质粒pET28a-ureB,并使用离子交换层析一步纯化法,获得高纯度且具有生物活性的目的蛋白,可作为疫苗参考品,为疫苗后续研究奠定基础。 1 材料与方法 1.1 材料 1.1.1 菌株及质粒
E. coli DH5α及E. coli BL21(DE3)由本实验室保种,pET11c-LTB-ureB表达质粒由本实验室构建保存,载体pMD18-T、pET-28a购自TaKaRa公司(大连)。 1.1.2 主要试剂
质粒提取试剂盒、DNA凝胶回收试剂盒购自AXYGEN公司;Taq DNA聚合酶、T4 DNA连接酶、DL5000 DNA Marker、限制性内切酶BamHⅠ、NdeⅠ、XbaⅠ、XhoⅠ均购自TaKaRa公司(大连);离子交换层析柱介质Q Sepharose High Performance、凝胶过滤层析柱介质Sephadex G-25 Medium购自美国GE公司。 1.2 方法 1.2.1 pET11c-LTB-ureB重组质粒的克隆及序列测定
取5 μL pET11c-LTB-ureB质粒转化DH5α感受态,涂Amp抗性的LB平板,挑取单克隆于LB液体培养基中大量扩增,用质粒提取试剂盒提取质粒。经BamHⅠ、NdeⅠ双酶切,电泳鉴定正确后,送上海生工测序。 1.2.2 ureB基因表达载体的构建
根据测序结果,应用Primer 5.0设计扩增ureB基因引物。上游引物:GTCTAGAAATAATTTTGTTTAACTTTAAGAAGGAG- ATATAATGAAAAAGATTAGCAGAAAAGAATATG (下划线为XbaⅠ酶切位点),下游引物:CTCGAGT-TACTAGAAAAT GCTAAAGAGTTGTGCCAAGCTCA(下划线为XhoⅠ酶切位点)。以pET11c-LTB-ureB质粒为模板,采用上述引物,进行PCR扩增。扩增条件为:95℃ 2 min;95℃ 30 s,50℃ 30 s,72℃ 2 min;35个循环。1%琼脂糖凝胶电泳鉴定后,用DNA凝胶回收试剂盒回收1 700 bp目的片段,并将ureB基因连接到pMD18-T载体上,转化DH5α感受态,提取阳性克隆质粒,用XbaⅠ和XhoⅠ双酶切鉴定质粒,并将鉴定正确的质粒送至上海生工测序。
利用XbaⅠ和XhoⅠ双酶切测序正确的pMD18T-ureB和pET-28a载体质粒,并回收1 700 bp和5 000 bp的目的条带。将回收的目的片段和载体片段,用T4 DNA连接酶连接,连接产物转化BL21(DE3)感受态细胞;均匀涂布于含有Kan抗性的LB平板,37℃恒温培养箱过夜培养,挑取单克隆于LB液体培养基中大量扩增,提取重组质粒;经XbaⅠ和XhoⅠ双酶切鉴定正确后送上海生工测序。 1.2.3 UreB蛋白的诱导表达
将测序结果正确的重组工程菌接种于5 mL含Kan的LB液体培养基中,37℃摇床培养过夜。将过夜培养的重组工程菌按1%的比例转接入50 mL含Kan的LB培养液中,37℃摇床培养(200 r/min)。待OD600≈1.0时,加入终浓度为1 mmol/L的IPTG开始诱导,分别于诱导0、1、2、3、4、5 h取样,并采用SDS-PAGE检测目的蛋白诱导表达情况。 1.2.4 发酵菌体的处理
将高效表达的菌体以1:10(M/V)比例与缓冲液(10 mmol/L Tris-HCl pH8.5)混合、溶解,搅拌均匀后,向菌体悬液液中加入冰袋将菌液冷却至10℃左右,利用高压均质机高压(800 bar)破碎2次,破碎后的菌液通过管式离心机离心收集粗包涵体沉淀(离心转速:20 000 r/min;离心流速:1 L/min),-20℃保存。 1.2.5 UreB包涵体的洗涤及裂解
称取UreB包涵体20 g,按照1:10(m/v)的比例,用洗涤液Ⅰ(50 mmol/L Tris-HCl 1%Triton-X 100 pH8.5)溶解包涵体,高速分散器混匀后,搅拌1 h,8 000 g离心30 min,弃上清,预留上清(收集液)检测,重复洗涤一次;沉淀再用洗涤液Ⅱ(50 mmol/L Tris-HCl 1 mol/L尿素 pH8.5)溶解,高速分散器混匀后,搅拌1 h,8 000 g离心30 min,弃上清,预留上清检测,重复洗涤一次;最后沉淀用pH8.5的50 mmol/L Tris-HCl 8 mol/L尿素溶解,高速分散器混匀后,裂解过夜。 1.2.6 UreB蛋白的Q Sepharose High Performance纯化
柱床体积为150 mL,用5倍柱体积pH8.5 50 mmol/L Tris-HCl、8 mol/L尿素平衡层析柱;用3倍柱体积含不同盐浓度的50 mmol/L Tris-HCl 8 mol/L尿素 pH8.5的洗脱缓冲液进行梯度洗脱,盐浓度梯度分别为40 mmol/L、60 mmol/L、80 mmol/L、90 mmol/L、0.2 mol/L、2 mol/L NaCl,流速为15 mL/min,采取分段收集样品的方法,对样品进行SDS-PAGE检测,利用凝胶成像系统进行纯度分析,系统的分析软件为Imaglab(Version 4.1)。 1.2.7 超滤浓缩、脱盐
Q柱样品用截留量为50 kD的膜包进行超滤浓缩后,用G-25凝胶过滤层析柱脱盐处理(pH10.0 25 mmol/L碳酸氢钠缓冲液),收集样品进行SDS-PAGE检测,利用凝胶成像系统进行纯度分析,系统的分析软件为Imaglab(Version 4.1)。 1.2.8 免疫双扩散检测蛋白特性
选用重约2 kg、健康状况良好的新西兰大耳兔2只,每只兔子采用背部多点皮内注射1 mg抗原。免疫时间分别为0、10、17 d,3次免疫后取兔耳缘静脉血,免疫双扩散检测UreB抗原的特异性。
用0.9%的生理盐水配制1.5%的琼脂糖凝胶,水浴加热至充分溶化后,倒于载玻片上,制成厚度约为2-3 mm厚的琼脂糖凝胶板;置于室温冷却凝固后,用打孔器准确打孔,加热封底。冷却后,中央孔内滴加一定的兔抗血清,加入量以不溢出为度,周边孔分别滴加UreB纯化蛋白(1、5、10、20 μg)、 空白对照(pH10.025 mmol/L碳酸氢钠缓冲液)、阴性对照(pET-28a空载质粒转化后诱导表达蛋白,采用Lowery法测蛋白质含量,取10 μg加样)。加完样品后,将琼脂平皿加盖后放置于加盖的湿盒内,37℃温箱中孵育30 h,观察并记录结果。 2 结果 2.1 ureB基因的核酸电泳鉴定
ureB基因的PCR扩增产物和重组质粒pET28a-ureB双酶切产物,用1.0%的琼脂糖凝胶电泳检测,结果分别见图 1、图 2。图 1中为扩增的目的基因电泳结果,经序列测定:ureB基因大小为1 710 bp,与ureB基因的预期大小一致;从图 2中可以观察到pET28a-ureB质粒采用XbaⅠ和XhoⅠ双酶切后,可见约5 000 bp和1 700 bp左右的条带,与预期结果一致。
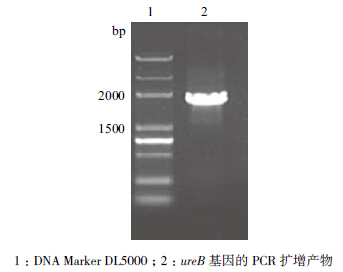 |
| 图 1 ureB 基因的PCR 扩增 |
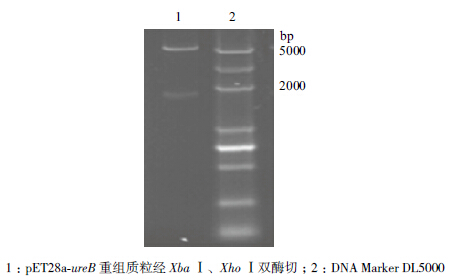 |
| 图 2 pET28a-ureB 重组质粒双酶切鉴定 |
将重组质粒转入大肠杆菌中扩增培养后进行诱导表达5 h,采用SDS-PAGE检测(0、1、2、3、4、5 h)UreB目的蛋白的表达情况。结果(图 3)显示,UreB的相对分子质量约为64 kD,表达量随诱导时间的延长而增加,诱导5 h时表达量最高,目的蛋白约占总蛋白的27.4%。
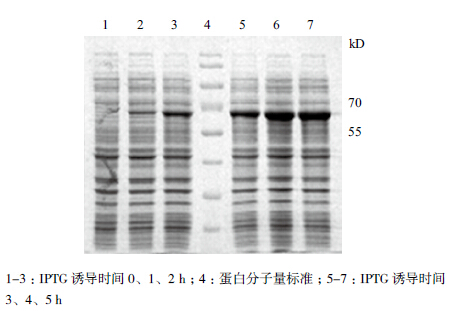 |
| 图 3 不同诱导时间下UreB 的表达量分析 |
利用洗涤液Ⅰ和洗涤液Ⅱ对包涵体各洗涤两次,SDS-PAGE检测结果(图 4)显示,包涵体洗涤效果良好,4次洗涤收集液中UreB目的蛋白的纯度依次为9.7%、25%、37.5%、49.5%,而在裂解液中UreB纯度达到了67.3%。
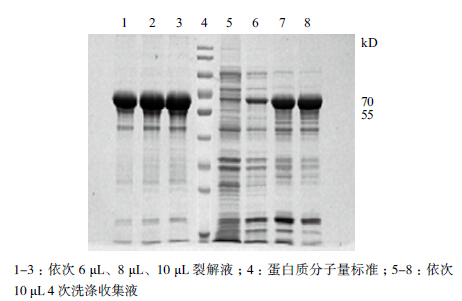 |
| 图 4 UreB 包涵体的洗涤与裂解效果的电泳分析 |
采用Q Sepharose High Performance阴离子交换层析对UreB蛋白进行纯化,经SDS-PAGE检测(图 5),用80 mmol/L和90 mmol/L NaCl进行洗脱可获得较高纯度的目的蛋白,纯度可达到96.7%、96.9%。
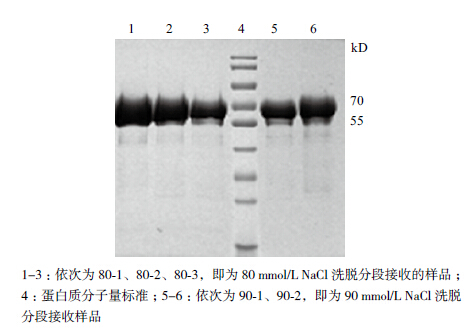 |
| 图 5 80 mmol/L 和90 mmol/L NaCl 洗脱目的蛋白的电泳分析 |
Q柱样品用截留量为50 kD的膜包进行超滤浓缩,浓缩后的样品用G-25脱盐柱进行脱盐处理。脱盐后目的蛋白以可溶性的形式存在,经SDS-PAGE检测(图 6),样品中的目的蛋白纯度高达98.5%。
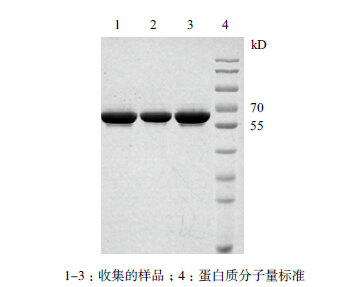 |
| 图 6 UreB 蛋白脱盐后电泳分析 |
兔抗UreB血清免疫双扩散结果(图 7)显示,UreB抗原具有良好的反应特异性,在兔抗血清与UreB纯化蛋白之间出现明显的免疫沉淀线,而兔抗血清与阴性对照之间未出现沉淀线。
 |
| 图 7 免疫双扩散鉴定 |
研究表明,UreB作为疫苗的抗原,具有较好的免疫保护作用,如何获得高质量UreB蛋白,是能否作为疫苗参考品的关键。这就要求不仅要获得高纯度的UreB蛋白,还需要保证其具有良好的生物活性、反应特异性,为此我们构建重组表达质粒,进行诱导表达及纯化工艺的摸索。
本研究选用pET28a作为表达载体,并以实验室保存的pET11c-LTB-ureB表达质粒为模板,设计带有XbaⅠ和XhoⅠ酶切位点上下游引物,克隆出疫苗的抗原基因,成功构建了重组表达质粒pET28a-ureB。将重组质粒转入大肠杆菌中进行表达,可获得以包涵体形式表达的UreB蛋白,该形式被认为可防止蛋白质降解,且利于纯化[13, 14]。
我们优化了包涵体洗涤工艺,进行4次洗涤即可达到较好的洗涤效果,其中采用洗涤液Ⅰ进行的前两次洗涤,电泳检测UreB蛋白纯度只有9.7%和25%,这表明前两次洗涤杂蛋白去除效果较好,而洗涤液Ⅱ中因含有尿素,导致目的蛋白有一定量的损失,但经过工艺验证,当洗涤液Ⅱ中尿素浓度1 mol/L时,可使目的蛋白损失最小,而杂蛋白去除效率最大化,洗涤液在电泳检测结果表明杂质去除效果非常明显,杂质去除率可达30%以上。经过多次试验验证,包涵体的最佳裂解液为pH8.5的50 mmol/L Tris-HCl 8mol/L尿素溶液。在蛋白纯化过程中,样品能否保证其生物学活性,被看作工艺是否成功的前提条件[15],而经过多次纯化必然会对蛋白的活性有所影响。因此,在UreB纯化过程中,利用Q Sepharose High Performance阴离子交换层析进行了多次实验摸索,确定了最佳的平衡缓冲液为pH8.5的50 mmol/L Tris-HCl 8 mol/L尿素溶液。同时在目的蛋白洗脱的过程中,摸索出盐离子最佳洗脱梯度,并采取分段收集样品的方法检测样品,最终确定了一步纯化即可获得高纯度且具有生物活性的目的蛋白的方法。而根据已有的相关报道,在利用阴离子交换层析法进行UreB纯化时,在裂解及平衡缓冲液组成上有所不同,所用缓冲液pH值多为8.0,大多采用了梯度洗脱,但都未采取分段收集样品方法,这就导致收获液的纯度达不到要求,增加了纯化 难度。
实验表明离子交换层析是一种高效分离蛋白的方法,可以根据蛋白表面静电荷不同,建立适合的盐离子洗脱梯度,从而获得我们所需要具有生物活性的目的蛋白。目前有相关报道的UreB纯化方法,一是采用亲和层析进行纯化;二是采用多级纯化法,如亲和层析与离子交换层析相结合或离子交换层析与疏水层析相结合,这两种方式都可以获得较满意蛋白纯度,可见的报道中最高的蛋白纯度为98.3%。相比以上两种传统的UreB纯化方式,我们通过摸索纯化工艺,优化纯化条件,最终确定了一步纯化的工艺,将UreB蛋白经Q Sepharose High Performance阴离子交换层析纯化及G-25凝胶过滤脱盐后,能够快速获得纯度高且具有生物活性、反应特异性的目的蛋白,蛋白纯度可高达98.5%,在节省了时间的同时,保证了蛋白的活性,同时节省了生产成本。 4 结论
本研究确定的纯化工艺,达到了一步纯化即得到高纯度、具有生物活性蛋白的目的,该纯化工艺简单、有效。制备的UreB蛋白,可作为口服重组幽门螺杆菌疫苗的参考品,用于疫苗的相关检测试验。
| [1] | Yamaoka Y. Mechanisms of disease:Helicobacter pylori virulence factors[J]. Nature Reviews Gastroenterology and Hepatology, 2010, 7(11):629-641. |
| [2] | Machado AM, Figueiredo C, Seruca R, et al. Helicobacter pylori infection generates genetic instability in gastric cells[J]. Biochimica et Biophysica Acta(BBA)-Reviews on Cancer, 2010, 1806(1):58-65. |
| [3] | Suerbaum S, Michetti P. Helicobacter pylori infection[J]. New England Journal of Medicine, 2002, 347(15):1175-1186. |
| [4] | Peter S, Beglinger C. Helicobacter pylori and gastric cancer:the causal relationship[J]. Digestion, 2007, 75(1):25-35. |
| [5] | Graham DY, Malaty HM, Evans DG, et al. Epidemiology of Helicobacter pylori in an asymptomatic population in the United States[J]. Gastroenterology, 1991, 100(6):1495-1501. |
| [6] | 张卫军, 郭刚, 刘开云, 等. 幽门螺杆菌双价亚单位分子内佐剂疫苗的构建表达与纯化[J]. 第三军医大学学报, 2008, 30 (17):1587-1590. |
| [7] | Khoder G, Yamaoka Y, Fauchre JL, et al. Proteomic Helicobacter pylori biomarkers discriminating between duodenal ulcer and gastric cancer[J]. Journal of Chromatography B, 2009, 877(11):1193-1199. |
| [8] | Hung CT, Leung WK, Chan FK, et al. Comparison of two new rapid serology tests for diagnois of Helicobacter pylori infection in Chinese patients[J]. Digestive and Liver Disease, 2002, 34(2):111-115. |
| [9] | Voland P, Weeks DL, Marcus EA, et al. Interactions among the seven Helicobacter pylori proteins encoded by the urease gene cluster[J]. American Journal of Physiology-Gastrointestinal and Liver Physiology, 2003, 284(1):G96-G106. |
| [10] | 史彤, 刘文忠. 金属螯合亲和层析法对重组幽门螺杆菌尿素酶 B 亚单位的纯化[J]. 胃肠病学, 2002, 7(4):199-201. |
| [11] | 袁小澎, 邹全明, 柏杨, 等. 幽门螺杆菌尿素酶 B 亚单位功能片段的纯化及活性研究[J]. 南方医科大学学报, 2007, 27(7):959-962. |
| [12] | 王缚鲲, 邹全明. 从包涵体中纯化重组人幽门螺杆菌尿素酶 B 亚单位[J]. 中国生物制品学杂志, 2002, 15(1):38-41. |
| [13] | 杨晓梅. 包涵体蛋白的复性技术[J]. 国外医学:临床生物化学与检验学分册, 2000, 21(2):98-99. |
| [14] | Patra AK, Mukhopadhyay R, Mukhija R, et al. Optimization of inclusion body solubilization and renaturation of recombinant human growth hormone from Escherichia coli[J]. Protein Expression and Purification, 2000, 18(2):182-192. |
| [15] | Cho WK, Sohn U, Kwak JW. Production and in vitro refolding of a single-chain antibody specific for human plasma apolipoprotein A-I[J]. Journal of Biotechnology, 2000, 77(2):169-178. |




