2. 安徽省肥西县特殊教育学校,合肥 231200
2. Special Education School in Feixi County of Anhui Province,Hefei 231200
铜绿假单胞菌(Pseudomonas aeruginosa),又名绿脓杆菌,是医院感染最常见的条件致病菌之一,常分布于人与动物皮肤和肠道上;在机体烧伤、免疫力下降、重大疾病创伤后,容易诱发感染,甚至导致感染性休克[1, 2]。由于抗生素的大量使用,铜绿假单胞菌出现不同程度的耐药性,增加了治疗的难度,人们一直在寻找一种不产生耐药性的防治 药物[3, 4]。
铜绿假单胞菌主要的免疫保护抗原有OprI,OprF和OprH。OprI为铜绿假单胞菌主要的外膜蛋白之一,可激活机体非特异性免疫,并与抗原递呈细胞(Antigen-presenting cells,APC)相互作用,提高与其融合的蛋白的保护率[5, 6]。研究发现OprI免疫小鼠产生的抗体可有效抵抗铜绿假单胞菌的感染[7],其激发的非特异性免疫对猪瘟(Classical swine fever,CSF)也有免疫保护作用[8];人体免疫试验证实OprI可显著增强机体的特异性抗体水平[9]。可见OprI在疫苗上具有很好的应用前景[5, 10]。
本实验利用分子克隆方法获得铜绿假单胞菌OprI表达菌株;纯化OprI蛋白,免疫小鼠,攻毒铜绿假单胞菌研究其免疫保护作用;通过正交试验确定OprI最佳的表达条件与培养条件,旨为OprI工业发酵、蛋白功能与疫苗开发研究奠定基础。 1 材料与方法 1.1 材料
P. aeruginosa PAO1,E. coli DH5α,E. coli BL21,pET-32a质粒由实验室保存。昆明鼠购于西安交通大学动物中心。引物合成、基因序列测定均由西安沃尔森生物技术有限公司完成。Protein Marker,NDA Marker,Taq酶,限制性内切酶,T4-DNA 连接酶,均为TaKaRa 公司产品;IPTG,蛋白胨,酵母提取物均购于美国MP公司;质粒提取试剂盒、基因组提取试剂盒与胶回收试剂盒为上海生物工程公司;小鼠抗OprI血清本实验室制备;山羊抗小鼠IgG二抗购于Sigma公司。 1.2 方法 1.2.1 重组质粒的构建
根据NCBI公布的P. aeruginosa PAO1基因序列,设计oprI基因引物:Se- nse Primer:5'- ACAGGATCCATGAACAACGTTCTGA-AA -3';Anti-sense Primer:5'- ACTCTCGAGTTACTT-GCGGCTGGCTTT -3',下划线分别为限制性内切酶位点BamH I和Xho I。PCR反应体系(50 mL):PCR反应缓冲液5 mL,模板DNA 3 mL,10 mmol/L dNTP 2 mL,25 mmol/L引物各1 mL,Taq 酶0.5 mL,补水至50 mL。PCR反应条件为:94℃预变性3 min,30个PCR循环(94℃变性1 min,55℃退火45 s,72℃延伸90 s),72℃充分延伸10 min,最后4℃保温。用0.8%琼脂糖凝胶电泳检测DNA片段的大小,胶回收试剂盒回收DNA片段。pET-23a质粒载体与PCR产物均采用BamH I和Xho I双酶切后,T4-连接酶16℃连接过夜,转化E. coli DH5α,提取重组质粒进行酶切鉴定及测序鉴定,检验正确后转化E. coli BL21表达菌株,进行OprI蛋白表达测定。 1.2.2 重组蛋白的表达检测与蛋白纯化
取经鉴定的重组菌过夜培养,以1:100倍转接入新鲜的LB培养基中,待OD600约0.6时,加入终浓度0.5 mmol/L IPTG诱导培养6 h,离心收集菌体,加入上样缓冲液,用SDS-PAGE蛋白电泳检测OprI蛋白表达情况;并利用SDS-PAGE电泳切胶的方法对OprI进行蛋白纯化。 1.2.3 重组蛋白的Western blotting检测
采用Western blotting方法检测蛋白表达情况[11],简要步骤为:将OprI表达菌株进行IPTG诱导(对照为未诱导),SDS-PAGE蛋白电泳,转NC膜,5%牛奶封闭后,加入小鼠OprI多克隆抗血清,洗涤后,二抗孵育,最后DAB显色,确认OprI的表达。 1.2.4 重组蛋白的小鼠免疫
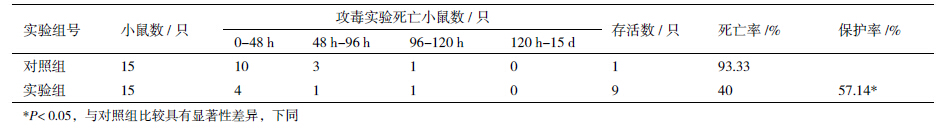
选用4-5周龄的昆明鼠,实验组和对照组各15只。实验组免疫纯化的OprI蛋白,对照组免疫从pET32质粒菌株中诱导、表达与纯化的免疫标签蛋白。小鼠采用腹腔免疫的方式,实验组每只免疫OprI蛋白50 μg/每次,对照组免疫PBS;第1次采用弗氏完全佐剂,免疫10 d后进行第2次免疫;第2次免疫7 d后进行铜绿假单胞菌攻毒实验。 1.2.5 免疫小鼠的攻毒保护实验
在预实验基础上,进行免疫动物的攻毒实验。末次免疫7 d 后,以107CFU单位铜绿假单胞菌注入小鼠腹腔进行攻毒试验,攻毒后密切观察实验小鼠的活动、摄食及精神状态15 d。依据公式:保护率(%)=(1-实验组死亡率/对照组死亡率)×100%,计算OprI的免疫保护作用;利用SPSS软件计算显著性。 1.2.6 重组蛋白表达条件的优化
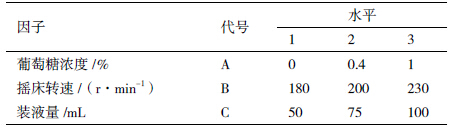
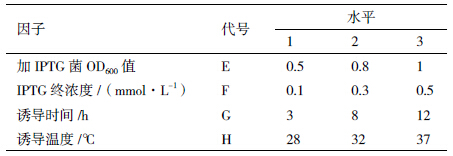
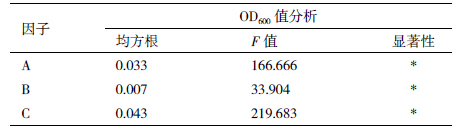
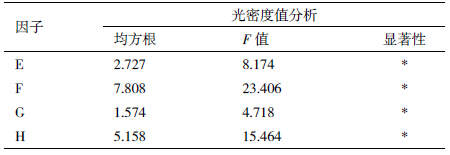
为确定OprI蛋白最佳表达条件,进行L9(34)正交试验,分为菌最适培养条件与蛋白最适诱导表达条件2部分,因子与水平分别见表 1和表 2[12]。
菌株培养条件正交试验主要步骤为:取单菌落入LB 培养液中,37℃,培养16 h,以1:100转接菌体入正交试验模型要求250 mL锥形瓶中,按表 1 的条件培养,记录所得菌液的OD600值。依据OD值进行数据的极差分析,使用SPSS软件进行数据的方差分析。
菌株诱导表达条件正交实验主要步骤为:根据菌最适培养条件获得的结果,快速培养菌体至表 2要求的不同OD600值,再按照正交试验模型的条件加入不同浓度的IPTG,诱导相应的时间,吸取1 mL菌液离心,沉淀加入300 mL的2×SDS 上样缓冲液,沸水中煮样5 min,上样10 μL进行SDS-PAGE电泳。使用软件Phoretix 1D对电泳得到的OprI蛋白表达图谱进行光密度分析;使用SPSS软件进行数据的方差分析。 2 结果 2.1 重组质粒的构建
以铜绿假单胞菌基因组为模板,PCR扩增oprI基因,获得252 bp左右的基因片段,与预期大小一致(图 1-A)。将PCR产物与pET-32a质粒载体进行双酶切,T4-DNA连接酶作用后,转化E. coli DH5α菌株,提取质粒,用BamH I和Xho I双酶切获得252 bp片段,与目的基因大小一致(图 1-B);序列测序显示与NCBI公布的基因序列相同,证明成功构建重组质粒。
 |
| 图 1 铜绿假单胞菌oprI 基因重组质粒构建 |
为验证重组蛋白表达情况,将构建的重组质粒菌株经IPTG诱导,SDS-PAGE电泳获得30 kD的蛋白条带,包含OprI蛋白9.24 kD大小,以及pET-32a质粒自带的20.4 kD 融合蛋白标签,重组蛋白表达情况与预期大小一致;并利用SDS-PAGE电泳切胶的方法获得纯化的OprI蛋白,如图 2所示。
 |
| 图 2 OprI 蛋白表达与纯化 |
利用蛋白Western blotting显色技术,发现诱导表达重组菌株获得的蛋白有条带显示,而对照组未出现,如图 3所示。证明重组的OprI蛋白可与抗体结合,OprI表达正确。
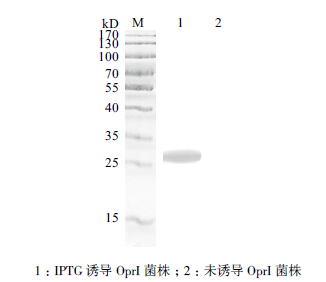 |
| 图 3 OprI 表达菌株Western blotting 验证 |
小鼠通过免疫OprI蛋白,攻毒铜绿假单胞菌发现24 h内均出现较重的中毒症状,毛蓬松皱褶、摄食减少、精神萎靡嗜睡,并出现大量死亡,在4 d后死亡得到控制,小鼠能够逐渐恢复,一旦恢复可长期存活。实验与对照组小鼠具体的存活与死亡情况及时间,如表 3 所示。
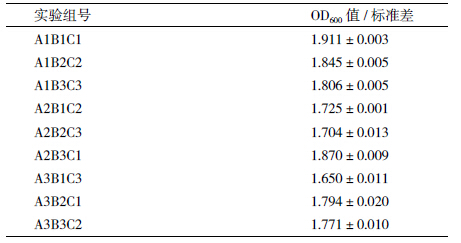
根据表 1 设计的因素、水平,按照正交试验 L9(34)模式设计各个试验组合,进行3次重复,获得OprI表达菌株菌液浓度的OD600数值(表 4)。将数据进行极差分析(表 5)显示,组合A1B3C1为菌株最适培养条件,即培养基中不需要加入葡萄糖,转速230 r/min,装液量50 mL;方差分析结果(表 6)显示葡萄糖浓度、转速及装液量均达到显著性。因而,实际发酵工程菌时,不需要额外补充葡萄糖,可适当提高转速,进行IPTG诱导前菌体的快速培养。
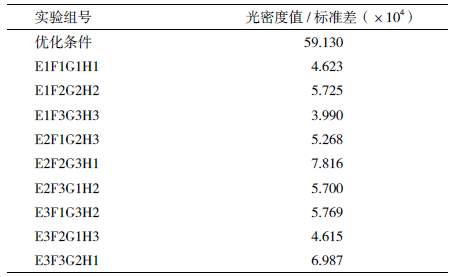
为检测OprI的最佳表达情况,进行3次重复,通过SDS-PAGE电泳,获得OprI蛋白表达图谱(图 4);然后通过软件Phoretix 1D分析图谱中的蛋白条带,获得蛋白的光密度值(表 7)。对数据进行极差分析获得最佳OprI蛋白表达组合为E2F2G2H1(加IPTG菌液OD600值:0.8;IPTG终浓度:0.3 mmol/L;诱导时间:8 h;诱导温度:28℃)(表 8)。方差分析结果显示,加IPTG时菌液浓度、加IPTG终浓度、诱导时间及诱导温度,这4个因素对于蛋白表达的影响均达到显著性(表 9)。可见OprI工程菌诱导时应采用:加入低浓度IPTG、对数生长中期诱导、低温诱导,且诱导时间不易过长。
根据最优化的OprI表达条件(培养条件:培养基中不加入葡萄糖,转速230 r/min,装液量50 mL;诱导条件:加IPTG菌液OD600值 0.8,IPTG终浓度 0.3 mmol/L,诱导时间 8 h,诱导温度 28℃),进行OprI表达菌株的蛋白诱导,获得的蛋白条带如图 5所示。将最优化诱导条件结果使用软件Phoretix 1D分析光密度,并与之前实验(图 4)获得的光密度相比较,发现最优化条件获得的光密度高于其它的试验条件(表 10)。证明最优化条件下OprI蛋白得到很好的表达。
 |
| 图 4 OprI 表达菌株IPTG 诱导的正交试验 |
 |
| 图 5 最优化条件下OprI 蛋白的诱导表达 |
由于抗生素广泛应用,铜绿假单胞菌快速产生耐药性,增加致病菌的治疗难度。基因工程疫苗以其无耐药性特点,受到人们高度重视[13, 14]。因而,利用基因工程获得多肽类物质,用于后续的疫苗开发与科学研究尤为重要[15]。
OprI是铜绿假单胞菌主要外膜蛋白,具有很强的免疫原性[5],本实验利用分子克隆获得OprI表达菌株,研究发现其对小鼠的免疫保护率达到显著性的57.14%,为开发OprI蛋白免疫制剂奠定理论基础。
外源基因表达的影响因素很多,但诱导条件的最佳组合往往是唯一的[12]。本实验利用正交实验模型进行铜绿假单胞菌OprI蛋白的表达研究,结果表明,在未诱导时,OprI表达菌株最适培养条件为:葡萄糖浓度0%,转速230 r/min,装液量50 mL;菌体加入IPTG诱导后,最佳蛋白表达条件为:加IPTG时菌液OD600值:0.8;IPTG终浓度:0.3 mmol/L;诱导时间:8 h;诱导温度:28℃。实验证实提高培养基转速增加营养与氧气的供给,利于菌体的生长[16],这与本研究发现的提高转速结果一致。低温诱导利于蛋白表达[12],与本研究结果一致,生产中应采用低温诱导。IPTG具有毒性,不利于菌体蛋白表达[17],结合实际生产中经济角度考虑,可采用低浓度IPTG诱导。合适的诱导时间利于蛋白的表达[18],在工程菌发酵上应采用合适的诱导时间。此外,实验发现最优化条件下OprI的表达量高于其它的实验组合,进一步证实验设计的合理性,为实际生产提供依据。
因而,OprI工程菌蛋白发酵可按两步进行:(1)IPTG诱导前,提高培养基转速加快菌体生长到合适的诱导浓度;(2)IPTG诱导后,选择菌体对数生长中期诱导、低温、低浓度IPTG,以及诱导时间不易过长。 4 结论
本实验获得OprI蛋白的表达菌株;Western-blotting 证实表达的OprI蛋白能与抗体特异性结合;将纯化的OprI蛋白免疫小鼠,发现其激活的特异性免疫对小鼠铜绿假单胞菌感染的保护率达到显著性的57.14%。正交试验获得OprI菌株最佳诱导表达条件为:加IPTG菌夜OD600值0.8,加IPTG终浓度 0.3 mmol/L,诱导时间 8 h,诱导温度 28℃;菌株最佳培养条件为:转速230 r/min,葡萄糖浓度0%,装液量50 mL。
| [1] | 崔钦娜, 李芳, 邢伟越. 铜绿假单胞菌全局调控因子 RsmA 的缺失影响 2 个吩嗪基因簇的表达[J]. 微生物学报, 2012, 52(11):1326-1334. |
| [2] | 黄兴富, 范华. 铜绿假单胞菌的临床分布及对环丙沙星耐药机制的研究[J]. 中国实验诊断, 2013, 18(3):437-440. |
| [3] | 徐立升, 刘明涛, 张芸, 等. 抗菌药联合外排泵抑制剂对铜绿假单胞菌耐药突变选择窗的影响[J]. 中华医学杂志, 94(26):2055-2058. |
| [4] | 朱玉莹, 易勇, 杨犀. 多重耐药铜绿假单胞菌中Ⅰ型整合子新结构的发现及其与耐药的相关性[J]. 微生物学报, 2013, 53(9):927-932. |
| [5] | Loots K, Revets H, Goddeeris BM. Attachment of the outer membrane lipoprotein(OprI)of Pseudomonas aeruginosa to the mucosal surfaces of the respiratory and digestive tract of chickens[J]. Vaccine, 2008, 26(4):546-551. |
| [6] | Weimer ET, Ervin SE, Wozniak DJ, et al. Immunization of young African green monkeys with OprF epitope 8-OprI-type A- and B-flagellin fusion proteins promotes the production of protective antibodies against nonmucoid Pseudomonas aeruginosa[J]. Vaccine, 2009, 27(48):6762-6769. |
| [7] | Rahner R, Eckhardt A, Duchêne M, et al. Protection of immunosuppressed mice against infection with pseudomonas aeruginosa by monoclonal antibodies to outer membrane protein OprI[J]. Infection, 1990, 18(4):242-245. |
| [8] | Rau H, Revets H, Cornelis P, et al. Efficacy and functionality of lipoprotein OprI from Pseudomonas aeruginosa as adjuvant for a subunit vaccine against classical swine fever[J]. Vaccine, 2006, 24(22):4757-4768. |
| [9] | von Specht BU, Lücking HC, Blum B, et al. The Pseudomonas aeruginosa outer membrane protein I vaccine:immunogenicity and safe administration in man[J]. Behring Inst Mitt, 1997, 98:326-337. |
| [10] | Westritschnig K, Hochreiter R, Wallner G, et al. A randomized, placebo-controlled phase I study assessing the safety and immunogenicity of a Pseudomonas aeruginosa hybrid outer membrane protein OprF/I vaccine(IC43)in healthy volunteers[J]. Human Vaccines & Immunotherapeutics, 2014, 10(1):170-183. |
| [11] | 刘祥, 陈春琳, 牟欢, 等. 重组人骨硬化蛋白的表达、纯化及多克隆抗体制备[J]. 生物技术, 2014, 24(6):68-72. |
| [12] | 刘祥. 溶藻弧菌附着定值因子ACFA原核载体构建、表达条件优化及多克隆抗体制备[J]. 华北农学报, 2015, 30(1):35-41. |
| [13] | Stryjewska A, Kiepura K, Librowski T, et al. Biotechnology and genetic engineering in the new drug development. Part Ⅱ monoclonal antibodies, modern vaccines and gene therapy[J]. Pharmacological Reports, 2013, 65(5):1086-1101. |
| [14] | Zhang L, Cai D, Zhao X, et al. Liposomes containing recombinant gp85 protein vaccine against ALV-J in chickens[J]. Vaccine, 2014, 32(21):2452-2456. |
| [15] | Tripathi NK, Priya R, Shrivastava A. Production of recombinant Chikungunya virus envelope 2 protein in Escherichia coli[J]. Applied Microbiology and Biotechnology, 2014, 98(6):2461-2471. |
| [16] | Xu M, Sun Q, Su J. Microbial transformation of geniposide in Gardenia jasminoides Ellis into genipin by Penicillium nigricans[J]. Enzyme and Microbial Technology, 2008, 42(5):440-444. |
| [17] | Corrales-Garcia L, Ortiz E, Castañeda-Delgado J, et al. Bacterial expression and antibiotic activities of recombinant variants of human β-defensins on pathogenic bacteria and M. tuberculosis[J]. Protein Expression and Purification, 2013, 89(1):33-43. |
| [18] | Studier FW. Protein production by auto-induction in high density shaking cultures[J]. Protein Expression and Purification, 2005, 41(1):207-234. |