传统中医理论认为金银花具有清热解毒、疏利咽喉、消暑除烦的功效。新鲜金银花含水量约为80%,颜色嫩绿,但新鲜金银花不利于运输及储存,必须及时干燥。干燥过程极易造成金银花外观颜色严重褐变,同时,其主要功效成分绿原酸和木犀草苷含量明显下降,金银花药用价值损失很大[1]。为探究金银花在干燥过程中酶促褐变的机理,有必要提取分离高纯度的PPO作酶学性质的相关研究。
目前,PPO提取方法有匀浆法和丙酮粉法。匀浆法操作简单,所得酶液活性较强,但多酚类物质残留量较高,酶液纯度偏低。丙酮粉法主要是通过丙酮使细胞膜的磷脂结构破坏,从而改变细胞膜的通透性,再经过提取可使膜结合的PPO或胞内的PPO释放出胞外。相对于匀浆法而言,其酶粉活性尚可、体积小且便于贮存,可直接应用[2]。田玉庭[3]曾用丙酮粉法提取澳洲青苹PPO,经初步纯化后,SDS-PAGE凝胶电泳检测仅显示一条电泳带。Ben-Shalom等[4]用丙酮粉法提取橄榄果实中的PPO,也取得了良好的效果。目前,尚未有响应面优化丙酮粉法提取金银花多酚氧化酶的相关研究报道,本研究对其进行初步探索。 1 材料与方法 1.1 材料
无损伤、未开花、品质良好的新鲜金银花,购于河南省孟津县益丰金银花生产基地,品种为金丰一号。丙酮、磷酸氢二钠、磷酸二氢钠、磷酸、氢氧化钠、邻苯二酚、考马斯亮蓝G-250、牛血清蛋白。以上均为分析纯。
飞利浦HR2850搅拌机、天孚DT510L电子天平、湘仪H1850R冷冻离心机、SHB-Ⅲ循环水式多用真空泵,郑州长城科工贸易有限公司;DYY-6C电泳仪,北京市六一仪器厂;UV2400紫外可见分光光度计,舜宇恒平科学仪器有限公司;PHS-3C PH计,上海越平科学仪器有限公司。 1.2 方法 1.2.1 酶的提取
10 g样品加入一定体积-20℃ 丙酮中,打浆1 min(打10 s停5 s),迅速用布氏漏斗抽滤,将滤饼溶于冷冻丙酮中反复抽滤,至滤饼无色为止。将滤饼置于培养皿中,在室温下干燥,待丙酮完全挥发后,即得丙酮粉。丙酮粉溶于一定pH磷酸盐缓冲液中,静置若干时间,用八层纱布过滤后在冻离心机中离心,取上清液,即为PPO粗酶液[5]。 1.2.2 酶活力的测定
向3 mL pH 7.0的磷酸盐缓冲液和1 mL 0.01 mol/mL的邻苯二酚的混合溶液中加入1 mL PPO粗酶液,混合均匀后,测定其在2 min内420 nm下的吸光度,从加入粗酶液开始计时,每10 s记录一次OD值,用PBS和邻苯二酚混合液为参比,通过最初直线段较稳定的斜率来计算PPO活力[6]。一个酶活力单位(U/mL)定义为:每单位时间内引起吸光度改变0.001所需的酶量。
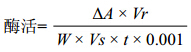
其中,A:吸光度的变化量;Vr:加样缓冲液总体积(mL);Vs:取样比色体积(mL);W:取样质量(g)。 1.2.3 蛋白质浓度的测定
采用Bradford考马斯亮蓝法测定PPO含量,用牛血清蛋白制作标准曲线[7],标准曲线方程为:
y=4.8279x-0.0158,R2=0.9992
其中,y:吸光度,x:蛋白质质量浓度(mg/mL)。 1.2.4 PPO比活力的测定
PPO比活力是指每毫克PPO所具有的活力数。比活力越大,表示PPO的纯度越高[8]。计算公式如下:比活力=活力(U/mL)/蛋白质质量浓度(mg/mL)。 1.2.5 单因素试验 1.2.5.1 缓冲液pH值的选择
按料液比为1:100,取1 g丙酮粉,分别加入100 mL pH为6.0、6.5、7.0、7.5、8.0的PBS中,静置30 min后,8 层纱布过滤。用高速冷冻离心机在4℃、10 000 r/min的条件下离心15 min,分别测定上清液中酶的比活力。 1.2.5.2 料液比的选择
取1 g丙酮粉,分别加入60、100、140、180、220 mL pH为7.5的磷酸盐缓冲液中,静置30 min后,8层纱布过滤。用高速冷冻离心机在4℃、10 000 r/min的条件下离心15 min,分别测定上清液中酶的比活力。 1.2.5.3 提取时间的选择
取1 g丙酮粉,加入料液比1:100,pH为7.5的磷酸盐缓冲液中,分别静置0 min、30 min、1 h、1.5 h、2 h后,八层纱布过滤。用高速冷冻离心机在4℃、10 000 r/min的条件下离心15 min后,测定各上清液中酶的比活力[9, 10, 11]。 1.2.6 丙酮粉法提取金银花PPO工艺响应面实验
根据单因素实验结果,以缓冲液pH值、料液比、提取时间构建二元回归模型,采用响应面分析方法对提取金银花PPO比活力大小的影响进行分析。 2 结果 2.1 缓冲液pH值的影响
由图 1可知,不同pH值的磷酸盐缓冲液提取金银花PPO丙酮粉,所得PPO比活力有明显的差异。当pH小于7.5时,PPO比活力随着缓冲液pH值的增大而增大。当pH到达7.5时,PPO比活力到达一个峰值。当pH大于7.5时,PPO比活力出现明显下降的趋势。
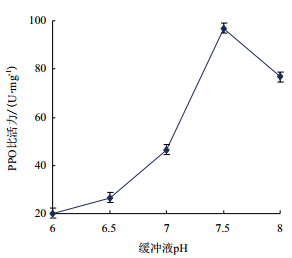 |
| 图 1 缓冲液 pH 值对 PPO 比活力的影响 |
由图 2可知,当料液比大于1:100时,PPO比活力随着料液比的增加上升明显,当料液比小于1:100时,PPO比活力出现了略微下降的趋势后基本保持不变。
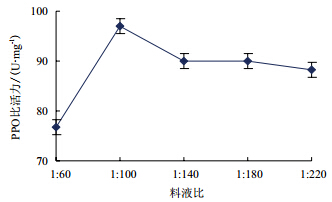 |
| 图 2 料液比对 PPO 比活力的影响 |
由图 3可知,随着提取时间的延长,PPO比活力逐渐增加,15 min时达到峰值。随着提取时间的继续增加,PPO比活力开始下降。可能的原因是随着提取时间的增加,越来越多的PPO溶入到了缓冲液中,比活力随之增加。当在某一时间,PPO完全溶入缓冲液后,随着提取时间的继续增加,受提取环境的影响,本身构相并不稳定的PPO活力开始下降,因此比活力逐渐降低。
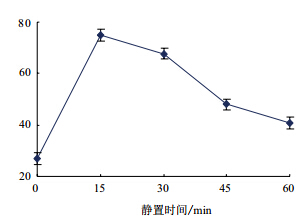 |
| 图 3 提取时间对 PPO 比活力的影响 |
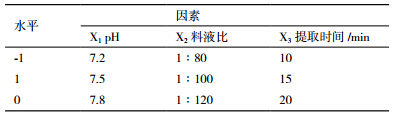
综合单因素实验结果,缓冲液pH值、料液比、提取时间三因素对金银花PPO的比活力有较为明显的影响。根据Box-Behnken的原理,在单因素数据结果的基础上,采取三因素三水平响应面实验设计分析方法,实验因素与水平设计见表 1。
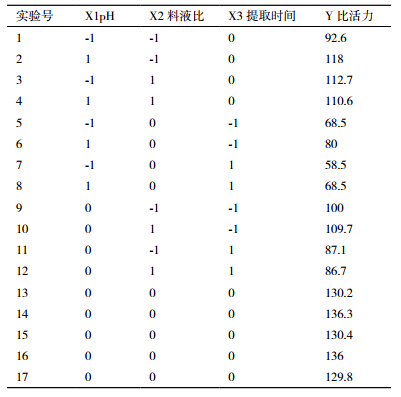
以pH值(X1)、料液比(X2)、提取时间(X3)为自变量,以比活力(Y)为响应值,设计实验方案及结果见表 2。
表 2中17个实验选择分为响应面的析因点和零点,其中序号1到12的实验为析因试验,13到17为中心实验。析因点自变量在由X1、X2、X3因素所构成的三维顶点上取值,零点则在对应区域的中心点。一般情况下,零点实验要重复进行5次,以便于实验的估计误差。由于各因素对比活力的影响均不是简单的线性关系,所以采用Design-Expert软件对表 2的响应值分别进行多元回归拟合,并确定各因素对响应值的影响。各因素回归拟合后,响应变量Y对pH值、料液比、提取时间的二次多项回归模型如下:
Y=-17189.37750+4392.41667X1+8.37625X2+48.72400X3-1.14583X1X2-2.5000X1X3-0.025250X2X3-283.69444X12+3.66875E-0.003X22-1.52530X32。 2.4.4 回归方程的参数评估
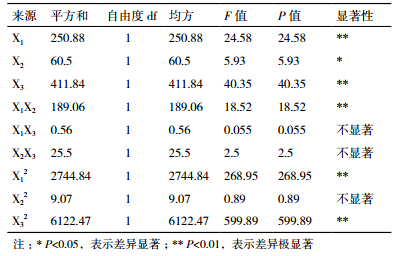
由表 4可知,X1、X3、X1X2、X12、X32对提取金银花PPO比活力影响极显著,X2对提取金银花PPO比活力影响显著。其中,三因素对提取金银花中PPO比活力影响的主次顺序是pH值>浸提时间>料液比。
通过Design-Expert的最优化模型回归分析,得到最佳的提取工艺条件为,pH7.49,料液比1:120、静置时间为14.37 min,此条件下PPO酶的比活力的预测值为137.389 U/mg。为便于实际操作,把最佳提取工艺修正为pH 7.5,料液比1:120、静置时间为14.5 min。
为验证响应面法优化结果的可靠性,在修正条件下,采用丙酮粉法对金银花PPO进行了提取,进行5次验证试验,得到平均比活力为131.732 U/mg,结果与预测值相近。验证表明,拟合模型对于提取金银花PPO比活力的影响有较好的预测能力。 3 讨论 3.1 缓冲液pH值对PPO比活力的影响
PPO在弱碱性条件下构相稳定性最高,活性最大[12];而在酸性或者强碱性条件下,PPO会聚集、变性,从而影响比活力。 3.2 料液比对PPO比活力的影响
料液比过高,使丙酮粉未能完全溶于缓冲液中,提取不彻底造成PPO比活力不高。随着缓冲液体积的增加,丙酮粉中的PPO开始逐渐完全的溶入到缓冲液中,从而比活力增加[13]。当料液比达到一定值时,丙酮粉中PPO和缓冲液的溶合达到一种平衡状态,当料液比继续增加时,PPO可能会从缓冲液中溶出,造成比活力的降低[14]。 3.3 静置时间对PPO比活力的影响
随着提取时间的增加,越来越多的PPO溶入到了缓冲液中,比活力随之增加。当在某一时间,PPO完全溶入缓冲液后,随着提取时间的继续增加,受提取环境的影响,本身构相并不稳定的PPO活力开始下降,因此比活力逐渐降低。 3.4 回归方程的方差分析
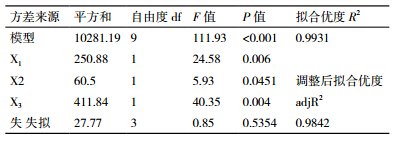
对该模型进行方差分析(表 3),模型的F值为111.93,P值<0.001,远小于一般显著性检验规定(P<0.05为显著,P<0.01为极显著),说明二次多项式模型极显著;失拟项的P值0.5354>0.05,说明模型失拟度不显著。回归方程的拟合度还可通过拟合优度R2和调整后拟合优度adjR2来验证,二次多项式的模型的预测值与试验真实值之间的相关性达99.31%,调整拟合优度98.42%,表明该模型能够解释98.42%响应值的变化,模型拟合程度良好。故可用此模型对丙酮粉法提取PPO粗酶液的比活力的大小进行分析和预测。
如图 4所示,X1、X2在不同程度上对PPO比活力有影响,且二者交互作用极为显著,可能是pH影响酶液的总酶活,料液比影响酶液中酶的浓度。二者的变化,引起了PPO比活力的变化;或者是料液比对酶浓度的影响随着pH值的变化而变化,进而影响PPO比活力的变化。X1、X3对PPO比活力影响最大,但二者交互作用却不显著,可能是pH对酶活性的影响和提取时间对酶浓度的影响的差异不显著。X2X3亦是如此。
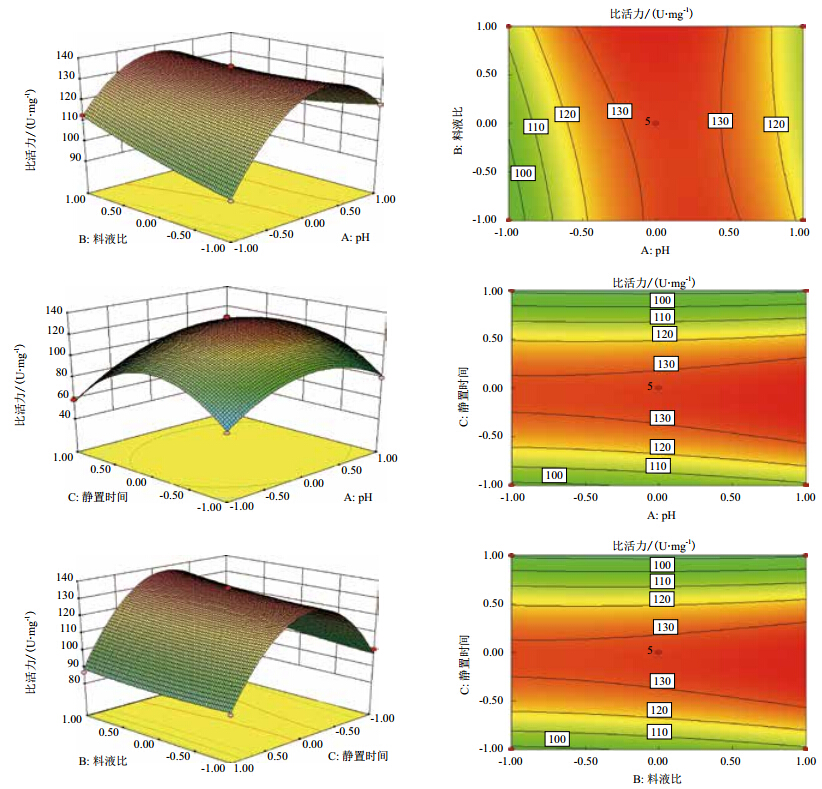 |
| 图 4 缓冲液 pH 值与料液比 pH 与静置时间、 料液比、 与静置时间交互作用的响应面和等高线 |
有文献报道,罗磊等[7]曾用响应面优化匀浆法提取金银花中PPO酶,得到酶的比活力为654.998 U/mg。丙酮粉法虽然对酶活性损失较大,但其酶粉活性尚可,且纯度较高,可直接应用,并为研究PPO酶学性质打下了良好的基础。采用聚丙烯酰胺凝胶电泳对罗磊优化的匀浆法和本试验优化的丙酮粉法提取的粗酶液进行检测[18],结果显示丙酮粉法提取的酶液清晰,在没有进一步提纯的条件下仅有4条谱带;匀浆法提取的酶液谱带较多,且不清晰。由此可见,匀浆法的酶液含有较多的杂蛋白,而丙酮法提取的酶液蛋白纯度较高。因此,为了进一步研究金银花在干燥过程中的褐变机理,应选用丙酮粉法。 4 结论
由单因素试验可知,缓冲液pH值、料液比、提取时间对PPO比活力有显著的影响。构建的二次回归模型,拟合性良好,验证了三因素对PPO比活力影响显著。其中pH值和静置时间极其显著、pH值和料液比交互作用极其显著。
优化条件为缓冲液pH 7.5,料液比为1:120,静置时间为14.5 min,并与验证试验相符。经电泳检测,丙酮粉法提取酶液纯度较匀浆法高,因此选用丙酮粉法提取金银花PPO。
| [1] | 武晓红, 田智勇, 王焕.金银花的研究新进展[J].时珍国医国 药, 2005, 16(12):111-112. |
| [2] | 李立祥, 吴红梅.提取方法对茶多酚氧化酶的影响[J].中国 茶叶加工, 2001, (4):26-31. |
| [3] | 田玉庭, 岳田利, 袁亚宏, 等.澳洲青苹多酚氧化酶的分离纯 化研究[J].食品研究与开发, 2006, 127(5):180-182. |
| [4] | Ben-Shalom N, Kahn V, Harel E, et al.Catechol oxidase from green olivers[J].Properties and Partial Purification Phytochem, 1997, (16):1153-1158. |
| [5] | 施春华.烟草多酚氧化酶的分离纯化, 光谱性质, 反应机理和 应用研究[D].合肥:中国科学技术大学, 2002. |
| [6] | He SL, Liu HX, Zhou SJ, et al.A Preliminary study on poly phenol oxidase extraction from sugarcane juice[C].South China University of Technology (SCUT).Biennial World Conference on Recent Development in Sugar Technologies.Guangzhou:SCUT, 2009, 183-186. |
| [7] | 罗磊, 周燕燕, 刘云宏, 等.响应面法优化金银花多酚氧化酶提 取工艺[J].食品科学, 2014, 35(3):117-121. |
| [8] | 张宽朝, 全明吉.黑豆多酚氧化酶的分离纯化及其酶学性质的 研究[J].中国饲料, 2012(19):38-41. |
| [9] | 刘亮.荔枝果皮多酚氧化酶内源底物的确定及其促褐变机 制[D].武汉:华中农业大学, 2008. |
| [10] | 徐仁华.蒜氨酸酶的分离纯化及其酶学性质研究[D].南昌: 南昌大学, 2008. |
| [11] | 李玲.砀山酥梨果实PPO酶学特性、PPO克隆及生物信息学 分析[D].合肥:安徽农业大学, 2011. |
| [12] | Kouakou TH, Kouadio YJ, Kouamé P, et al.Purification and biochemical characterization of polyphenol oxidases from embryogenic and nonembryogenic cotton (Gossypium hirsutum L.) cells[J].Appl Biochem Biotechnol, 2009, 158:285-301. |
| [13] | 王磊.马铃薯酶促褐变机理研究[D].南昌:南昌大学, 2012. |
| [14] | Gao ZJ, Han XH, Xiao XG.Purification and characterisation of polyphenol oxidase from red Swiss chard[J].Food Chemistry, 2009(117):342-348. |
| [15] | 孟雅, 李刚, 崔焱, 张龙.马铃薯多酚氧化酶的提取纯化条件 对其活性影响的研究[J].化学与生物工程, 2006, 23(10): 47-49. |
| [16] | 刘文山, 肖凯军, 郭祀远.苹果多酚氧化酶的提取及其抑制作 用的研究[J].现代食品科技, 2006, 22(4):82-84. |
| [17] | 王丽霞.中华芦荟多酚氧化酶的分离纯化[J].淮阴师范学 院学报:自然科学版, 2008, 7(4):319-321. |
| [18] | 胡燕妮.杨桃果实多酚氧化酶的研究[D].南宁:广西大学, 2008. |