2. 河南仰韶生化工程有限公司,渑池 472400
2. Henan Yangshao Biochemical Engineering Company, Mianchi 472400
α-淀粉酶可从淀粉分子内部切开α-1,4 糖苷键,生成糊精和还原糖,广泛应用于食品、酿造、制药、纺织及石油开采等诸多领域,在工业生产中有极其重要的地位,是目前用途较广泛的一种酶制剂[1, 2]。目前工业应用的α-淀粉酶主要来源于细菌和丝状真菌[3, 4],在原始菌株中,真菌来源的α-淀粉酶被发现比细菌更稳定[5]。国外对酸性α-淀粉酶的研究起步较早,1963年日本Yasuji等[6]发现可用真菌生产酸性α-淀粉酶。在酵母菌中也发现了部分能产生高酶活α-淀粉酶的菌株[7]。我国对产α-淀粉酶菌株的研究起步较晚,尤其是耐酸性α-淀粉酶。目前,国际上一些大的酶制剂公司生产耐酸α-淀粉酶的菌种50%是基因工程菌[8]。近年来,已发现数十株优良产α-淀粉酶菌,包括耶鲁维亚酵母(Yarrowia)、类酵母(Aureobasidium)、毕赤氏酵母(Pichia)、假丝酵母(Candida)、红酵母(Rhotolorula)等[9],对酵母菌应用于工业生产α-淀粉酶有了进一步推动[10]。本研究筛选出一株耐酸性α-淀粉酶酵母菌株,研究且优化其发酵条件,旨在为工业利用提供参考。 1 材料与方法 1.1 材料 1.1.1 土壤样品
河南省偃师某面粉厂污水排出口处采集土壤样品。4℃保存备用。 1.1.2 培养基
筛选培养基(g/L)[1]:牛肉膏 3,蛋白胨 10,NaCl 5,可溶性淀粉 10,琼脂粉 15,pH 5.0。种子及发酵培养基(g/L)[11]:胰蛋白胨5,可溶性淀粉10,(NH4)2SO4 2.5,KH2PO4 3,CaCl2 0.2,pH调至5.0。 1.2 方法 1.2.1 酸性α-淀粉酶产生菌的分离筛选
初筛:土壤样品,10倍梯度稀释法涂布于筛选培养基,28℃恒温培养。滴加碘液,记录有透明圈的菌株。复筛:将初筛有透明圈的菌株,接种种子培养基,37℃、200 r/min培养12 h,以10%的接种量转至发酵培养基,相同条件培养24 h。发酵液5 000 r/min离心15 min,上清为粗酶液,测定酶活[1]。 1.2.2 淀粉酶活力测定方法
Yoo酶活测定法[12, 13]稍加改进:2.5 mL 0.5%可溶性淀粉溶液与2.5 mL柠檬酸-磷酸盐缓冲液(pH5.0)50℃恒温水浴锅预热10 min,加入酶液0.5 mL,50℃下准确反应10 min,加入5 mL 0.1 mol/L的盐酸终止反应,取上述混合液0.5 mL与5 mL碘液混匀,660 nm测定吸光度值R(以2.5 mL蒸馏水代替可溶性淀粉溶液,其余条件相同作为空白)。在上述反应条件下,以0.5 mL的缓冲液代替0.5 mL酶液,测定吸光度值R0[11]。
酶活定义:50℃、pH5.0条件下,10 min水解1 mg淀粉所需的酶量为一个酶活力单位。
酶活公式:待测酶活(U/mg)=100*D*(R0-R)/R
其中,D:稀释倍数,R0:对照吸光值,R:酶液的吸光值,100:转换系数。 1.2.3 菌种ITS序列鉴定 1.2.3.1 分子试剂及引物
Taq mix(TaKaRa)、ITS4引物5′-3′:ggAAgTAAAAgTCgTAACAAgg、ITS5引物5′-3′:TCCTCCgCTTATTgATATgC。 1.2.3.2 基因系统发育鉴定
基因组总DNA的提取参考文献[14]进行。ITS序列PCR扩增反应体系:Taq mix 12.5 μL,ITS4 0.5 μL,ITS5 0.5 μL,ddH2O 9 μL,基因组DNA模板2.5 μL,总体积25 μL。反应过程:95℃ 5 min,30次循环(94℃ 30 s,55℃ 1 min,72℃ 1 min),72℃ 10 min。PCR产物测定核苷酸序列,GenBank数据库完成BLAST比对。 1.2.4 酶学性质研究
37℃、200 r/min培养48 h的发酵液上清作为粗酶,pH3.8、4.0、4.5、5.0、6.0、7.0、8.0的缓冲条件,分别测定酶活以确定pH范围。设置30、37、45、50、55、60、70和80℃温度条件测定酶活以确定温度耐受性。 1.2.5 产酶发酵条件研究 1.2.5.1 菌株产酶曲线
种子液10 mL接种到100 mL发酵培养基,从3 h开始每小时测定酶活,以培养时间为横坐标,酶活力为纵坐标绘制产酶曲线。 1.2.5.2 温度对菌株产酶的影响
以5%的接种量将种子液接至100 mL发酵培养基,分别28、37、40℃振荡培养,从产酶高峰期开始每小时测定酶活。 1.2.5.3 初始pH对菌株产酶的影响
调节发酵培养基初始pH值为4.5、5.0、5.5、6.0,接入5%种子液,37℃、200 r/min培养,在产酶高峰期取样,测定酶活。 1.2.5.4 碳源对菌株产酶的影响
分别以0.5%葡萄糖、蔗糖、乳糖、可溶性淀粉作为碳源,5%的接种量至100 mL发酵培养基中,37℃、200 r/min培养,在产酶高峰期测定酶活[15]。 1.2.5.5 氮源对菌株产酶的影响
分别以0.5%蛋白胨、棉籽饼、黄豆饼、牛肉膏作为氮源,5%的接种量至100 mL发酵培养基中,37℃、200 r/min培养,在产酶高峰期测定酶活。 1.2.5.6 装液量对菌株产酶的影响
在500 mL三角瓶中分别装入50、100、150、200 mL发酵培养基,接入5%的种子液,37℃、200 r/min培养,在产酶高峰期测定酶活。 1.2.6 正交试验
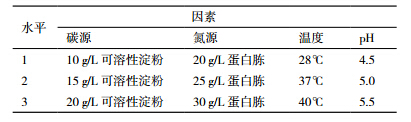
根据单因素优化实验结果,针对碳源、氮源、温度和pH,经SPSS软件设计四因素三水平正交实验[16]。 2 结果 2.1 菌株筛选
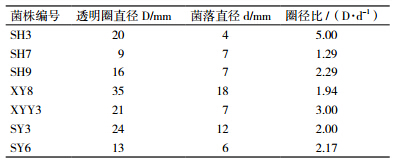
共筛选出产酸性α-淀粉酶的菌株24株,部分筛选结果见表 1,其中初筛SH3菌株,透明圈/菌落直径比最大,D/d为5,选其作为实验菌株。
PCR扩增菌株18S ITS基因片段,测序后GenBank序列比对,结果与红酵母属(Rhodotorula sp.)的序列同源性最高,为97%(AM901697)-98%(NR073315),基本确定为酵母菌。 2.3 产酶曲线
产酶曲线见图 1,由图 1可见酶活先上升后下降,在14 h酶活达到91.4 U/mg,此后酶活迅速下降,12-15 h是高酶活时期。
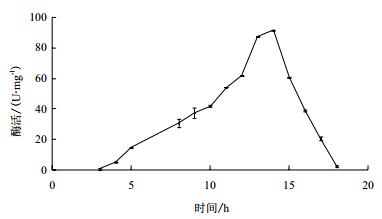 |
| 图 1 SH3 菌株产酶曲线图 |
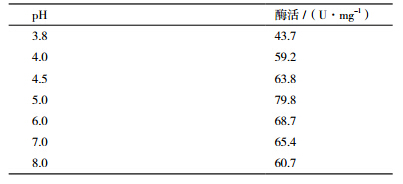
50℃、不同pH下测定菌株SH3的α-淀粉酶活力,结果如表 2所示。SH3所产淀粉酶活力受酸碱度影响较大,该酶在pH3.8-8.0之间均有酶活,在偏酸性条件下酶活力较高,pH5.0为酶反应最适pH,酶活为79.8 U/mg。
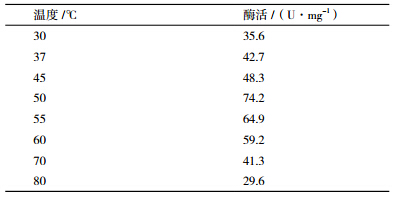
pH5.0、不同温度下测定SH3酶活力,结果由表 3可知,该酶在30℃-80℃均有酶活,30℃-50℃酶活力随温度升高而升高,最适作用温度为50℃,酶活力为74.2 U/mg。
28℃、37℃、40℃发酵条件下研究温度对菌株SH3产酶的影响,结果(图 2)表明,37℃和40℃酶活均是先上升后下降,37℃酶活14 h达到最高91.6 U/mg,40℃酶活与37℃相比上升较快,13 h达到最高91.3 U/mg,但下降也较快。28℃菌体生长缓慢,高活性酶活出现较晚。可能随温度升高生长代谢加快,产酶高峰期提前。选取37℃作为最佳发酵温度。
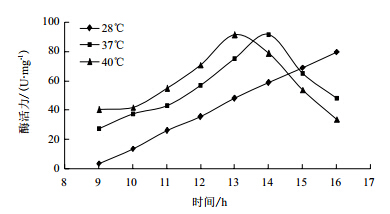 |
| 图 2 温度对产酶的影响 |
由图 3可知,在发酵高峰期,相同时间内200 mL装液量的发酵酶活最高,14 h时达到最高88.2 U/mg。
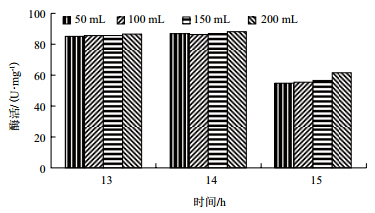 |
| 图 3 装液量对菌株产酶影响 |
选取pH4.5、5.0、5.5、6.0的初始培养条件,分别测定SH3酶活力,结果(图 4)表明,pH4.5-6.0条件下菌体均能生长,发酵14 h时测定酶活,pH5.0发酵条件下酶活最高,为89.7 U/mg,依次高于pH5.5、6.0和4.5,其中pH4.5发酵条件下酶活相对最低,为33.4 U/mg。
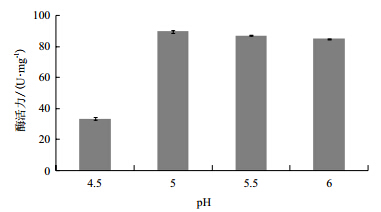 |
| 图 4 初始培养基 pH 条件对产酶的影响 |
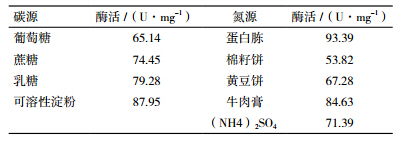
由表 4可知,可溶性淀粉作为培养基碳源时酶活最高,为87.95 U/mg,葡萄糖作碳源时酶活最低。而氮源中蛋白胨为最佳氮源,酶活最高达到93.39 U/mg,棉籽饼作氮源时酶活最低,为53.82 U/mg。
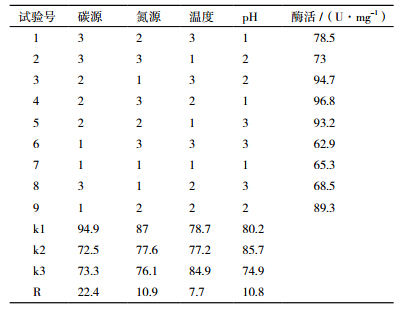
在单因素的基础上,对可溶性淀粉、蛋白胨、初始温度与pH四因素作三水平正交试验(表 5)。由表 6可知,最佳发酵条件为可溶性淀粉15 g/L、蛋白胨30 g/L、37℃、pH4.5,对应酶活最高为96.8 U/mg。极差分析结果可看出,碳源对菌株产酶的影响最大,影响程度依次为:可溶性淀粉>蛋白胨>pH>温度。
酶α-淀粉酶是基于淀粉糖原料生产产品过程中使用的主要糖酶,在全球酶制剂产业中占30%左右[17, 18]。传统α-淀粉酶最适作用pH值为5.8-6.2,而淀粉乳偏酸性(pH3.2-4.5),进一步糖化也是在酸性条件(pH4.2-4.5)下进行,即液化前后需两次调pH,影响产品提取,不利于节能减排。耐酸耐高温α-淀粉酶可有效解决这一问题,需求量越来越大,已在欧美等发达国家得到广泛应用,但菌种选育等核心技术也被国外跨国公司所垄断。我国缺乏高产菌株,尚不能自主生产。
现阶段筛选得到的产酸性α-淀粉酶菌株主要是芽孢杆菌和曲霉[20, 21, 22],普遍存在产酶水平较低的问题,仍需在自然界筛选高酶活菌株,并进一步优化耐酸、耐高温性能。采用基因工程技术对功能基因进行定向改造,构建工程菌,是选育高产、高性能菌株的重要途径[19]。 4 结论
从土壤样品中分离到一株产酸性α-淀粉酶菌株SH3,该菌18S ITS序列与红酵母菌相似性97%。其酶活性最适作用pH5.0,最适作用温度50℃。最佳发酵条件为可溶性淀粉15 g/L、蛋白胨30 g/L、37℃、pH4.5,对应酶活力96.8 U/mg。
| [1] | 张丽靖,沈江峰,金庆超,等. 一株酸性淀粉酶产生菌的分离、鉴定及酶学特性初步研究[J]. 生物技术通报,2011(5):142-145. |
| [2] | 谢建华,师永生,杜丽琴,等. 一株产酸性α-淀粉酶菌株的筛选、纯化及酶学性质[J]. 应用与环境生物学报,2011,17(1):95-99. |
| [3] | Gupta R,Gigras P,Mohapatra H,et al. Microbial α-amylases:a biotechnological perspective[J]. Process Biochemistry,2003,38(11):1599-1616. |
| [4] | 李松,王正祥. 真菌α-淀粉酶的研究进展[J]. 生物技术通报,2011(3):66-70. |
| [5] | 姚清,陈建华. 新型α-淀粉酶的研究进展[J]. 药物生物技术,2013,20(6):553-555. |
| [6] | Yasuji M. Acid-stable-amylase of black aspergilla partⅡ[J]. Agricultural and Biological Chemistry,1968,32(1):104-109. |
| [7] | Augustin J,Zemek J,Kocková-Kratochvílová A,et al. Production of α-amylase by yeasts and yeast-like organisms[J]. Folia Microbiologica,1978,23:353-361. |
| [8] | 王琦. 耐高温α-淀粉酶基因改造研究进展[J]. 食品研究与开发,2013,34(5):133-136. |
| [9] | 池振明,龚方,李静,等. 海洋酵母菌胞外酶及其基因的最新研究进展[J]. 中国海洋大学学报,2008,38(5):766-774. |
| [10] | Li H,Chi Z,Wang X,et al. Amylase production by the marine yeast Aureobasidium pullulans N13d[J]. Journal of Ocean University of China,2007,6:60-65. |
| [11] | 潘涛. 一株酸性α淀粉酶产生菌的筛选、发酵条件及基因克隆研究[D]. 郑州:河南工业大学,2010. |
| [12] | 李翠香,胡元森,潘涛. 一株耐酸性α-淀粉酶产生菌的分离鉴定及发酵条件研究[J]. 河南工业大学学报:自然科学版,2009,30(2):51-54. |
| [13] | Yoo YJ,Hatch RT. Comparison of alpha-amylase activities from different assay methods[J]. Biotechnology and Bioengineering,1987,30:147-151. |
| [14] | 吴文婷. 地芽孢杆菌CHB1产高温酶液态发酵条件优化及其粗酶液性质初探[D]. 福州:福建农林大学,2012. |
| [15] | 朱中南,郑毅,章淑妹,等. α-淀粉酶发酵条件的优化[J]. 海峡科学,2011,60(12):23-25. |
| [16] | 卢纹岱. SPSS for Windows统计分析[M]. 第3版. 北京:电子工业出版社,2006. |
| [17] | Sanchez S,Demain AL. Enzymes and bioconversions of industrial,pharmaceutical,and biotechnological significance[J]. Organic Process Research & Development,2011,15(11):224-230. |
| [18] | Hashemi M,Shojaosadati SA,Razavi SH,et al. The efficiency of temperature-shift strategy to improve the production of α-amylase by Bacillus sp. in a solid-state fermentation system[J]. Food and Bioprocess Technology,2012,5:1093-1099. |
| [19] | Sharma A,Satyanarayana T. High maltose-forming,Ca2+-independent and acid stable α-amylase from a novel acidophilic bacterium,Bacillus acidicola[J]. Biotechnology Letters,2010,32:1503-1507. |
| [20] | 黄伟,刘永乐,王发祥,等. 原生质诱变选育高产酸性α-淀粉酶黑曲霉菌株[J]. 食品工业科技,2014,3:160-167. |
| [21] | Sharma A,Satyanarayana T. Microbial acid-stable α-amylases:characteristics,genetic engineering and applications[J]. Process Biochemistry,2013,48:201-211. |
| [22] | 王建玲,陈志鑫,刘逸寒,等. 产耐酸性α-淀粉酶菌株的分离、鉴定、酶学特性研究及发酵培养基的优化[J]. 生物技术通报,2014(4):133-136. |