磷是植物生长过程中的一种主要营养元素,在土壤中主要以难溶的矿物形态存在[1]。我国土壤全磷含量较高,耕地土壤一般为0.02%-0.11%[2],但是能被植物直接吸收利用的有效磷含量一般不超过全磷量的5%[3]。大部分磷肥与土壤中的 Ca2+、Fe 3+、Fe 2+、Al 3+等结合,形成难溶性磷酸盐,因此全国74%的耕地土壤缺磷,严重影响着植物生长。长期以来,为了提高农产品的产量,人们大量使用化学肥料和农药,磷肥在施用后往往很快就被固定形成无效态磷[4, 5],造成了作物的低吸收和磷元素在土壤中的大量积累[6]。有机磷农药的有效利用率也仅为20%-30%,水田中施用的有机磷农药几乎有90%左右都残留在农田中[7, 8],这些难溶或不溶性的有机磷化合物造成了严重的环境污染。
解磷菌能使土壤中难溶性或不溶性的磷转化成易于被植物吸收利用的磷,从而提高土壤供磷水平[9],同时还能促进农作物对植物根系锌、铜等其它营养元素的吸收、增强植物抗病能力,并减少环境污染[10]。目前报道的解磷菌主要有细菌[11]、真菌[12]和放线菌[13],研究较多的是细菌。乐果(dimethoate)是广泛使用的有机磷农药之一,为中等毒性、内吸性有机磷类杀虫剂、杀螨剂,在土壤中很容易沉降聚集,污染农畜渔果产品,并通过食物链的富集作用转移到人体,对人体产生危害[14]。目前分离到的乐果降解菌有蜡状芽孢杆菌(Bacillus cereus)[15],铜绿假单胞菌(Pseudomonas aerugin-osa)[16],即绿脓杆菌,不动菌属(Acinetobacter)[17],沙门氏菌、阴沟肠杆菌、枯草芽孢杆菌[18]等。
有机磷降解菌不仅种类繁多,并且对于不同的土壤、水域和植物的类型,解磷机制也不尽相同[19, 20]。有机磷降解酶主要是水解酶类,通过切断有机磷化合物中如:P-O键、P-F 键、P-S 键、P-CN等分子键,使之成为无毒的、溶于水的小分子,而且一种有机磷降解酶往往能降解多种有机磷化合物[21]。本研究从大豆土壤中分离到一株可降解卵磷脂的有机磷解磷菌,命名为Yj1,经过16S rDNA鉴定后对其生物学特性进行研究时发现,该菌株还可以有效降解乐果。进一步对该菌株降解卵磷脂和乐果的特性进行研究,以期为土壤中有机磷化合物的有效利用以及有机磷农药的降解提供有效菌源,并为有机磷解磷菌剂的开发与应用提供基础数据。 1 材料与方法 1.1 材料
供试土壤大豆根际土壤于2013年2月,从吉林农业大学大豆试验田(经度125°19′、纬度43°43′)进行采集,4℃保存。 1.2 方法 1.2.1 菌株的筛选与纯化
取1 g土壤样品,加入100 mL灭菌的有机磷液体培养基,30℃,135 r/min摇床培养。培养10 d后,取1 mL悬浊液逐级稀释至10-2、10-3、10-4、10-5、10-6,分别取以上各浓度样品100 µL涂布于以卵磷脂为有机磷源的固体培养基,30℃培养24-48 h。选择有较大溶磷圈的单菌落,反复纯化4次,直至形成均一的菌落,将其转至斜面培养至菌苔长出,置于4℃保存。 1.2.2 菌株鉴定
将纯化后的有机磷解磷菌单菌落接种至LB液体培养基中,135 r/min,30℃恒温培养过夜,12 000 r/min、4℃离心10 min,收集菌体。进行细菌总DNA的提取,具体方法参照萨姆克鲁斯 J 拉塞尔[22]的方法。以菌株总DNA为模板,利用细菌16S rDNA通用引物进行PCR,引物序列:R:5′-AAGGAGGTGATCCAGCC-3′,F:5′-AGAGTTTGA-TCCTGGCTCAG-3′。反应条件:98℃预变性5 min;94℃变性45 s,57℃退火45 s,72℃延伸2 min,33个循环;后延伸7 min,4℃保存。反应体系为:模板0.2 μL,上下游引物F、R各0.2 μL,LA Taq buffer 2 μL,dNTPs(2.5 mmol/L)2 μL,eTaq聚合酶0.2 μL,无菌去离子水补至20 μL。PCR产物经1%琼脂糖凝胶电泳鉴定。同时将产物纯化回收后,送上海生物工程有限公司进行测序。测序序列与GenBank进行BLAST同源性比较,并利用Mega5.10软件与相关菌株的16S rDNA构建系统发育树。 1.2.3 菌株生长条件的优化
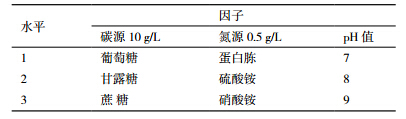
以有机磷培养基为基础,对碳源、氮源及pH值进行优化,采用L933正交设计试验优化,供试因素及水平见表 1。挑取Yj1单菌落接种于5 mL LB培养基中,OD600=0.6时,种子液按1%接种量接种于以大豆卵磷脂为有机磷源的培养基中,30℃,150 r/min培养72 h,每隔6 h取样,利用分光光度计测定OD600的吸光值。并对36 h生长量数据采用SPSS16. 0统计软件和Excel进行方差的分析,进而确定碳源、氮源及pH值的最佳组合。
以正交试验中确定的最佳培养条件为基础,以大豆卵磷脂、乐果为有机磷源的未接菌培养基为对照。另取150 μL 种子液(种子液的制备同上)分别接入150 mL两种磷源的有机磷培养基,30℃,150 r/min进行培养,每12 h取样一次,测定OD600的吸光值。
1.2.5 酸性磷酸酶和碱性磷酸酶活性的测定 该酶活测定按照伊鋆[23]的方法进行。酶活测定菌体培养同上,每隔12 h吸取1 mL发酵液,加入pH值为6.5的MUB试剂,再加0.025 mol/L对硝基苯磷酸二钠溶液1 mL,震荡10 s。37℃反应1 h后,加入1 mL 0.5 mol/L氯化钙溶液和4 mL 0.5 mol/L 氢氧化钠溶液,震荡并过滤悬液。将滤液在420 nm处比色,此为酸性磷酸酶活性测定方法;碱性磷酸酶时所用MUB试剂pH为8.0,其它步骤同酸性磷酸酶测定方法。酸性、碱性磷酸酶时以A420/min光吸收值增加0.001为一个酶活力单位。
1.2.6 有机磷降解酶活性的测定 该酶活测定按照金彬明[24]的方法进行。菌液的培养同上,每隔12 h取菌液0.9 mL,8 000 r/min 离心2 min,去上清,用0.9 mL pH 7.5的20 mmol/L的Tris-HCl悬起,为粗酶液。
取0.1 mL的0.05 mol/L乐果溶液、0.9 mL的粗酶液与比色管中,25℃下反应45 min,加入1 mL 10%三氯乙酸终止反应,在加入1 mL 10%碳酸钠溶液显色,测定A405光吸收值。有机磷降解酶时以A405/min光吸收值增加0.001为一个酶活力单位。
1.2.7 有机磷降解酶的纯化 将OD600=0.6 的Yj1种子液以1‰的量接入1 L 卵磷脂为磷源的有机磷培养基中,30℃,150 r/min,培养48 h后4℃、4 000 r/min离心30 min离心收集菌体。每克菌以15 mL 20 mmol/L的Tris-HCl(pH7.5)缓冲液悬起,每毫升溶液加入1 mg溶菌酶充分搅拌后4℃静置30 min,冰浴超声波破碎(1 400 W、工作5 s、间歇9 s、50次循环)。4℃下10 000 r/min离心20 min。取上清逐步进行10%、20%、40%和65%的硫酸铵沉淀。沉淀用40 mL的Tris-HCl(20 mmol/L pH7.5)缓冲液悬起后,进行Sephadex G-25 Fine层析柱脱盐,取流川液再进行阳离子交换层析(SP Sepharose Fast Flow),分别以含有0.1 mol/L、0.2 mol/L和0.5 mol/L三个浓度NaCl的Tris-HCl(20 mmol/L,pH7.5)进行阶段洗脱;利用层析系统(AKTAPRIME)检测流出组分。取流川及出峰时的流出液体进行有机磷降解酶活力测定,酶活测定方法同上。其中0.2 mol/L NaCl的Tris-HCl洗脱液的流出组分具有有机磷降解酶活性,SDS-PAGE检测分离结果。
2 结果
2.1 有机磷解磷菌的分离与纯化
以大豆卵磷脂为磷源,从吉林农业大学大豆试验田土壤中分离到一株具有明显解磷效果的菌株,将该菌株命名为Yj1。在以大豆卵磷脂(图 1-A)和乐果(图 1-B)为有机磷源的固体培养基中生长时,均有明显透明圈。对该菌株的降解稳定性进行实验,经过多次的连续传代实验,菌株遗传特性比较稳定。
以菌株Yj1的基因组DNA为模板,利用细菌16S rDNA引物进行PCR扩增,得到长度约为1.5 kb的扩增产物。对其进行回收,并测序。将测序序列利用GenBank DNA 数据库进行BLAST同源性比较,结果表明该菌株基因序列与Serratia marcescens WW4(CP003959.1)有较高的同源性,相似度为99%,因此该菌株被鉴定为沙雷氏菌(Serratia marcescens)。
利用Mega5.10构建了Yj1与文献中相关有机磷农药降解细菌的系统发育树。由图 2可知,31株溶磷菌的16SrDNA序列在系统发育树中主要分为两个大的分支。其中,构成第一个分支的菌以芽孢杆菌属为主体;第二个分支菌株以假单胞菌属为主体。Yj1属于第一个分支,与芽孢杆菌属和假单胞菌属形成一簇。
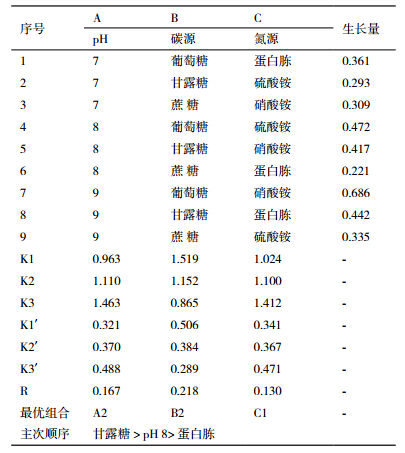
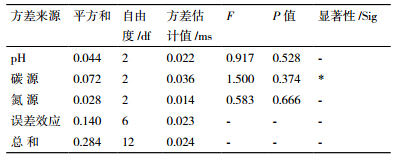
对Yj1菌株生长条件中pH值、碳源、氮源进行3因素、3水平的正交试验,结果如表 2,对所得结果进行方差分析(表 3)。从表 2看出,pH值、碳源、氮源对Yj1的生长均有影响。培养基的初始pH值在一定程度上影响菌株的生长量,pH值为8时菌株生长量最大。在以甘露糖为碳源时,菌株生长量最大,葡萄糖和蔗糖为碳源时菌株生长量较低。氮源不同菌株的生长量明显不同,菌株在以蛋白胨为氮源时生长量最高,硝酸铵、硫酸铵为氮源时生长量低于前者。综合正交试验结果与方差分析结果表明,影响供试菌株生长量的主次顺序为碳源>pH值>氮源,本试验的最优组合为A2B2C1,即为甘露糖、pH8、蛋白胨。
以大豆卵磷脂和乐果分别为磷源时,Yj1的生长曲线见图 3。从图 3可以看出,在以两种有机磷化合物为磷源的培养基中生长时,菌体生长曲线均呈现先增加后下降的趋势。大豆卵磷脂为磷源时,24 h菌体生长进入平台期。在开始的48 h菌体生长量达到最大。乐果为磷源时,菌体初期生长率要明显低于大豆卵磷脂中的生长率,60 h菌体生长量达到最大值,之后呈现下降趋势。两种磷源条件下,菌株生长量均很低,OD600值不超过0.4。但是72 h内以大豆卵磷脂为磷源时的菌体生长情况优于乐果。
当以大豆卵磷脂为磷源测定酸性磷酸酶、碱性磷酸酶与有机磷降解酶活性时,酶活性均呈先增长后下降的趋势(图 4),酸性磷酸酶、碱性磷酸酶和有机磷降解酶分别在36、12和48 h出现峰值,酶活分别为948 IU、694 IU和301 IU。72 h内有机磷降解酶活性低于酸性磷酸酶和碱性磷酸酶的活性。
当以乐果为磷源时,酸性磷酸酶活性最大值出现的时间与大豆卵磷脂为磷源时相同。而碱性磷酸酶和有机磷降解酶活性出峰时间与大豆卵磷脂明显不同,分别是60 h和12 h。72 h内碱性磷酸酶活性一直都依次高于酸性磷酸酶和有机磷降解酶。而且从图 4可看出,72 h内以大豆卵磷脂为磷源时的酸性磷酸酶、碱性磷酸酶活性与有机磷降解酶活性明显高于以乐果为磷源时的酶活。
2.6 有机磷降解酶的纯化及酶活分析
为了进一步明确Yj1菌株中有机磷降解酶的特性,收集以大豆卵磷脂为磷源、生长48 h Yj1所有菌体,超声波破碎后进行硫酸氨沉淀以及阳离子交换层析分离纯化,并对有机磷降解酶活性进行测定。结果(图 5)表明,在65%硫酸铵的沉淀中测得有机磷降解酶的活性,过G-25脱盐柱后在阳离子交换层析过程中,0.2 mol氯化钠洗脱液中酶活较强。以SDS-PAGE检测蛋白结果显示纯化的蛋白为单一条带。
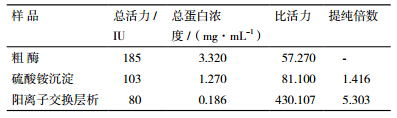
对分级纯化的酶液进行酶活测定,结果见表 4。粗酶、硫酸铵沉淀以及阳离子交换洗脱液有机磷降解酶的比活力分别为57.270、81.100和430.107。提纯倍数相比,阳离子交换层析是硫酸氨沉淀的5.303倍,硫酸氨沉淀仅为粗酶的1.416倍。
田间长期施用磷肥及农药在造成土壤中磷素积累的同时,对环境也造成了极大的污染。解磷微生物可以有效的分解土壤中的无效态磷,释放植物可以吸收利用的磷素[25]。研究发现,假单胞菌属(Pseudomonas sp.)LPx[26]和副球菌属(Paracoccus sp.)L3[13]能够降解乐果;降解毒死蜱的有人苍白杆菌(Ochrobactrum anthropi)CP1[27]、假单胞菌属(Pseudomonas sp.)CP6[27]和伯克霍尔德氏菌属(Burkholderia sp.)CP7[27];生丝微菌属(Hyphomicrobium sp.)MAP-1[27]和甲基杆菌属(Methylobacterium sp.)MAP-2[28]能够降解甲胺磷;寡养单胞菌(Stenotrophomonas sp.)PF32[29]能够降解甲基对硫磷,黏质沙雷氏菌(Serratia marcescens strain)HL1[30]、DAP33[30]和B4[30]等。本实验从大豆根际土壤中分离得到的沙雷氏菌(Serratia marcescens)Yj1除了能够降解大豆卵磷脂之外,对有机磷农药乐果也具有一定的降解能力。
碳源,氮源和pH值在一定程度上影响着微生物的生长。赵小蓉[31]研究发现,曲霉 2TCiF2 在蔗糖为碳源时溶磷活力最高,节杆菌1TCRi7 只有在葡萄糖为碳源时才具有溶磷能力。陈燕飞[32]研究显示,大肠杆菌和金黄色葡萄球菌均在pH为7的条件下生长情况最佳。本实验以碳源、氮源和pH值为因素进行了三因素三水平的正交试验,对菌株的发酵条件进行优化。得出影响供试菌株生长量的主次顺序为碳源> pH值>氮源。这与曲霉 2TCiF2的碳源生长条件实验结果一致。
钟传青等[33]研究表明,解磷微生物产生的植酸酶、核酸酶和磷酸酶等加速了植酸、核酸、磷脂等含磷有机化合物的分解,促进磷素释放,可以提高植物磷素营养,且贫磷条件可以促进酸性和碱性磷酸酶活性的增加。目前,关于酸性磷酸酶与碱性磷酸酶特性的研究较多[34]。本实验对大豆卵磷脂和乐果为磷源时的酸性磷酸酶、碱性磷酸酶与有机磷降解酶的活性进行了测定。结果表明,两种磷源条件下0-72 h内,有机磷降解酶的活性低于酸性磷酸酶和碱性磷酸酶,在48 h,大豆卵磷脂为磷源时的有机磷降解酶活性高是乐果为磷源时的6倍。
刘玉焕等[35]从曲霉菌中分离纯化出有机磷农药降解酶,此酶对有机磷农药乐果具有较好降解作用。金彬明等[24]从海洋微生物 M-1 中分离纯化出有机磷降解酶,最适pH7.5。Munnecke[36]发现有机磷农药降解酶的降解效果远远胜于微生物本身,特别是对低浓度的农药。因此,有机磷农药降解酶目前已被公认为是消除农药残留的最有潜力的新方法。所以本实验以大豆卵磷脂为磷源,通过硫酸铵沉淀法和阳离子交换层析法对有机磷降解酶进行了纯化,提纯后的酶活分别为粗酶活的1.416和7.510倍。与金彬明所纯化出的能够降解甲基对硫磷的有机磷降解酶不同,本实验所纯化出的能够降解乐果的有机磷降解酶与阳离子交换柱结合,带正电荷,且此蛋白对有机农药乐果有较好的降解作用。
4 结论
本实验从大豆土壤中筛选并纯化得到了一株具有稳定降解有机磷的沙雷氏菌(Serratia marcescens)Yj1。该菌株的最佳培养条件为:pH8,以甘露糖为碳源,以蛋白胨为氮源。以大豆卵磷脂为有机磷源时菌体生长良好。碱性磷酸酶的活性优于酸性磷酸酶以及有机磷降解酶的活性。通过硫酸铵沉淀法和阳离子交换层析法,从Yj1菌体纯化获得了单一条带的有机磷降解酶。
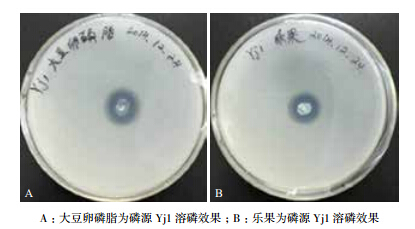
图 1 大豆卵磷脂和乐果为磷源 Yj1 溶磷效果 
图 2 Yj1 系统发育树构建 
图 3 不同磷源时菌株 Yj1 生长曲线 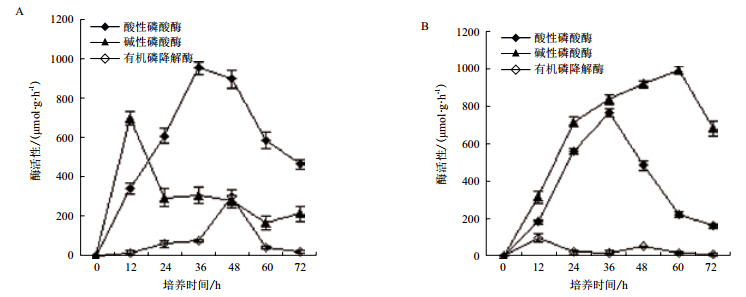
图 4 大豆卵磷脂(A) 和乐果(B) 分别为磷源时 Yj1 的酶活性测定 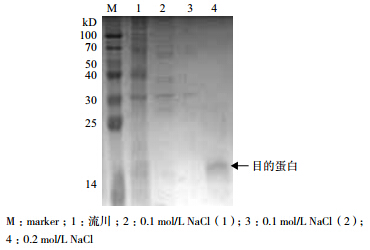
图 5 纯化得到的有机磷降解酶电泳图
| [1] | Abd-Alla MH. Phosphatases and the utilization of organic phosphorus by Rhizobium legum inosarum biovarviceae[J]. Letters in Applied Microbiology,1994,18:294-296 . |
| [2] | 王光华,赵英,周德瑞,等. 解磷菌的研究现状与展望[J]. 生态环境,2003,12(1):96-100. |
| [3] | 吉蓉. 土壤解磷微生物及其解磷机制综述[J]. 甘肃农业科技,2013,8:42-44. |
| [4] | Tao GC,Tian SJ,Cai MY,et al. Phosphorus-solubilizing and mineralizing abilities of bacteria isolated from soils[J]. Pedosphe-re,2008,18(4):51. |
| [5] | Xie LH,Lu JL,Zhang YP,et al. Influence of long term fertilization on phosphorus fertility of calcareous soilⅡ,Inorganic and organic phosphorus1[J]. Chinese Journal of Applied Ecology,2004,15(5):790-794. |
| [6] | 王继雯. 有机磷降解菌的分离筛选及初步鉴定[J]. 河南科学,2011,29(1):31-34. |
| [7] | 杨小蓉,宗浩,郑鸽,等. 一株降解氧乐果的高效菌的分离和鉴定[J]. 四川师范大学学报:自然科学版,2001,24(4):392-394. |
| [8] | 王堃,王志春,李荣,等. 乐果降解菌L3 的分离、鉴定及降解性能[J]. 中国环境科学,2008,28(11):994-998. |
| [9] | Whitel MA,Harden TJ,Bender GL. Phosphorus solubilization in solution culture by the soil fungus Penicillium radicum[J]. Australian Journal of Soil Research,1997,35:291-300. |
| [10] | 马春浩. 解磷微生物及其应用研究综述[J]. 安徽农学通报,2007,13(4):34-36. |
| [11] | Sperber JI. Solution of mineral phosphoruss by soil bacteria[J]. Nature,1957,180:994-995. |
| [12] | Reddy MS,Kumar S,Babita K,et al. Biosolubilization of poorly soluble rock phosphoruss by Aspergillus tubingensis and Aspergillus niger[J]. Bioresource Technology,2002,84:187-189. |
| [13] | Kobus J. The distribution of microorganisms mobilizing phosphorus in different soils[J]. Scta Microbiologia Plolonica,1962,11:255-264. |
| [14] | 黄雅,李政一,赵博生. 有机磷农药乐果降解的研究现状与进展[J]. 环境科学与管理,2009,43(4):20-24. |
| [15] | 邓晓,李勤奋,侯宪文,等. 乐果降解菌LGX1的筛选及其降解特性研究[J]. 生态环境学报,2010,19(5):1034-1039. |
| [16] | 王华,艾涛,温晓芳,等. 土壤中乐果降解菌的筛选及其特性研究[J]. 农业环境科学学报,2006,25(5):1255-1259. |
| [17] | 王永杰,李顺鹏,沈标. 有机磷农药乐果降解菌的分离及其活性研究[J]. 南京农业大学学报,2001,24(2):71- 74. |
| [18] | 马丽娜,官雪芳,朱育菁,等. 乐果降解菌的分离、筛选和鉴定[J]. 中国农学通报,2008,24(7):441-444. |
| [19] | 赵小蓉,林启美,李保国. 微生物溶解磷矿粉能力与 pH 及分泌有机酸的关系[J]. 微生物学杂志,2003,23(3):5-7. |
| [20] | Yi YM,Huang WY,Ge Y. Exopolysaccharide:a novel importantfactor in the microbial dissolution of tricalcium phosphorus[J]. World J Microbiol Biotech,2008,24:1059-10651. |
| [21] | 孙嘉,郎朗. 有机磷农药降解酶的研究进展[J]. 资源节约与环保,2014,5:149-154. |
| [22] | 萨姆布鲁克 J,拉塞尔 DW,黄培堂,译. 分子克隆实验指南[M]. 第3版. 北京:科学出版社,2008. |
| [23] | 伊鋆. 高效解磷细菌的筛选及解磷机理的研究[D]. 大连:大连理工大学,2011. |
| [24] | 金彬明,刘佳明. 海洋微生物有机磷降解酶的纯化与性质研究[J]. 中国微生态学杂志,2007,19(1):37-39. |
| [25] | 伍宁丰,梁果义,邓敏捷,等. 有机磷农药降解酶及其基因工程研究进展[J]. 生物技术通报,2003(5):9-12. |
| [26] | 肖佳沐,袁海平,楼紫阳,等. 一株乐果降解菌的筛选、鉴定及其降解特性研究[J]. 环境污染与防治,2010,32(12):67-71. |
| [27] | 史延华. CP1 菌株的分离、筛选及其对毒死蜱的降解[J]. 微生物学通报,2011,38(9):1331-1338. |
| [28] | 王莉. Hyphomicrobium sp. MAP-1菌株修复甲胺磷乙酰甲胺磷和水胺硫磷污染土壤的实验研究[J]. 农业环境科学学报,2013,32(1):81-87. |
| [29] | 许育新,冯昭中,陆鹏,等. 甲基对硫磷降解菌PF32的分离鉴定及其降解特性研究[J]. 农药学学报,2009,11(3):329-334. |
| [30] | Cycona M,Zmijowska A,Wójcik M,et al. Biodegradation and bioremediation potential of diazinon-degrading Serratia marcescens to remove other organophosphorus pesticides from soils[J]. Journal of Environmental Management,2013,117:7-16. |
| [31] | 赵小蓉,林启美,李保国. C、N源及C/N比对微生物溶磷的影响[J]. 植物营养与肥料学报,2002,8(2):197-204. |
| [32] | 陈燕飞. pH 对微生物的影响[J]. 太原师范学院学报:自然科学版,2009,8(3):121-124. |
| [33] | 钟传青,黄为一. 不同种类解磷微生物的溶磷效果及其磷酸酶活性的变化[J]. 土壤学报,2005,42(2):286-293. |
| [34] | 于群英. 土壤磷酸酶活性及其影响因素研究[J]. 安徽技术师范学院学报,2001,15(4):5-8. |
| [35] | 刘玉焕,钟英长. 华丽曲霉Z58有机磷农药降解酶的纯化和性质[J]. 微生物学报,2000,40(4):430-434. |
| [36] | Munnecke DM. Enzymatic detoxification of waste organophosphorus pesticides[J]. Agric Food Chem,1980,28:105-111. |