磷是植物生长发育的必需元素之一,但土壤中95%以上的磷与Ca2+、Fe2+、Fe3+、Al3+等金属离子结合而丧失植物有效性,植物难以吸收利用。如何提高土壤磷素利用率,分离筛选出高效且具有溶磷作用的微生物菌株并制成土壤磷素活化剂,已成为国内外研究热点。土壤中存在大量的微生物,能够将植物难以吸收利用的磷转化为可吸收利用的形态,具有这种能力的微生物称为溶磷菌[1],包括细菌、真菌和放线菌,广泛分布在根际、土壤和作物种子表面[2]。溶磷菌除了溶解土壤中难溶性或不溶性的磷素外,还可以吸附根系周围锌、铜、钙等微量元素,改善植物营养,同时分泌生长调节物质,促进根系生长等作用。因此应用溶磷菌能够有效地提高农作物产量,对实现农业生态系统的可持续发展具有重要的理论和实践意义[3]。
油茶属山茶科常绿灌木或小乔木,是我国南方特有的木本油料作物。在耕地资源有限的情况下,努力发展油茶产业对提升我国食用油自给率,保障国家食用油安全和提高山区农民收入具有重要意义。海南油茶林土壤全磷含量范围为100-120 mg/Kg,油茶在此范围内均可正常生长[4, 5],低磷条件下未表现出明显的缺磷症状,近年来的研究结果表明油茶根际土壤中存在溶磷菌[6, 7],油茶根际溶磷菌的高效溶磷作用可能是油茶适应低磷胁迫的重要机理之一。本实验通过对油茶根际溶磷菌的溶磷能力进行研究,以期筛选出优良溶磷菌株,为油茶产量的提高和微生物肥料研制提供理论依据,也为解决热带缺磷问题提供一条绿色途径。
1 材料与方法 1.1 材料 1.1.1 样品采集供试土壤采自五指山市油茶林地,采集健康的油茶植株根际土壤,将各样品做好标记,带回实验室置于4℃的冰箱内保存备有。
1.1.2 培养基有机磷培养基:葡萄糖10 g,(NH4)2SO4 0.5 g,MgS04·7H2O 0.3 g,NaCl 0.3 g,KCl 0.3 g,FeSO4·7H2O 0.03 g,MnSO4·4H2O 0.03 g,卵磷脂0.2 g,CaCO3 5.0 g,酵母膏0.4 g,琼脂20g,蒸馏水1000 mL,pH7.0-7.5。
LB培养基:蛋白胨10 g,酵母膏5 g,NaCl 10 g,琼脂18 g,蒸馏水1 000 mL,pH7.0。牛肉膏蛋白胨液体培养基:牛肉膏3.0 g,蛋白胨5.0 g,氯化钠10.0 g,蒸馏水1 000 mL,pH7.2-7.4。
1.2 方法 1.2.1 溶磷细菌的分离纯化称取10 g根际土壤置于盛有90 ml无菌水的三角瓶中,振荡30 min (160 r/min),制成悬浮液。取其上清液用无菌水10倍逐级稀释,依次稀释成10-2、10-3、10-4浓度,各吸取0.1 mL涂布于有机磷培养基平板,于28℃恒温培养箱中倒置培养。待菌落长出后,挑取具有溶磷菌特征的单菌落划线纯化,并将纯化的菌株接种到斜面LB培养基上,置于4℃的冰箱中保存待用。
1.2.2 溶磷细菌的溶磷能力 1.2.2.1 定性测定采用溶磷圈法[8],将培养基制成平板、分区,每区点植1个菌株,28℃培养7 d,观察有无溶磷圈生成,测定溶磷圈直径(D),菌落直径(d)。根据能否产生溶磷圈判断菌株有无溶磷能力;根据D/d值大小初步确定菌株的溶磷能力,同时观察并记录菌落的性状、大小、边缘结构、高度、透明度、颜色、生长状况等。
1.2.2.2 定量测定采用钼锑抗比色法,于150 mL三角瓶中盛入有机磷液体培养基50 mL高压灭菌20 min (121℃、101 kPa)备有。挑选各初筛菌株,接种于牛肉膏蛋白胨液体培养基中30℃振荡培养至发酵液变浑浊后离心,用无菌水重悬,即制备成菌悬液。分别将1 mL菌悬浮液接种于有机磷液体培养基中,以不接菌为对照,每个处理3次重复,30℃震荡培养7 d (160 r/min);培养完毕,发酵液于4℃条件下12 000 r/min离心15 min,取上清液1 mL,采用钼锑抗比色法测定有效磷增量(mg/L)[9],计算公式如下:
P=K×V/V1
其中:P为有效磷增量;K为从标准曲线查得显色液的磷含量(mg/L);V为显色时溶液定容的体积(mL);V1为显色时吸取上清液的体积(mL)[10]。
1.2.3 溶磷菌株培养液pH 值变化测定用酸度计测定培养7 d 后的各菌株培养液pH 变化情况。 1.2.4 溶磷菌株6-Y-09 的鉴定 1.2.4.1菌株6-Y-09形态特征和主要生理生化特征
参照《常见细菌系统鉴定手册》[11]对菌株6-Y-09的菌落形态特征及主要生理生化特征进行试验和观察记录。
1.2.4.2 菌株6-Y-09 的16S rDNA 序列分析采用细菌基因组DNA提取试剂盒提取溶磷菌的DNA。PCR扩增选用通用引物27 F 5'-AGAGTTTGATCCTGGCTCAG-3',1492 R 5'-GGTTACCTTGTTACGACTT-3'。反应体系50 μL (1 μL模板、1 μL 1492 R、1 μL 27 F、25 μL PCR mastermix、22 μL ddH2O)。PCR扩增(94℃预变性5 min,94℃变性1 min,55℃退火1 min,72℃延伸1.5 min,进行35个循环,72℃终延伸10 min,4℃保存),取50 μL PCR产物用1%的琼脂糖凝胶进行电泳检测,在紫外灯下观察、并拍照保存。将PCR产物送至北京六合华大基因科技股份有限公司进行测序。
经测序获得溶磷菌株6-Y-09的16S rDNA序列,将该序列通过Blast程序与GenBank中核酸数据进行比对分析(http://blast.ncbi.nlm.nih.gov/Blast.cgi),采用BioEdit、Mega5.0等软件对菌株进行系统发育分析,采用邻接法(Neighbour-joining,NJ法)构建系统发育树。
1.2.5 数据处理数据采用Excel 和SAS 软件进行方差分析。 2 结果 2.1 溶磷细菌的分离纯化
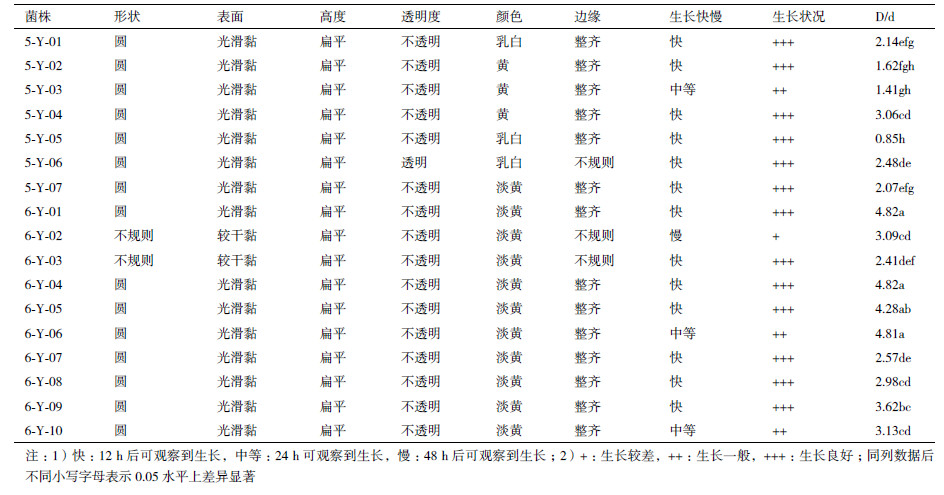
从油茶根际土壤样品中共分离筛选获得17株能产生明显溶磷圈的细菌,对所分离纯化得到的17株细菌的形态进行观察,并用溶磷圈法对各菌株的D/d值进行测定,结果如表 1所示。其中菌株6-Y-09在以卵磷脂为磷源的培养基上出现了明显且较大的透明圈(图 1)。
 |
| 图 1 菌株6-Y-09 在有机磷培养基上的溶磷圈 |
各菌株在有机磷液体培养基中培养7 d后,测定其pH和有效磷含量,结果(表 2)发现,17株溶磷菌溶解有机磷能力差异显著,有效磷含量在34.76-201.38 mg/L之间,与不接菌对照(23.99 mg/L)相比,有效磷增量在10.77-177.39 mg/L之间,增幅在44.8%-739.4%之间。其中,菌株6-Y-09的溶磷量为201.38 mg/L,比CK增加了8.39倍,溶磷效果显著高于其他菌株。
有机磷细菌液体培养基的溶磷量与pH之间没有显著的相关性,主要原因是有机磷细菌主要是通过分泌胞外植酸酶、核酸酶和磷酸酶等非有机酸类物质将有机酸分解[12],而这些物质对培养液的pH改变不大。
2.3 菌株鉴定 2.3.1 菌株6-Y-09 的形态特征菌株6-Y-09在LB培养基上生长较好,速度快,培养48 h后.菌落为圆形,直径5 mm,淡黄色,不透明,湿润,扁平,无色素产生。
2.3.2 菌株6-Y-09 的生理生化特征菌株淀粉水解试验、吲哚试验、V-P试验、甲基红试验、H2S试验呈阴性;明胶液化试验、过氧化氯酶试验、硝酸盐还原试验、氧化酶试验呈阳性;能利用葡萄糖。
2.3.3 16S rDNA 序列测定及其系统发育分析将菌株6-Y-09的16S rDNA进行PCR扩增得到一条1 500 bp左右的条带,经序列测定,其大小为1 333 bp。将其DNA序列与NCBI数据库中相应的DNA序列进行BLAST相似性分析,发现菌株6-Y-09与Burkholderia cepacia strain GJ8同源性最高,相似性达100%。根据序列同源性从高到低的原则,挑取9株菌株的16S rDNA序列,运用BioEdit、Mega5.0软件构建系统发育树(图 2)。
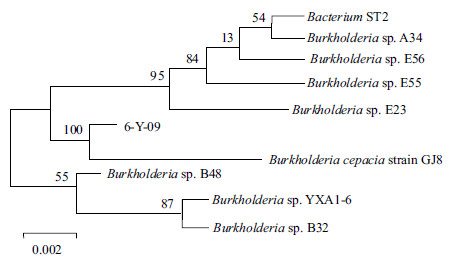 |
| 图 2 菌株6-Y-09 的同源性分析 |
本研究采用蒙金娜有机磷培养基,对五指山南定和水满等地区油茶林地的根际土壤中溶磷菌进行分离筛选,利用溶磷圈法,选出溶磷能力较强的菌株17株,菌株溶解有机磷D/d值在0.85-4.82之间。进一步摇瓶培养对17株菌进行复筛,有效溶磷量在34.76-201.38 mg/L之间。无论是在固体培养条件下的D/d值还是在液体培养条件下的有效溶磷量,菌株6-Y-09均表现出较强的溶磷能力,因此将其选择作为进一步鉴定的菌株。结合菌株6-Y-09的菌落形态特征、生理生化试验,16S rDNA序列和系统发育分析等研究,初步鉴定菌株6-Y-09为洋葱伯克霍尔德菌(Burkholderia capacia)。洋葱伯克霍尔德菌是1950年Burkholder从腐烂洋葱表皮中分离到的一株植物病原菌[13],对人本身来说是一种致病性较严重的致病菌,但是在自然界中又是一种重要的生防、环保菌,减少了对环境的危害,相关研究结果表明洋葱伯克霍尔德菌能够产生多种次级代谢产物,包括硝吡咯菌素、吩嗪,Cepabactin,Cepaciamide A等以及其他未被鉴定的物质,并具有防治植物病害和促进植物生长的双重功效[14, 15, 16]。另外,国外已有利用其开发出生物农药用于防治小麦纹枯病、小麦全蚀病、番茄南方根结线虫病[17, 18]、桃褐腐病[19]等,也有其防止植物病害作用机理的研究报道[20, 21],洋葱伯克霍尔德菌在农业生产和环境保护中表现出广泛的应用前景。
油茶是我国重要的木本油料作物,由于其生长周期长,必须维持土壤肥力才能达到持续高产的目的。微生物肥料可以改良土壤理化性质,调节植物生长,增加作物产量,且对生态环境友好,因此推广和应用微生物肥料是推动我国油茶产业化发展的重要措施。菌株6-Y-09有望成为溶磷菌剂及复合菌剂研制的优良菌株,本研究为该菌株今后的应用、微生物肥料的开发奠定了基础。此外,菌株6-Y-09的扩繁技术体系以及该菌株对油茶的长期接种效应及其促生机制还有待进一步研究。
4 结论通过分离和筛选获得17株有溶磷效果的菌株,且菌株6-Y-09表现出较强的溶磷能力。通过菌落形态特征、生理生化实验及系统发育分析等研究,初步鉴定菌株6-Y-09为洋葱伯克霍尔德菌(Burkholderia capacia)。
| [1] | 赵小蓉, 林启美. 微生物解磷的研究进展[J]. 土壤肥料, 2001(3):7-11. |
| [2] | 林启美, 赵海英, 赵小蓉. 溶磷微生物对不同磷矿粉的溶解能 力[J]. 中国农业科学, 2002, 35(10):1232-1235. |
| [3] | 张宇龙, 卢小良, 杨成德. 东祁连山高寒草地土壤无机磷溶解 菌分离及溶磷能力初探[J]. 草地学报, 2011, 19(4):560- 564. |
| [4] | 付登强, 杨伟波, 陈良秋, 等. 油茶林养分管理研究进展[J]. 热带农业科学, 2013, 33(2):17-21. |
| [5] | 付登强, 杨伟波, 陈良秋, 等. 海南油茶林土壤养分状况调 查[J]. 热带农业科学, 2013, 33(7):17-20. |
| [6] | 郝艳. 油茶林土壤微生物、酶活性研究及高效解磷菌的筛 选[D]. 湖南:中南林业科技大学, 2009. |
| [7] | 苟志辉. 油茶根际功能菌株的组合优化及菌肥研究[D]. 湖南: 中南林业科技大学, 2010. |
| [8] | 李玉娥, 姚拓, 朱颖, 等. 兰州地区苜蓿和红豆草根际溶磷菌 筛选及菌株部分特性研究[J]. 中国草地学报, 2009, 31(1): 46-51. |
| [9] | Smith KP, Goodman RM. Host variation for interactions with beneficial plant associated microbes[J]. Ann Rev Phytopath, 1999, 96 :4786-4790. |
| [10] | 史瑞和. 土壤农化分析[M]. 北京:农业出版社, 1981, 74. |
| [11] | 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社, 2001, 364-398. |
| [12] | 覃丽金, 王真辉, 陈秋波, 等. 根际解磷微生物研究进展[J]. 华南热带农业大学学报, 2006, 12(3):44-49. |
| [13] | Burkholder WH. Sour skin, a bacterial rot of onion bulbs[J]. Phytopath, 1950, 40 :115-117. |
| [14] | Roitman JN, Mahoney NE, Janisiewicz WJ. Production and composition of phenylpyrrole metabolites produced by Pseudomonas cepacia[J]. Appl Microbial Biotechnol, 1990, 34 :381-386. |
| [15] | Sharma S, Singh RK. Colonization behavior of bacterium Burkholder cepacia inside the Oryza sativa roots visualized using green fluorescent protein reported[J]. World Journal of Microbiology & Biotechnology, 2008, 24(7):1169-1175. |
| [16] | Sullivan LA, Mahenthiralingam E. Biotechnological potential within the genus Burkholderia[J]. Letters in Applied Microbiology, 2005, 41(1):8-11. |
| [17] | 李纪顺, 杨合同, 陈凯, 等. 两株多功能生防菌在小麦根际定 殖及其对小麦病害的防治效果[J]. 山东农业科学, 2005, 4 : 34-39. |
| [18] | Kothe M, Antl M, Huber B, et al. Killing of cacnorhabditis elegans by Burkholder cepaciais controlled by the cep quorum-sensing system[J]. Cellular Microbilogy, 2003, 5 :343-351. |
| [19] | 范青, 田世平, 姜爱丽, 等. 采摘后果实病害生物防治拮抗菌 的筛选和分离[J]. 中国环境科学, 2001, 4 :313-316. |
| [20] | Heungens K, Parke JL. Zoospore homing and infection events : Effects of the biocontrol bacterium Burkholder cepaciais AMMDR1 on two oomycete pathogens of pea[J]. Applied and Environmental Microbiology, 2000, 12 :5192-5200. |
| [21] | Omar I, Rossall S. Biological control of fusarium crown and root of tomato with antagonistic bacteria and integrated control when combined with the fungicide carbendazim[J]. Plant Pathology, 2006, 1 :92-99. |