2. 广东省水产经济动物病原生物学及流行病学重点实验室 广东省教育厅水产经济动物病害控制重点实验室,湛江 524088 ;
3. 仲恺农业工程学院,广州 510225)
2. Guangdong Provincial Key Laboratory of Pathogenic Biology and Epidemiology for Aquatic Economic Animals,Key Laboratory of Diseases Controlling for Aquatic Economic Animals of Guangdong Higher Education Institutions,Zhanjiang 524088 ;
3. Zhongkai University of Agriculture and Engineering,Guangzhou 510225
溶藻弧菌是一种嗜盐嗜温性、兼性厌氧的革兰氏阴性短杆菌,广泛分布于世界各地,是水生动物弧菌病的主要病原菌之一[1, 2, 3]。近年来,随着养殖环境的持续恶化,溶藻弧菌病不断暴发,给水产养殖业造成巨大经济损失。此外,该菌可导致人类的食物中毒等多种疾病[4, 5],严重危害人类健康。
长期以来,针对弧菌病的防治仍然以化学药物及抗生素为主,但由此导致的药物残留及细菌耐药问题也日趋严重,因此寻找免疫原性更强,保护力更高,毒副作用更低的基因工程亚单位疫苗渐受关注[6, 7]。目前利用疫苗预防弧菌病的研究已取得进展,灭活菌体、脂多糖、鞭毛蛋白等菌体成分被证明具有良好的免疫原性[8, 9, 10],一些亚单位疫苗、减毒疫苗、DNA疫苗也显示了良好的免疫保护[7, 8, 11]。但在实际生产应用中发现,一种疫苗难以防治溶藻弧菌种内众多血清型的感染,更不用说防治其他弧菌的感染,因此只有制备跨科属种而不仅仅是种内保护作用的疫苗才能满足海水养殖弧菌病防制治的需要。
Tol-Pal (Translocation-Peptidoglycan associated lipoprotein)系统是革兰氏阴性菌高度保守的膜蛋白系统之一,主要由5个相互接触的蛋白组成,分别是转运蛋白TolB蛋白(Translocation protein B)、Pal蛋白、TolA蛋白、TolR蛋白和TolQ蛋白,其中TolA蛋白、TolQ蛋白和TolR蛋白组成了细菌的内膜蛋白复合体,而TolB蛋白和Pal蛋白则组成了细菌外膜复合体[12]。Tol-Pal系统确切功能目前尚不十分清楚,一般认为该系统对于维持革兰氏阴性菌细胞膜的完整性和稳定性非常重要[13],此外,一些研究认为该系统其也参与细菌的致病过程。在大肠杆菌内,Tol-Pal系统的主要功能是将A类大肠杆菌毒素输送至胞外并转运至敏感的宿主靶细胞内,最后导致细胞的死亡[14]。在霍乱弧菌(Vibrio cholera)中,Tol-Pal系统负责转运霍乱毒素进入宿主细胞,从而发挥其毒力[15]。在鼠伤寒沙门氏菌(Salmonella enterica serovar Typhimurium)中,Tol-Pal系统提高其耐受胆盐的能力,保证其顺利地侵染宿主[16]。Tol-Pal系统中的TolB位于细胞膜表面,广泛与外界接触,而且又是病原菌转运毒素的必要装置,推测其极可能是一种共同抗原。但纵观国内外,目前鲜见关于溶藻弧菌Tol-Pal系统的免疫原性和免疫保护性的相关研究报道。本试验在项目组已完成TolB体外异源表达[17]的基础上,进一步研究TolB蛋白的免疫原性和对石斑鱼的免疫保护性,以期为高效亚单位疫苗的制备奠定基础。
1 材料与方法 1.1 材料 1.1.1 载体和菌株溶藻弧菌强毒株HY9901,由本实验室自广东湛江海域患病红笛鲷(Lutjanus sanguineus)鱼体中分离并保存[18];大肠杆菌BL21(DE3)和表达载体pET-28a (+)由本实验室保存;克隆载体pMD18-T购自TaKaRa公司。
1.1.2 实验动物SPF级8周昆明小鼠(22.5±2.5) g购自广东医学院实验动物中心,在温度18-22℃,相对湿度50%-60%条件下,饲养一周后进行实验。健康石斑鱼(Epinephelus awoara)体重(15±2) g购自湛江某鱼场,在水温20℃下,每日投喂小杂鱼,室内暂养一周后用于实验。
1.1.3 主要试剂Ex Taq DNA聚合酶购自TaKaRa公司;BamH I和Sal I等限制性核酸内切酶、T4 DNA连接酶等购自NEB公司;预染蛋白Marker为Fermentas公司产品;细菌基因组DNA提取试剂盒、DNA胶回收试剂盒购自天根公司;其余试剂均为进口或国产分析纯;PCR引物合成和序列测定均由上海生工生物技术服务有限公司完成;抗生素使用浓度为:氨苄西林(Amp)100 μg/mL、卡那霉素(Kan)50 μg/mL。
1.2 方法 1.2.1 溶藻弧菌HY9901总DNA的提取和tolB基因的扩增将溶藻弧菌HY9901菌株涂布于大豆酪蛋白琼脂培养基(TSA)平板上,挑选单菌落接种于TSB (5% NaCl)培养基,28℃振荡培养12 h以上。取适量菌液于Ependoff离心管中,10 000 r/min离心1 min收集菌体,参照试剂盒说明书提取基因组DNA。根据GenBank上登录的溶藻弧菌全基因序列(ACCESSION:NZ_AAPS00000000)设计一对引物,上游引物P1为:5'-ATGATTAGACGCCTTTTACTA-3',下游引物P2为:5'-CTACAAAAACGGTGACCA-3'。PCR反应条件为:94℃预变性4 min;94℃ 30 s,55℃ 30 s,72℃ 90 s,共35个循环;72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳检验后切胶回收,然后克隆至pMD18-T载体,菌落PCR鉴定后将阳性克隆送至上海生工生物技术服务有限公司测序。1.2.2原核表达载体构建与表达纯化按照文献[17]进行。将tolB基因与原核表达载体pET-28a连接后转化至大肠杆菌BL21感受态细胞,IPTG诱导表达后使用HisTrap HP亲和柱纯化目的蛋白,-20℃保存。
1.2.2 原核表达载体构建与表达纯化按照文献[17]进行。将tolB基因与原核表达载体pET-28a连接后转化至大肠杆菌BL21感受态细胞,IPTG诱导表达后使用HisTrap HP亲和柱纯化目的蛋白,-20℃保存。
1.2.3 TolB蛋白免疫小鼠将纯化的融合蛋白皮下多点注射免疫SPF级昆明小鼠。每只小鼠免疫200 μg融合蛋白,以注射PBS为对照。每隔7 d加强免疫一次,共免疫4次。首次注射的抗原为蛋白或PBS与完全佐剂混匀制备,后3次注射的抗原均采用蛋白或PBS与不完全佐剂混匀制备。末次加强免疫后1周眼球取血,离心分离血清,测定效价后冷冻保存备用。
1.2.4 石斑鱼的免疫和攻毒石斑鱼100尾随机分成对照组和注射组,每组50尾。对照组分别注射100 μL PBS,免疫组注射100 μL TolB蛋白(1 000 μg/mL)。在首次免疫后第3周,对免疫组石斑鱼进行第2次免疫,方法同第1次。首次免疫后,每周取样一次,每组取3尾鱼,尾静脉采血0.5 mL,室温下静置2 h后4℃过夜,12 000 r/min离心10 min,分离血清,-80℃保存,ELISA测定抗体效价。免疫后第4周,进行攻毒试验,每尾鱼肌肉注射0.2 mL溶藻弧菌HY9901(6.0×108 cfu/mL),每天观察鱼的动态,记录死亡情况,对部分发病及死亡鱼进行病理检查和病原菌分离,并计算其相对免疫保护力(RPS):

将诱导表达后的融合蛋白和溶藻弧菌HY9901的全菌蛋白进行SDS-PAGE电泳后,进行转印,5%脱脂牛奶4℃封闭过夜。用鼠抗血清与之反应,二抗为HRP标记的羊抗鼠IgG。各步骤之间用含体积分数0.1%的Tween 20的磷酸缓冲液(TTBS)洗膜4次,每次10 min。最后用DAB显色液显色至有清晰的目的条带出现,用无菌水终止反应,将膜置于滤纸上自然干燥。
利用纯化的融合蛋白为抗原包被96孔板,根据预实验确定最适抗原浓度为每孔10 μg/100 μL。待测鼠抗血清或石斑鱼抗血清为一抗,第1孔稀释100倍或64倍,以后倍比稀释。注射PBS后的血清作阴性对照,HRP标记的羊抗鼠IgG或者兔抗石斑鱼IgM为二抗,四甲基联苯胺(TMB)溶液显色后酶标仪测定抗体效价。
2 结果 2.1 tolB基因的克隆和序列分析PCR扩增得到一条约1.3 kb的特异条带(图 1-A),克隆至pMD18-T载体,菌落PCR也扩增出1.3 kp的条带(图 1-B)。测序表明,tolB基因含有一个1 353 bp的开放读码框(ORF),编码450个氨基酸(图 2),预测分子量约为49.7 kD,等电点为9.49。将该基因提交至GenBank,其登录号为JQ846501。
 |
| M :DL2000 DNA Marker ;1-6 :tolB PCR 产物 图 1 tolB 基因的克隆(A)和菌落PCR(B) |
对tolB基因所推导的氨基酸序列进行N端信号肽结构的预测发现,在第22-23位氨基酸为信号肽;并发现该蛋白第24-43位氨基酸为跨膜区(图 2)。蛋白质亚细胞定位预测结果显示,TolB位于胞外基质中可能性最大,为66.7%,其次为细胞质和囊泡,可能性均为11.1%。InterProScan Sequence Search程序预测结构域发现该蛋白含有1个N-terminal结构域(24-122 aa),3个PD40-like β-螺旋结构域(223-248、256-292和300-336 aa)。
 |
| 终止子以星号表示,方框代表信号肽,下划线处为跨膜区 图 2 溶藻弧菌HY9901 tolB 基因核苷酸及其编码的氨基酸序列 |
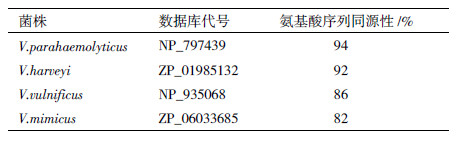
BLAST分析发现溶藻弧菌TolB基因与其他已知物种的TolB具有较高的同源性,其中TolB氨基酸序列与副溶血弧菌(Vibrio parahaemolyticus)的TolB氨基酸序列的同源性最高达94%,多序列相似性比较表明TolB是高度保守的(表 1)。
TolB免疫小鼠后,ELISA检测鼠抗血清效价在1:40 000以上。Western blot分析发现,TolB抗血清不仅能与融合蛋白发生反应(图 3第2泳道),而且能与天然的溶藻弧菌全菌蛋白发生反应(图 3第3泳道),在53 kD处有印迹带,注射PBS后的血清不能与53 kD带发生反应(图 3第1泳道)。
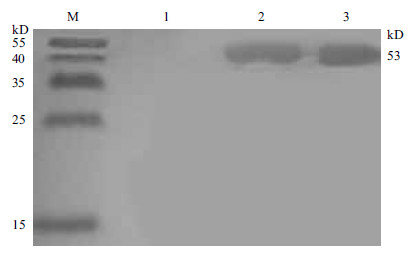 |
| M :预染蛋白分子量标准;1 :阴性对照;2 :TolB 融合蛋白;3 :溶藻弧菌全菌蛋白 图 3 TolB 的免疫印迹 |
TolB免疫后的石斑鱼,分别在第2、3、4、5、6和7周采血和收集血清,用间接ELISA法测定抗体效价。结果(图 4)表明,石斑鱼在免疫后都发生特异免疫反应,所有免疫组与非免疫对照组间都存在显著差异(P < 0.05),在第2周即可检测到抗体的产生,在第4周抗体水平达到峰值(1:2 048),在第7周实验结束时,所有免疫组的抗体效价均维持在1:64以上。
 |
| * :0.01 < P < 0.05 ;** :P < 0.01 图 4 间接ELISA 法测定的免疫鱼抗体效价 |
TolB蛋白免疫石斑鱼后第4周,进行攻毒实验。结果(图 5)表明,对照组鱼在感染第3天开始死亡,并且出现了明显症状,如运动和摄食能力下降,出现腹水和体表溃疡等,从肝、肾中重新分离到了溶藻弧菌,确认死于攻击引起的感染。在感染后2周内,对照组的石斑鱼全部死亡;免疫组的死亡率为24%,相对免疫保护力为76%。
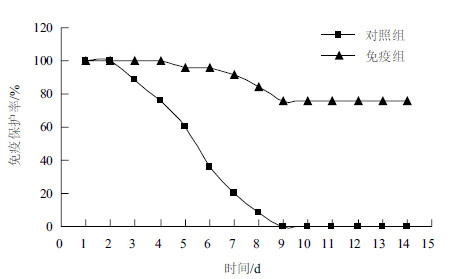 |
| 图 5 免疫后用溶藻弧菌HY9901 攻毒的存活率 |
对Tol-Pal系统的报道最早始于其对A类大肠杆菌毒素的转运作用[13],后续研究发现其功能涉及维持革兰氏阴性菌的外膜完整性和稳定性、发挥毒力、细胞分裂、细菌耐药性等方面[19]。对鼠伤寒沙门氏菌(Salmonella Typhimurium) Tol-Pal系统的研究表明,tolA基因的缺失可导致其毒力下降[20],对大肠杆菌(Escherichia coli)细胞分裂的研究发现,分裂末期中隔附近聚集了大量Tol蛋白系统[21],对福氏志贺菌(Shigella flexneri)耐药性研究发现Pal-Tol膜蛋白系统的表达产物TolA蛋白,TolQ蛋白和TolB蛋白可能与其多药耐药性存在一定的关系[22]。但是有关Tol-Pal系统相关蛋白的免疫原性和免疫保护性功能尚未知晓。本研究通过基因序列比对发现,氨基酸序列中存在3个PD40-likeβ-螺旋结构域。相关研究表明,该结构域通过识别转运大肠杆菌素等致病性蛋白质毒素[14],参与细菌的致病过程,因此溶藻弧菌TolB在致病过程中可能参与毒素的转运。但是TolB蛋白能否引起宿主良好的免疫反应,从而作为疫苗的有效成分,尚不得而知。为解决以上问题,笔者将用纯化的融合蛋白免疫SPF级小鼠,获得了高效价的抗血清,ELISA检测效价达1:40 000,表明在弗氏完全佐剂和弗氏不完全佐剂的协助下,融合蛋白在小鼠中能够引发很强的体液免疫应答。更重要的是,鼠抗TolB的血清不仅与融合蛋白发生免疫反应,而且也能与天然溶藻弧菌的全菌蛋白发生免疫反应,提示溶藻弧菌转运蛋白TolB是它的主要抗原之一,具备了成为疫苗候选成分的基本条件。
很多研究表明,外膜蛋白具有良好的免疫原性[23, 24, 25],而且有些外膜蛋白还是很好的共同抗原,是研制基因工程疫苗的良好材料。如Li等[26]发现外膜蛋白OmpK广泛存在于弧菌中,对溶藻弧菌、哈氏弧菌(Vibrio harveyi)、副溶血弧菌均具有高免疫保护率。在本研究中,通过基因序列的比对发现,溶藻弧菌Tol-Pal系统中的TolB基因与其他已知物种的TolB具有较高的同源性,其中与副溶血弧菌的TolB氨基酸序列的同源性最高达94%,多序列相似性比较表明TolB是高度保守的,可能是弧菌的交叉保护抗原。为验证TolB的保护性,笔者将在大肠杆菌中表达并纯化的TolB蛋白免疫石斑鱼。结果发现,免疫石斑鱼血清中也产生了较高水平的特异性抗体,进一步验证了TolB强的免疫原性;对溶藻弧菌强毒株攻毒感染的免疫保护率为76%,表明TolB可以作为一个有效候选亚单位疫苗成分,达到免疫防治的目的。但是,从免疫鱼中获得的血清抗体效价(1:1 024)低于免疫小鼠获得的血清抗体效价(1:40 000)。这种血清抗体效价的差异在其他一些鱼类中也存在[27, 28]。出现这种差异的原因可能是因为鱼类与小鼠相比,免疫系统相对不完善,免疫应答能力比小鼠弱。另外,免疫剂量、免疫佐剂以及免疫途径等,都可能导致免疫应答水平和免疫保护效果的不同。今后在TolB免疫剂量、免疫佐剂的选择、免疫途径以及采用不同弧菌进行攻毒等方面需更进一步地开展研究,以期提高该蛋白的免疫应答和免疫保护力,为进一步制备高效亚单位疫苗奠定基础,为海水鱼类弧菌病的防治提供有效的途径。
4 结论本研究从溶藻弧菌HY9901成功克隆得到TolB的基因全长序列。该基因(GenBank登录号JQ84-6501)全长1 353 bp,共编码450个氨基酸残基。BLAST比对发现溶藻弧菌TolB基因与其他已知弧菌的TolB具有较高的同源性。用原核表达的TolB蛋白免疫SPF级小鼠,制备多克隆抗体,ELISA效价达1:40 000。免疫印迹表明鼠抗TolB血清能与诱导后的重组蛋白发生特异反应。用TolB蛋白两次免疫石斑鱼,ELISA检测表明抗体效价在第4周达到峰值(1:2 048)。攻毒实验结果表明TolB对石斑鱼的免疫保护率为76%。
| [1] | Sadok K, Mejdi S, Nourhen S, et al. Phenotypic characterization and RAPD fingerprinting of Vibrio parahaemolyticus and Vibrio alginolyticus isolated during Tunisian fish farm outbreaks[J]. Folia Microbiol(Praha), 2013, 58(1):17-26. |
| [2] | Chang CC, Yeh MS, Lin HK, et al. The effect of Vibrio alginolyticus infection on caspase-3 expression and activity in white shrimp Litopenaeus vannamei[J]. Fish and Shellfish Immunology, 2008, 25(5):672-678. |
| [3] | Ben Kahla-Nakbi A, Chaieb K, Bakhrouf A. Investigation of several virulence properties among Vibrio alginolyticus strains isolated from diseased cultured fish in Tunisia[J]. Diseases of Aquatic Organisms, 2009, 86(1):21-28. |
| [4] | Campanelli A, Sanchez-Politta S, Saurat JH. Cutaneous ulceration after an octopus bite :infection due to Vibrio alginolyticus, an emerging pathogen[J]. Annales de Dermatologie et de Venereologie, 2008, 135(3):225-227. |
| [5] | Sganga G, Cozza V, Spanu T, et al. Global climate change and wound care :case study of an off-season Vibrio alginolyticus infection in a healthy man[J]. Ostomy Wound Manage, 2009, 55(4):60-62. |
| [6] | 黄志坚, 何建国. 溶藻弧菌外膜蛋白(Va-OMP)的免疫原性及 免疫保护性[J]. 水产学报, 2006, 30(4):538-543. |
| [7] | 潘燕华, 马悦, 赵东玲, 等. 鳗弧菌减毒活疫苗对牙鲆免疫效果 的研究[J]. 食品与药品, 2009, 11(3):12-15. |
| [8] | 曹剑香. 溶藻弧菌(Vibrio alginolyticus)疫苗及其外膜蛋白对 南美白对虾(Penaeus vannamei)免疫功能的影响[D]. 湛江: 湛江海洋大学, 2004. |
| [9] | 简纪常, 叶剑敏, 吴灶和. 溶藻弧菌脂多糖对石斑鱼免疫功能 的影响[J]. 水生生物学报, 2004, 28(1):103-105. |
| [10] | 梁海鹰, 夏立群, 吴灶和, 等. 溶藻弧菌HY9901 鞭毛蛋白 flaB 基因的克隆及原核表达[J]. 水产学报, 2010, 34(1): 139-146. |
| [11] | Liang H, Wu ZH, Jian JC, et al. Protection of red snapper (Lutjanus sanguineus)against Vibrio alginolyticus with a DNA vaccine containing flagellin flaA gene[J]. Letters in Applied Microbiology, 2011, 52(2):156-161. |
| [12] | Sturgis J. Organisation and evolution of the tol-pal gene cluster[J]. Journal of Molecular Microbiology and Biotechnology, 2001, 3(1):113-122. |
| [13] | Lloubès R, Cascales E, Walburger A, et al. The Tol-Pal proteins of the Escherichia coli cell envelope :an energized system required for outer membrane integrity?[J]. Research in Microbiology, 2001, 152(6):523-529. |
| [14] | Carr S, Penfold C, Bamford V, et al. The structure of TolB, an essential component of the tol-dependent translocation system, and its protein-protein interaction with the translocation domain of colicin E9[J]. Structure, 2000, 8(1):57-66. |
| [15] | Heilpern A, Waldor M. CTXφ infection of Vibrio cholerae requires the tolQRA gene products[J]. Journal of Bacteriology, 2000, 182 (6):1739-1747. |
| [16] | Prouty AM, Van Velkinburgh JC, Gunn JS. Salmonella enterica serovar Typhimurium resistance to bile :identification and characterization of the tolQRA cluster[J]. Journal of Bacteriology, 2002, 184(5):1270-1276. |
| [17] | 周泽军, 庞欢瑛, 丁燏, 等. 溶藻弧菌HY9901 转运蛋白TolB 的原核表达及条件优化和纯化[J]. 中国农学通报, 2013, 29 (11):55-59. |
| [18] | Cai SH, Wu ZH, Jian JC, et al. Cloning and expression of the gene encoding an extracellular alkaline serine protease from Vibrio alginolyticus strain HY9901, the causative agent of vibriosis in Lutjanus erythopterus(Bloch)[J]. Journal of Fish Diseases, 2007, 30(8):493-500. |
| [19] | Godlewska R, Wiśniewska K, Pietras Z, et al. Peptidoglycanassociated lipoprotein(Pal)of Gram-negative bacteria :function, structure, role in pathogenesis and potential application in immunoprophylaxis[J]. FEMS Microbiology Letters, 2009, 298 (1):1-11. |
| [20] | Paterson GK, Northen H, Cone DB, et al. Deletion of tolA in Salmonella Typhimurium generates an attenuated strain with vaccine potential[J]. Microbiology, 2009, 155(Pt 1):220- 228.. |
| [21] | Gerding MA, Ogata Y, Pecora ND, et al. The trans-envelope Tol- Pal complex is part of the cell division machinery and required for proper outer-membrane invagination during cell constriction in E. coli[J]. Molecular Microbiology, 2007, 63(4):1008-1025. |
| [22] | 黄娇娇. 福氏志贺菌多药耐药相关基因的表达与耐药性关系 研究[D]. 北京:中国农业科学院, 2010. |
| [23] | 吴灶和, 曹剑香, 简纪常, 等. 溶藻弧菌外膜蛋白对凡纳滨对 虾免疫功能的影响[J]. 热带海洋学报, 2005, 24(6):1-5. |
| [24] | 毛芝娟. 副溶血弧菌Vibrio parahaemolyticus 主要外膜蛋白的 克隆, 表达和免疫原性研究[D]. 杭州:浙江大学, 2007. |
| [25] | 张崇文, 于涟, 毛芝娟, 等. 哈维氏弧菌外膜蛋白OmpK 基因的克隆及原核表达[J]. 水产学报, 2006, 30(1):9-14. |
| [26] | Li N, Yang Z, Bai J, et al. A shared antigen among Vibrio species : outer membrane protein-OmpK as a versatile Vibriosis vaccine candidate in Orange-spotted grouper(Epinephelus coioides)[J]. Fish and Shellfish Immunology, 2010, 28(5-6):952-956. |
| [27] | 王妍妍, 李贵阳, 李杰, 等. 迟缓爱德华氏菌OppA 蛋白的免 疫原性及免疫保护分析[J]. 海洋科学, 2011, 35(5):19- 23. |
| [28] | 闫茂仓, 单乐州, 陈少波, 等. 三种创伤弧菌免疫原的制备及 其对黄姑鱼的免疫保护效果[J]. 动物学研究, 2012, 33(5): 503-509. |