2. 广西海洋研究所,北海 536000;
3. 广东海洋大学海洋学院,湛江 524088;
4. 广东省水产经济动物病原生物学及流行病学重点实验室,湛江 524088
2. Guangxi Institute of Oceanology,Beihai 536000;
3. Marine College,Guangdong Ocean University,Zhanjiang 524088;
4. Guangdong Provincial Key Laboratory of Pathogenic Biology and Epidemiology for Aquatic Economic Animals,Zhanjiang 524088
拟穴青蟹(Scylla paramamosain)隶属于节肢动物门(Arthropoda)、甲壳纲(Crustacea)、十足目(Decapoda)、短尾亚目(Brachyura)、梭子蟹科(Portunidae)、青蟹属(Scylla),具有很高的经济价值和营养价值,是中国重要海水养殖品种之一[1]。由于拟穴青蟹具食性广、适应性强、生长速度快、养殖周期短、耐干露时间长、易运输和养殖效益高等优点,深受养殖户喜爱。随着养殖强度增大以及日益恶化的养殖环境,拟穴青蟹养殖过程不断受到包括细菌、真菌以及病毒等多种病原体的侵害[2, 3, 4]。抗菌肽具有广谱抗细菌、抗真菌以及独特的作用机理,在蟹类防御病原微生物入侵方面起着重要作用[5]。
抗菌肽Hyastatin是Sperstad等[6]从蛛形互爱蟹(Hyas araneus)血细胞中纯化鉴定的一种对G+/G-菌、真菌均有抑制活性的新型抗菌肽,其C端结构域与对虾抗菌肽Penaeidins同源,有6个保守的Cys残基,形成3对分子内二硫键,属于Penaeidins家族抗菌肽。国内还未见有关经济蟹类hyastatin基因的克隆及其蛋白纯化方面的报道。本研究将已克隆到的拟穴青蟹hyastatin基因全长序列成熟肽的编码序列插入表达载体pET-28a,转入大肠杆菌BL21(DE3),构建并优化原核高效表达条件,对该基因所表达的蛋白进行纯化,以期为其在拟穴青蟹先天性免疫中的功能及其应用研究奠定基础。 1 材料与方法 1.1 材料 1.1.1 载体和菌株
大肠杆菌DH5α、BL21(DE3)、质粒pET-28a购至上海生工试剂,拟穴青蟹抗菌肽hyastatin基因是经测序无误,其克隆菌株保存于本实验室。 1.1.2 主要试剂
PCR反应试剂Taq DNA聚合酶、dNTP、限制性核酸内切酶Nde Ⅰ和Xho Ⅰ、T4 DNA连接酶、异丙基-β-D-硫代半乳糖苷(IPTG)、氨苄青霉素、DNA Marker、低分子蛋白Marker及预染标准相对分子质量蛋白均为TaKaRa公司产品;鼠抗His-tag单抗、辣根过氧化物酶标记的山羊抗鼠IgG、DAB显色试剂盒和DNA胶回收试剂盒购自南宁天地扬生物科技有限公司;PVDF膜购自上海生工生物技术有限公司;PCR引物均由英潍捷基(上海)贸易有限公司合成。其他试剂均为国产分析纯。 1.1.3 仪器
台式高速低温离心机(Thermo公司)、恒温摇床(常州中捷实验仪器制造有限公司)、全温振荡培养箱(上海博迅实业)、凝胶图象分析仪(GDS.8000,美国Gene公司)、蛋白纯化柱HisTrap HP 1 mL预装柱(GE公司)、小垂直板Mini Protean III电泳槽及Mini Trans-Blot转印槽(美国Bio-Rad)等。 1.2 方法 1.2.1 目的基因表达载体的构建与鉴定
根据拟穴青蟹hyastatin基因全长序列(GenBank登录号KC685376.1)设计一对特异引物,上游引物HYBDf为:5'-ccaacatatgtacaacgcgaaggttccgatc-3'(ccaa为保护碱基,下划线为Nde Ⅰ酶切位点),下游引物HYBDr为:5'-ccgctcgaggcctttgtagggtactggatag-3'(ccg为保护碱基,下划线为Xho Ⅰ酶切位点)。以拟穴青蟹cDNA单链为模板,用特异引物扩增该基因的成熟肽片段。PCR反应条件为:94℃预变性5 min;94℃ 30 s,58℃ 45 s,72℃ 1 min,共34个循环;72℃延伸10 min。PCR产物经琼脂糖凝胶电泳检测后,回收目的片段。PCR扩增产物和表达载体pET-28a分别经Nde I和Xho I双酶切,使用T4连接酶16℃连接4 h以上。连接产物转化入大肠杆菌BL21(DE3)感受态细胞中,挑选阳性菌落抽提质粒,进一步通过酶切和菌落PCR鉴定选择阳性克隆测序,确定表达框正确。 1.2.2 不同诱导温度对目的蛋白在大肠杆菌中表达量的影响
将表达正确的阳性克隆菌落,按1:50比例接种到含卡那霉素LB培养基中,37℃振荡培养至OD=0.4-0.6,在IPTG浓度为0.4 mmol/L时,37℃、28℃和16℃下诱导4 h,分别离心收集菌体并超声破碎,对离心后的沉淀以SDS-PAGE (浓缩胶浓度5%,分离胶浓度12%)分析目的蛋白表达的最适条件。 1.2.3 不同浓度IPTG对目的蛋白在大肠杆菌中表达量的影响
按1.2.1培养细菌,取1 mL做未诱导对照组,分别加入不同体积的IPTG,使其终浓度分别为0.2、0.4、0.6、0.8和1.0 mmol/L,37℃振荡4 h后各取1 mL菌液,以SDS-PAGE分析目的蛋白的表达量。 1.2.4 不同诱导时间对目的蛋白在大肠杆菌中表达量的影响
按1.2.1培养细菌,加入IPTG至终浓度为0.4 mmol/L,分别诱导0、1、2、3、4、5和6 h后收集菌液1 mL,以SDS-PAGE分析目的蛋白表达量。 1.2.5 目的蛋白的纯化
将含重组质粒的BL21菌接种于1 000 mL含氨苄青霉素的LB培养基,经优化的条件诱导后,离心收集菌体提取重组蛋白,用咪唑洗脱通过HisTrap HP柱纯化重组蛋白。 1.2.6 免疫印迹分析
将诱导前后的含空载体和Hyastatin基因的表达菌蛋白经SDS-PAGE电泳后,使用Mini Trans-Blot配合Mini Protean III电泳槽,将已用电转液浸泡30 min的胶块转移至硝酸纤维素膜上(200 mA,80 min),用鼠抗His-tag单抗与之反应,二抗为辣根过氧化物酶标记的山羊抗鼠IgG,各步骤之间用含体积分数0.1% Tween20的磷酸缓冲液(TBS)洗膜4次,每次10 min,最后用二氨基联苯胺(DAB)显色至有清晰的目标蛋白带出现,用无菌水终止反应,并冲洗10 min以终止显色,将膜置于滤纸上自然干燥。 2 结果 2.1 hyastatin基因原核表达载体的构建与鉴定
PCR扩增到约390 bp的基因片段,将回收纯化的目的片段连接到表达载体pET-28a,连接产物转化入大肠感染BL21(DE3)感受态细胞中,挑选阳性菌落抽提质粒,通过菌落PCR和酶切鉴定,均得到390 bp的片段,说明hyastatin基因原核表达载体构建成功(图 1,图 2)。
 |
| M:DL2000 DNA Marker;1-6:阳性克隆 图 1 重组质粒pET28a-Hyastatin 菌液PCR 鉴定 |
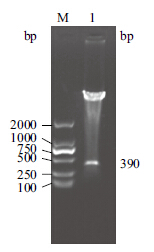 |
| M:DL2000 DNA Marker;1:ppET28a-Hyastatin/Nde Ⅰ+Xho Ⅰ 图 2 重组质粒pET28a-Hyastatin 双酶切鉴定 |
在其他条件一致的情况下,37℃、28℃和16℃不同诱导温度下重组融合蛋白的表达量表明,37℃条件下Hyastatin全菌蛋白表达量明显高于28℃和16℃下的表达量(图 3)。
 |
| M:低分子蛋白Marker;1-3:分别为37℃、28℃和16℃诱导的全菌蛋白 图 3 不同温度诱导表达的SDS-PAGE 分析 |
为0和0.2 mmol/L的IPTG诱导的重组融合蛋白表达量最少,0.1 mmol/L的IPTG诱导的重组融合蛋白表达量最大。浓度为0.4、0.7和1.0 mmol/L IPTG诱导的表达量较少且变化较小,这是因为诱导剂IPTG对细胞有毒性,高浓度IPTG不利于细菌生长,所以该融合蛋白的IPTG最佳诱导浓度是0.1 mmol/L (图 4)。
 |
| M:低分子蛋白Marker;1-6:分别为0、0.1、0.2、0.4、0.7和1.0 mmol/L IPTG诱导的全菌蛋白 图 4 不同IPTG 浓度诱导表达的SDS-PAGE 分析 |
在其他条件一致的情况下,经0-12 h诱导后,诱导时间在4 h,重组融合蛋白的表达量最高。6-10 h重组融合蛋白表达量变化不明显,诱导时间过短(2 h)或过长(12 h),重组融合蛋白的表达量均较少(图 5)。
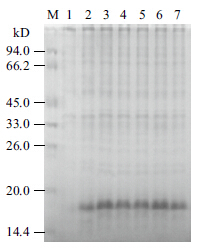 |
| M:低分子蛋白Marker;1-7:分别为诱导0、2、4、6、8、10和12 h后的全菌蛋白 图 5 不同时间诱导表达的SDS-PAGE 分析 |
最佳诱导条件下,即IPTG浓度0.2 mmol/L、37℃条件下培养4 h后,将超声破碎后提取的包涵体上样到HisTrap HP柱上。用咪唑缓冲液洗脱后进行Western blot分析,结果(图 6)表明,纯化后的重组融合蛋白可与His-Tag单克隆抗体结合,表现出与融合蛋白大小一致的条带,大小与SDS-PAGE中诱导后出现的条带吻合,结合测序结果可推断,已成功表达拟穴青蟹Hyastatin多肽。
 |
| M:预染蛋白Marker;1:纯化后的融合蛋白 图 6 用His-Tag 单克隆抗体进行Western blot 分析 |
原核表达是与外源基因表达系统的常见方法,它具有操作简单、成本低、表达效率高、产物稳定且易鉴定等优点。一个高效的原核表达体系的构建,不仅涉及宿主、载体和外源基因三者之间的关系,还受诱导条件的影响[7, 8]。本实验选用常用抗原蛋白表达载体pET-28a (+)作为表达载体,其N、C端带有His-Tag,有利于表达蛋白纯化。将编码拟穴青蟹抗菌肽hyastati蛋白活性核心区的碱基序列插人pET-28a载体,成功获得重组融合蛋白。通过HisTrapHP亲和层析柱,可从包涵体中分离得到纯度较高的重组融合蛋白,为抗菌肽hyastatin基因在拟穴青蟹获得性免疫中的作用及应用研究奠定基础。
研究表明,原核表达体系中,诱导温度、IPTG浓度及表达时间对诱导蛋白影响较大[9, 10, 11]。本实验通过固定其它条件,对单个因子如时间、浓度IPTG和温度的诱导表达后,获得整体的优化。温度在诱导过程中除影响氧的溶解度外,还会加速或延缓酶的反应速率,影响蛋白的性质。本研究中,最佳诱导温度37℃时蛋白表达量最高,28℃和16℃下的表达量依次减少。0.1-1 mmol/L范围内的IPTG均可诱导重组蛋白表达,在降低IPTG对细菌代谢的毒性作用和减少费用前提下,确定其最低有效浓度为0.2 mmol/L。诱导时间在0和2 h表达量较少,诱导4-10 h表达量变化不明显,诱导12 h表达量出现减少,可能与细菌生长到平台期或死亡期后菌体自溶释放蛋白酶降解一部分蛋白有关。本研究通过优化原核表达条件,得出IPTG浓度0.2 mmol/L、37℃条件下培养4 h后表达量最大,分子大小与预期值相符。这些结果为重组蛋白的大量纯化提供可靠实验依据。
本研究中重组蛋白主要以包涵体形式存在于表达产物中。包涵体的存在会影响目的蛋白的纯化,但包涵体形式可以保护蛋白质免受蛋白酶水解,而且利用包涵体的不溶性和致密性,通过离心即相对容易地对之进行提取[12]。包涵体在纯化过程中是否得到复性,是否需溶解复性才能回收正确折叠的重组蛋白还有待于进一步研究。Western blot结果显示,纯化的hyastatin基因表达融合蛋白可与鼠抗Histag单抗发生特异性结合,说明获得了融合蛋白的表达产物,为该蛋白在获得性免疫中的功能研究奠定基础。
养殖过程中因细菌、病毒和其它致病因子经常给拟穴青蟹育苗和养殖造成极大的经济损失[13, 14, 15]。在病原感染早期,拟穴青蟹只能依赖先天性非特异免疫,识别和清除入侵微生物,维持机体健康。因此,抗菌肽类产品有望在促进免疫应答,提高机体自身的抗病能力方面大显身手。目前,研究人员对青蟹抗菌肽hepcidin、scygonadin以及CrusSp等基因进行了克隆表达及抑菌活性分析[16, 17, 18],而拟穴青蟹抗菌肽hyastatin基因原核表达未见报道。本研究成功获得了拟穴青蟹抗菌肽hyastatin基因的重组蛋白,这为后续工作如纯化蛋白、批量获取纯化蛋白、抗体制备等提供前期条件,为进一步更深入地研究其功能、免疫机理奠定基础。 4 结论
本研究通过克隆拟穴青蟹抗菌肽hyastatin基因成熟肽片段,构建原核表达系统后进行优化表达,在IPTG浓度0.2 mmol/L、37℃条件下培养4 h后表达量最大,成功获得目的表达产物。
| [1] | 林琪, 李少菁, 黎中宝, 等. 中国东南沿海青蟹属(Scylla)的 种类组成[J] . 水产学报, 2007, 31(2):211-219. |
| [2] | 丁小丰, 王国良. 锯缘青蟹Scylla serrata 黄水病血液病理学分 析[J] . 海洋科学, 2011, 3(35):64-66. |
| [3] | 李凯, 王国良, 朱文斌, 吕永林. 养殖锯缘青蟹黄水病的流行病 学调查研究[J] . 浙江海洋学院学报:自然科学版, 2013, 5(32): 413-420. |
| [4] | 张迪, 杨铿, 苏友禄, 等. 青蟹呼肠孤病毒和青蟹双顺反子病 毒-1 双重巢式PCR 检测方法的建立[J] . 中国水产科学, 2013, 4(20):808-815. |
| [5] | 黄文树, 李少菁, 王克坚. 锯缘青蟹抗菌肽Scygonadin 基因的 转录表达特性研究[J] . 厦门大学学报:自然科学版, 2008, 6 (47):897-90. |
| [6] | Sperstad SV, Haug T, Vasskog T, et al. Hyastatin, a glycine-rich multi-domain antimicrobial peptide isolated from the spider crab (Hyas araneus)hemocytes[J] . Molecular Immunology, 2009, 46 (13):2604-2612. |
| [7] | 尹长城, 黄华. 大肠杆菌表达系统[M] . 北京:北京医科大学 出版社, 2002. |
| [8] | 王蓓, 李桂欢, 鲁义善, 等. 吉富罗非鱼源无乳链球菌Sip- GAPDH 融合基因的构建及其原核表达[J] . 生物技术通报, 2014(7):137-142. |
| [9] | 杨学明, 何荆洲, 张立, 等. 革胡子鲶GH 成熟肽在大肠杆菌中 表达条件的优化[J] . 生物技术通报, 2010(10):182-184. |
| [10] | 岳盈盈, 李鹏, 李志会, 等. 风疹病毒包膜糖蛋白E1 的原核 表达及条件优化[J] . 山东医药, 2010, 50(3):18-19. |
| [11] | Gao Q, Zhao JM, Song LS, et al. Molecular cloning, characterization and expression ofheat shock protein 90 gene in the haemocytes of bay scallop Argopecten irradiants[J] . Fish & Shellfish Immunology, 2008, 24(4):379-385. |
| [12] | 魏世娜, 王蓓, 鲁义善. 等. 红笛鲷NCCRP-1 基因原核表达 条件的优化及纯化[J] . 广东海洋大学学报, 2010, 30(6): 25-30. |
| [13] | 冯振飞, 王国良, 钱冬, 等. 锯缘青蟹养殖环境中细菌类群及 其数量分布[J] . 水产科学, 2008, 27(11):574-577. |
| [14] | 蔡小辉, 彭银辉, 刘旭佳, 等. 青蟹呼肠孤病毒对拟穴青蟹的 致病性研究[J] . 水产科学, 2013, 32(3):130-135. |
| [15] | 李 凯, 王国良, 朱文斌, 等. 养殖锯缘青蟹黄水病的流行病学 调查研究[J] . 浙江海洋学院学报:自然科学版, 2013, 32(5): 413-420. |
| [16] | 王克坚. 海洋鱼类和青蟹抗菌肽hepcidin 和scygonadin 的研 究[J] . 厦门大学学报:自然科学版, 2011, 50(2):418- 424. |
| [17] | Imjongjirak C, Amparyup P, Tassanakajon A. Two novel antimicrobial peptides, a rasin-likeSp and GRPSp, from the mud crab Scylla paramamosain, exhibit the activity against some crustacean pathogenic bacteria[J] . Fish & Shellfish Immunology, 2011, 30(2):706-712. |
| [18] | 徐栋梁, 李洁颖, 彭永鹤, 等. 拟穴青蟹抗菌肽CrusSp 基因克 隆表达及抑菌活性分析[J] . 华南师范大学学报:自然科学版, 2011(1):93-97. |




