2. 湿地生态与农业利用教育部工程研究中心,荆州 434025
2.Engineering Research Center of Ecology and Agricultural Use of Wetland,Ministry of Education,Jingzhou 434025
铁离子代谢平衡对生命体至关重要,包括活性氧运输、电子传递和DNA合成等过程都离不开铁离子的参与。游离铁离子的浓度也是病原菌赖以生存及病感染机体造成危害的重要因素[1]。转铁蛋白受体(TfR)是一种细胞膜相关糖蛋白,是调控细胞内铁离子吸收的"开关"。尽管TfR分子不直接和细胞中的铁离子结合,但却可通过调控与细胞质内转铁蛋白(Transferrin,Tf)的结合达到细胞内铁离子运输和存储平衡[2]。目前,已知转铁蛋白受体有两类(TfR1和TfR2),它们在分子结构上比较相似,但表达调控模式和功能上有着较大差异[3]。TfR1分子几乎可以在所有正常细胞中表达,但在成熟红细胞及多能造血干细胞中很少或几乎不表达[2];TfR2分子则是一种特异性介导肝脏细胞铁离子代谢的糖蛋白,主要在肝脏及十二指肠隐窝细胞中表达[4]。TfR1分子目前比较明确的作用就是调控细胞对铁离子的吸收[2],而TfR2分子对体内铁平衡的调节作用比它对铁的摄取作用重要得多[5]。迄今为止,只有人类和小鼠转铁蛋白受体基因及其功能进行了较为深入的研究。牛[6]、猪[7]、大菱鲆[8]和草鱼[9]等少数物种上也已有转铁蛋白受体分子被报道。有关于黄鳝转铁蛋白受体基因及其功能的研究国内外尚无报道。黄鳝是我国及许多东南亚国家重要的淡水养殖种类,具有较高的食用和药用价值。克隆并研究其铁离子代谢相关功能基因有助于了解黄鳝抗细菌病的分子机制及促进黄鳝健康养殖业的发展。本研究通过同源克隆结合RACE的方法从黄鳝肝脏cDNA中克隆了TfR1基因cDNA全长,对其进行生物信息学分析并研究其组织表达特异性,旨在为深入了解鱼类TfR1基因在铁离子代谢中的作用提供基础资料。 1 材料与方法 1.1 材料
健康成体黄鳝(体质量75-110 g)购买于荆州市太湖水产市场。pMD18-T克隆载体、PrimeScript RT reagent试剂盒、DL2000 DNA Marker等购至大连TaKaRa公司;Trizol试剂购买于Invitrogen公司;DH5α感受态细胞、DNA凝胶回收试剂盒为北京全式金公司产品;Smart Race cDNA Amplification Kit试剂盒购买于Clontech公司。 1.2 方法 1.2.1 总RNA提取、引物设计及cDNA片段获得
随机选取3条鳝鱼进行解剖取其血细胞、心脏、肝脏、脾脏、胃、肾脏、皮肤、肌肉、肠和脑等10种组织速冻于液氮中,保存于-80℃冰箱,用于RNA的提取。总RNA提取采用Trizol试剂按照说明书进行。cDNA合成用TaKaRa公司的PrimeScript RT regent试剂盒按照说明书进行。根据GenBank上报道的猪(Sus scrofa,NP_999166.1)、普通狨(Callithrix jacchus,NP_001288776.1)、人(Homo sapiens,BAF84-412.1)、狞猫(Caracal caracal,AFM73555.1)、黄牛(Bos taurus,ADE09354.1)、斑马鱼(Danio rerio,NP_001009917.1)、青鳉(Oryzias latipes,XP_0040-79020.1)、虹鳟(Oncorhynchus mykiss,CDQ90669.1)和红鳍东方鲀(Takifugu rubripes,XP_003975880.1)的TfR1基因cDNA序列设计了简并性引物de-F (5'-ccctcsttyaaycacacncagtt-3')和de-R (5'-gccctggatgntccaggtggc-3')用来扩增肝脏cDNA。PCR反应程序为:94℃ 4 min;94℃ 30 s,58℃ 30 s,72℃ 1.5 min,35个循环;72℃延伸7 min。扩增得到的产物经回收纯化后克隆至pMD18-T载体,转化大肠杆菌挑取3个阳性克隆送上海博尚生物科技有限公司进行序列测定。 1.2.2 黄鳝TfR1基因cDNA全长的获得
根据上述所得cDNA片段,设计基因特异性引物GSP5(5'-ga atgtgggtagccatgcctgctgtg-3')和GSP3(5'-acatccagaacagcgacctg-3')用来进行RACE扩增。RACE采用Smart Race cDNA Amplification Kit试剂盒说明书进行。PCR扩增产物经回收纯化后克隆至pMD18-T载体,转化大肠杆菌挑取3个阳性克隆送上海博尚生物科技有限公司进行序列测定。将上述所得5'UTR、3'UTR及中间cDNA片段进行拼接后即得黄鳝TfR1基因cDNA全长。 1.2.3 黄鳝TfR1基因序列分析及进化树构建
利用SignalP 4.1软件(http://www.cbs.dtu.dk/services/SignalP/)对黄鳝TfR1基因推断的氨基酸序列进行信号肽预测。采用蛋白质二级结构分析软件prosite (http:prosite.expasy.org/cg-bin/prosite/)对其进行N-糖基化位点和O-糖基化位点的分析。采用SMART软件对其进行功能结构域分析(http://smart.emblheidelberg.de/)。用DNAMAN软件对不同物种的TfR1基因进行多序列比对。采用MEGA4.0软件中的N-J法构建遗传进化树。 1.2.4 黄鳝TfR1基因组织表达分析
将各组织总RNA用无RNAase的DNase I消化后反转录获得cDNA第一条链。采用基因特异性引物rt-F1(5'-gtccatgatcatctattgcggat-3')和rt-R1(5'-gtactccaccttcatgatgc-3')检测各组织中TfR1基因转录本的表达量,以β-actin基因的表达量为内参,设计的β-actin的引物为actin-F1(5'-gctgtgctgtccctgta-3')和actin-R1(5'-gagtagccacgctctgtc-3')。 2 结果 2.1 黄鳝TfR1基因cDNA序列分析
以简并引物de-F/de-R和黄鳝肝脏cDNA为模板进行PCR扩增获得了1条约长1 300 bp的条带,经序列测定后认为是TfR1基因的cDNA片段。经过5'RACE和3'RACE扩增分别获得了该基因的5'UTR区域和3'UTR区域,序列拼接后得到了全长cDNA序列(GenBank登录号:KF819396)。序列分析(图 1)表明,黄鳝TfR1基因cDNA全长2 839 bp,5'UTR长134 bp,3'UTR长380 bp,编码一个长774个氨基酸的多肽链,还包含一个15 bp的poly (A)尾巴。
 |
| 方框表示N-糖基化位点;阴影表示poly (A)尾巴 图 1 黄鳝TfR1 基因全长cDNA 及推断的氨基酸序列 |
二级结构分析表明,该TfR1基因推断的氨基酸序列没有信号肽序列;在开放阅读框内可能存在着4个N-糖基化位点和2个O-糖基化位点(S107和S108)(图 1);跨膜区(TM)位于L77和H99之间,将TfR1基因分成短的N端和长的C端。C端含有完整的TFR_dimer域、肽酶M28结构域、PA结构域和一个小的SCOP结构域(图 2)。
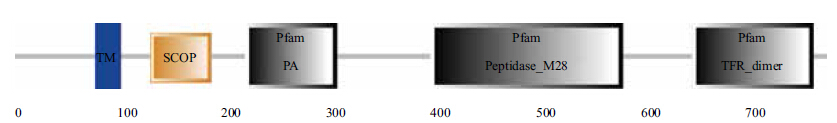 |
| 图 2 黄鳝TfR1 基因功能结构域 |
将黄鳝TfR1基因推断的氨基酸序列与其他物种的TfR1基因用DNAMAN软件比对(图 3)发现,同其他物种TfR1基因相比,黄鳝TfR1基因与红鳍东方鲀、青鳉、虹鳟、斑马鱼的同源性较高,分别达到了68.41%、67.65%、58.90%和55.68%;而与人、猪、狞猫和狨等脊椎动物的同源性较低。基于MEGA4.0软件的N-J法构建的分子进化树(图 4)表明,黄鳝与其他鱼类的TfR1聚于一个分支,同人、猪等其他脊椎动物亲缘关系较远。
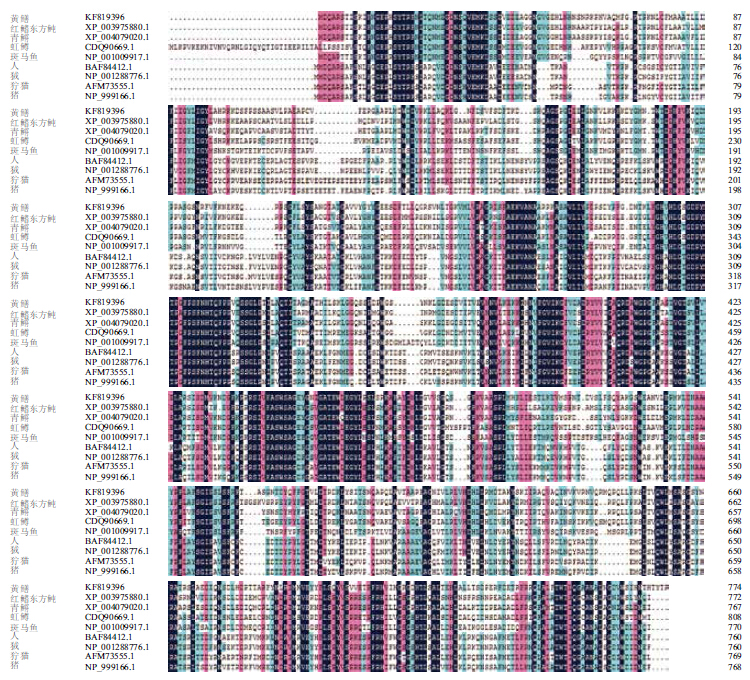 |
| 图 3 黄鳝TfR1 基因推断的氨基酸序列与其他物种的比较 |
 |
| 图 4 基于N-J 法构建的分子遗传进化树 |
用RT-CR法对黄鳝的10种组织进行TfR1基因转录本的检测分析,结果(图 5)显示,在所检测到的10种组织里,TfR1基因表达量有明显差异;在血细胞(Bc)中表达量最高,在肾脏(K)、脾脏(Sp)、小肠(I)中表达量中等,在皮肤(S)、胃(St)、肝脏(L)、肌肉(M)、心脏(H)和脑(B)中表达量较低。
 |
| S:皮肤:Sp:脾脏:St:胃:K:肾脏:L:肝脏:Bc:血液:B:脑:I:肠:H:心脏:M:肌肉;Marker:DNA Marker 图 5 黄鳝TfR1 基因的组织表达分析 |
铁离子对生命体至关重要,Tf-TfR复合物不仅在调控细胞铁离子代谢吸收平衡及降低Fe3+离子转化为Fe2+造成的细胞毒性过程中具有重要的作用,而且在机体系统性免疫机制激活中也具有重要作用[10]。当病原细菌入侵细胞后,在细胞质外由于大部分铁离子(Fe3+)被Tf分子结合从而导致病原细菌因缺乏足够游离铁而不能生存;这些过量被Tf饱和的铁会通过形成Tf-2Fe-TfR复合物的形式通过内噬作用进入细胞质内参与细胞代谢[11]。
不同物种来源的TfR1基因往往具有相类似的基因结构和功能域[6, 12];相同物种的TfR1和TfR2基因之间在结构和功能域之间也相对保守[6],不同图 2黄鳝TfR1基因功能结构域之处在于TfR2基因3'UTR区域往往缺少铁反应元件(IREs)表达不受铁状态调节[13]。这为采用同源克隆的方法克隆TfR基因提供了便利条件。本研究就是根据不同物种TfR1功能保守区设计简并引物获得的黄鳝TfR1片段,进而获得全长cDNA。人类的TfR1分子是一个同源二聚体分子,每个单体包含有1个760个氨基酸长的多肽。每个多肽由1个长671个氨基酸的胞外C端、1个61个氨基酸长的胞内N端区域和1个28个氨基酸长的跨膜区3个部分组成。牛的TfR2和TfR1基因结构域非常保守,唯一的区别在于TfR1基因C端含有一个小的SCOP区,类似结构也在人的TfR1基因上被发现[6]。本研究发现黄鳝TfR1基因结构上可分为3个主要的功能区域,C端长675个氨基酸,N端长76个氨基酸,跨膜区长22个氨基酸,在M129和E186间也存在一个长58个氨基酸的SCOP区域。另外,人的TfR1的胞外区存在3个N-糖基化位点和1个O-糖基化位点,这些糖基化位点是TfR执行功能必须的位点[14]。本实验也在黄鳝TfR1分子C端发现了4个N-糖基化位点和2个O-糖基化位点,造成这种现象的原因可能是由于所使用分析软件不同的算法造成的。
人类的TfR1基因在除了一些成熟的红细胞和已终止分化的细胞外的细胞中都可表达,但表达量会有很大差异[2]。处于不断增值的如肿瘤细胞其TfR1的基因表达量会很高,这可能是因为细胞对铁的需求量增加的原因[15]。人类TfR2分子的表达特征与TfR1也有不同;TfR1在肝脏中表达较低,而TfR2在肝脏中高表达,胃中低表达,其他组织TfR2表达量十分低[12]。林亚秋等[9]的研究表明草鱼的TfR1基因转录本可在12种健康组织中检测到,但脑和鳍中的表达量最高,肝脏等组织表达量中等,而黏液与鱼鳔中的表达量最低。张立春等[6]发现牛的TfR2基因主要在肝脏组织中表达,其他器官如脾脏、心脏和肠道也有少量表达,这个结果与人的组织分布规律基本一致,从而在一定程度上证明了不同物种TfR基因功能的保守性。本研究发现,在黄鳝的10种健康组织里,血细胞的表达量最高,而肝脏、脾脏、心脏、肌肉、肾脏和小肠等组织里TfR1基因转录本都较低的表达;这也与人类和草鱼TfR1基因表达情况类似;在血细胞里的表达量比较高的原因可能是血细胞形成需要更大量的铁,因为血红素细胞铁的含量占成体铁含量总量比重较高[2]。 4 结论
本研究通过同源克隆结合RACE技术克隆得到了黄鳝TfR1类分子全长cDNA序列,该基因与已知鱼类TfR1基因具有较高的同源性,具有其他物种TfR1基因相类似的结构功能区域和糖基化位点,是脊椎动物TfR家族中一个新成员。该基因在黄鳝不同健康组织里具有不同的表达水平,血细胞中表达量最高,而在肝脏、脾脏和小肠等组织里表达量较低。
| [1] | Wally J, Buchanan SK. A structural comparison of human serum transferrin and human lactoferrin[J]. Biometals, 2007, 20 :249- 262. |
| [2] | Ponka P, Lok CN. The transferrin receptor :role in health and disease[J]. The International Journal of Biochemistry & Cell Biology, 1999, 31 :1111-1137. |
| [3] | Smilevska T, Stamatopoulos K, Samra M, et al. Transferrin receptor-1 and 2 expression in chronic lymphocytic leukemia[J]. Leukemia Research, 2006, 30 :183-189. |
| [4] | Kawabata H, Yang R, Hirama T, et al. Molecular cloning of transferrin receptor 2. A new member of the transferrin receptorlike family[J]. Journal of Biology Chemistry, 1999, 274(30): 20826-20832. |
| [5] | Camaschella C, Roetto A, Cali A, et al. The gene TFR2 is mutated in a new type of haemochromatosis mapping to 7q22[J]. Nat Genet, 2000, 25(1):14-15. |
| [6] | 张立春, 金海国, 李赵志, 等. 延边黄牛转铁蛋白受体2 基因 克隆与序列分析[J]. 中国农业科学, 2012, 45(10):2022- 2030. |
| [7] | Ricard MA, Archibald FS, Niven DF. Isolation and identification of a putative porcine transferrin receptor from Actinobacillus pleuropneumoniae biotype 1[J]. J Gen Microbiol, 1991, 137(12): 2733-2740. |
| [8] | Yang CG, Liu SS, Sun B, et al. Iron-metabolic function and potential antibacterial role of Hepcidin and its correlated genes (Ferroportin 1 and Transferrin Receptor)in Turbot(Scophthalmus maximus)[J]. Fish & Shellfish Immunology, 2013, 34 :744-755. |
| [9] | 林亚秋, 郑玉才, 吉红, 等. 草鱼转铁蛋白受体cDNA 序列克隆 及其组织表达差异[J]. 湖北农业科学, 2009, 48(6):1289- 1292. |
| [10] | Brandsma ME, Jevnikar AM, Ma S. Recombinant human t r a n s f e r r i n :B e y o n d i r o n b i n d i n g a n d t r a n s p o r t[ J ] . Biotechnology advances, 2011, 29 :230-238. |
| [11] | Qian ZM, Li H, Sun HZ, et al. Targeted drug delivery via the transferrin receptor mediated endocytosis pathway[J]. Pharmacol Rev, 2002, 54 :561-587. |
| [12] | 常彦忠, 段相林, 钱忠明. 转铁蛋白受体2 及其功能与相关疾 病[J]. 生物化学与生物物理进展, 2003, 30(4):533-536. |
| [13] | Hentze MW, Muckenthaler MU, Andrews NC. Balancing acts : molecular control of mammalian iron metabolism[J]. Cell, 2004, 117(3):285-297. |
| [14] | Williams AM, Enns CA. Mutated transferrin receptor lacking asparagine-linked glycoprotein sites shows reduced functionality and an association with binding immunoglobulin protein[J]. Journal of Biological Chemistry, 1991, 266 :17648-17654. |
| [15] | Prutki M, Poljak-Blazi M, Jakopovic M, et al. Altered iron metabolism, transferrin receptor 1 and ferritin in patients with colon cancer[J]. Cancer Lett, 2006, 238(2):188-196. |




