2. 广东省普通高校 南海水产经济动物增养殖重点实验室,湛江 524088 ;
3. 广东省水产经济动物病原生物学及流行病学重点实验室,湛江 524088
2.Key laboratory of Aquaculture in South China Sea for Aquatic Economic Animals,Regular Higher Education Institute of Guangdong Province,Zhanjiang 524088;
3.Guangdong Provincial Key Laboratory of Pathogenic Biology and Epidemiology for Aquatic Economic Animals,Zhanjiang 524088)
卵形鲳鲹(Trachinotus ovatus)隶属于鲹科(Carsngidae)鲳鲹属(Trachinotus),为暖水性鱼类。近年来,随着人工育苗的成功和养殖技术日趋成熟,卵形鲳鲹的人工养殖在华南沿海地区迅速展开,成为海水鱼类养殖的主要品种之一。卵形鲳鲹属于温水型鱼类,低温环境将对卵形鲳鲹的养殖生产产生极大的影响,限制着卵形鲳鲹养殖业的发展。目前有关低温应激对卵形鲳鲹血清生化、免疫指标、激素的影响已开展研究[1],但关于卵形鲳鲹耐低温候选基因的筛选及全长克隆和低温胁迫对其表达量的影响尚未见报道。
鱼类的耐低温性状是一种重要的经济性状,也是一种数量性状,受微效多基因控制[2]。研究表明,鱼类在遭遇冷胁迫时为了保持生理稳态不被破坏,通过提高细胞膜上不饱和脂肪酸的比例来增加细胞膜的流动性,维持细胞在低温下的生理活性[3]。低温环境下磷脂中不饱和脂肪酸(特别是DHA)的积累是膜流动性对于温度适应的一种表现[4],控制脂肪酸去饱和反应,提高不饱和脂肪酸含量可以改善鱼类的抗寒性[5]。因此,细胞膜脂肪酸的脱饱和是鱼类在低温胁迫下的重要适应机制[6]。鱼类△ 6脂肪酸去饱和酶(△6FAD)是参与鱼类多不饱和脂肪酸(PUFA)生物合成的关键酶,大量研究证明,营养因素和环境因素会影响鱼类PUFA生物合成关键酶基因的表达水平,进而影响鱼类高度不饱和脂肪酸的合成[7]。多不饱和脂肪酸,尤其是二十二碳六烯酸(DHA)和二十碳五烯酸(EPA)作为鱼类的必须营养素在维持生命体的正常机能,促进生长、发育、繁殖和提高成活率等方面发挥着不可替代的生理作用。有关脂肪酸去饱和酶基因家族与植物抗冷性状的研究目前已有大量的研究,如白云豆[8]及油菜[9]的SAD (硬脂酰-ACP去饱和酶)和橄榄[10]、马齿苋[11]的FAD (脂肪酸去饱和酶)在转录水平均受低温调节,但与水生生物抗寒性的研究还较少。
本研究克隆卵形鲳鲹△6FAD cDNA的序列全长,并对该基因进行生物信息学分析,同时研究低温胁迫下卵形鲳鲹肝脏组织中该基因的表达模式,旨在为探究卵形鲳鲹多不饱和脂肪酸的合成机制及与温度调节的关系提供参考。 1 材料与方法 1.1 材料 1.1.1 实验材料
实验用鱼来自广东海洋大学东海岛海洋生物研究基地。鱼体健康,活力良好的卵形鲳鲹(约30 g)共195尾,分为5个实验组和1个对照组,每组3个平行,在温控循环水族箱中暂养一周后用于实验。 1.1.2 主要仪器和试剂
Trizol购自北京全式金生物有限公司。M-MLV Reverse Transcriptase、Oligo (dT)18、dNTP、Ribonuclease Inhibitor、DNA Marker、pMD18-T Vector均购自TaKaRa公司。UNlQ-10柱式Trizol总RNA抽提试剂盒、UNIQ-10柱式微量琼脂糖凝胶DNA回收试剂盒购自上海生工生物有限公司;3'-Full RACE Core Set with PrimeScriptTM RTase和5'-Full RACE Kit with TAP试剂盒均购自TaKaRa公司;F-416XL DyNAmo ColorFlash SYBR和AB-1182 ABgene Strips of 8 Tub购自美国Thermo Fisher Scientific公司,PCR仪为Bio-Rad公司和TaKaRa公司。荧光定量PCR仪为美国ABI公司产品。 1.2 方法 1.2.1 低温处理
实验期间每天投喂商品饲料两次,实验开始后采用3℃/d的降温方式对实验组从常温28℃开始进行降温处理直至分别降到预先设定的实验温度25℃、22℃、19℃、16℃和13℃,对照组则保持28℃的恒温。实验组卵形鲳鲹在各实验温度下分别喂养0、12、24、36、48、60、72和84 h后随机采样,取肝脏组织储存于液氮中用于后续实验。 1.2.2 卵形鲳鲹△ 6脂肪酸去饱和酶cDNA全长序列的克隆 1.2.2.1 总RNA的提取
取于-80℃保存的卵形鲳鲹肝脏组织50-100 mg,按照上海生工的UNlQ-10柱式Trizol总RNA抽提试剂盒中推荐的方法提取、纯化总RNA,提取的总RNA样品经过微量核酸定量仪测定其OD260/OD280值。 1.2.2.2 中间片段的获取
按TaKaRa公司M-MLV Reverse Transcriptase说明书步骤将上述提取的总RNA进行RT反应,随后应用基于其他物种△ 6脂肪酸去饱和酶基因序列设计的特异性引物PCR扩增卵形鲳鲹△ 6FAD的中间片段。PCR扩增条件为:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸45 s,32个循环。最后得到大小为300 bp左右的PCR产物,产物经切胶回收纯化后克隆到pMD18-T Vector上,并转化到感受态细胞E.coli DH5α中,经菌落PCR鉴定,挑选阳性克隆后送上海生工测序。 1.2.2.3 卵形鲳鲹△ 6FAD的3'和5'RACE
根据同源克隆获得的△ 6FAD大小为303 bp的中间片段,设计用于3'和5'序列全长扩增的特异性引物(表 1)。按照TaKaRa公司的3'-Full RACE Core Set with PrimeScriptTM RTase试剂盒要求,分别进行3'RACE和5'RACE扩增。3'RACE首轮和次轮PCR反应条件分别为:94℃预变性3 min;94℃变性30 s,55℃退火30 s,72℃延伸1 min 55 s,共25个循环;94℃预变性3 min,94℃变性30 s,55℃退火30s,72℃延伸1 min 55 s,共30个循环。5'RACE第一轮和第二轮PCR退火温度分别为:55.8℃和57.8℃,PCR程序同上。随后,纯化RACE-PCR产物并进行克隆和测序。
采用ORF Finder (http://www.ncbi.nlm.nih.gov/gorf/gorf.html)和protparam (http://web.expasy.org/protparam/)确定开放阅读框(ORF)并预测由该阅读框编码蛋白的分子量计算值(Mw)和理论等电点(pI);通过在线分SignalP 4.1 Server (http://www.cbs.dtu.dk/services/SignalP)预测信号肽序列;以TMHMM在线服务器(http://cbs.dtu.dk/services/TMHMM-2.0)预测该编码蛋白中存在的跨膜结构域;应用在线预测软件SOPMA (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和PredictProtein (http://www.predictprotein.org/)预测蛋白二级结构。应用Prosite (http://prosite.expasy.org/)和NCBI的CDD (http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)工具预测蛋白质结构域、家族和功能位点;氨基酸序列同源性分析和系统进化树的构建分别采用Vector NTI 11和MEGA6软件。 1.2.3 实时荧光定量PCR分析
将低温胁迫处理下采集的肝脏组织进行RNA的提取,并通过琼脂糖凝胶电泳和微量核算定量仪检测其总RNA的完整性、OD值和浓度。在检测卵形鲳鲹△ 6FAD在两种低温胁迫处理下的表达水平前,先将提取的所有样品总RNA进行反转录成cDNA,再按照Thermo公司的F-416XL DyNAmo ColorFlash SYBR试剂盒使用说明,采用SYBR Green Ⅰ嵌合荧光法进行实时定量PCR扩增反应。在荧光定量PCR仪上设置好孔的位置且各样品均设置3个复孔。反应条件为:94℃预变性5 min;94℃变性20 s,57.5℃退火30 s,72℃延伸30 s,进行40个循环;最后72℃延伸30 s。设置好PCR过程中检测的临界点,每个循环退火末期检测荧光信号。最后在反应条件中加入分析模式为:70-95℃升温,其中每次升温0.5℃,反应时间为10 s的熔解曲线分析,以卵形鲳鲹β-actin为内参,对得到的各样品Ct值进行均一化处理,应用2-ΔΔCT法确定不同处理方式下肝脏组织中△ 6FAD的相对表达量,实验数据采用SPSS19.0进行单因素显著性分析和Duncan多重性比较。 2 结果 2.1 总RNA的提取提取
的总RNA样品经过微量核酸定量仪,测定其OD260/OD280值均在1.8-2.0之间,说明提取的总RNA较为单一。1%琼脂糖凝胶电泳显示清晰的28S和18S rRNA条带(图 1),说明提取的总RNA样品完整性良好,可以用于下一步实验。
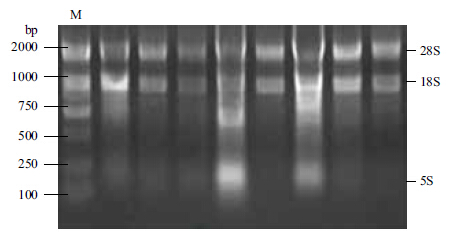 |
| 图 1 肝脏组织中提取的总RNA |
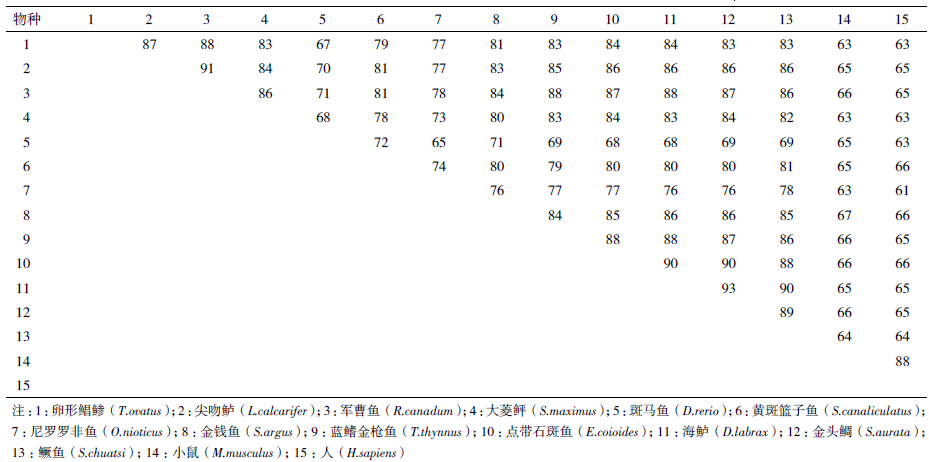
经DNAman工具拼接后获得全长为1 908 bp的卵形鲳鲹△ 6脂肪酸去饱和酶基因的全长cDNA序列(GenBank登录号:KP295471),开放阅读框1 329 bp,编码442个氨基酸残基(图 2)。利用Vector NTI 11软件将得到的卵形鲳鲹△ 6FAD基因所编码的氨基酸序列与GenBank上公布的其他物种的△ 6FAD的氨基酸序列进行同源性比对,结果(表 2)显示,该基因编码的氨基酸序列与其他鱼类的△ 6脂肪酸去饱和酶氨基酸序列具有很高的相似度,与尖吻鲈(Lates calcarifer)、军曹鱼(Rachycentron canadum)、大菱鲆(Scophthalmus maximus)、点带石斑鱼(Epinephelus coioides)、金头鲷(Sparus aurata)和鳜鱼(Siniperca chuatsi)的同源性分别高达87%、88%、83%、84%、83%和83%,但与斑马鱼(Danio rerio)、小鼠(Mus musculus)和人(Homo sapiens)等哺乳动物同源性较低,分别为67%、63%和63%。
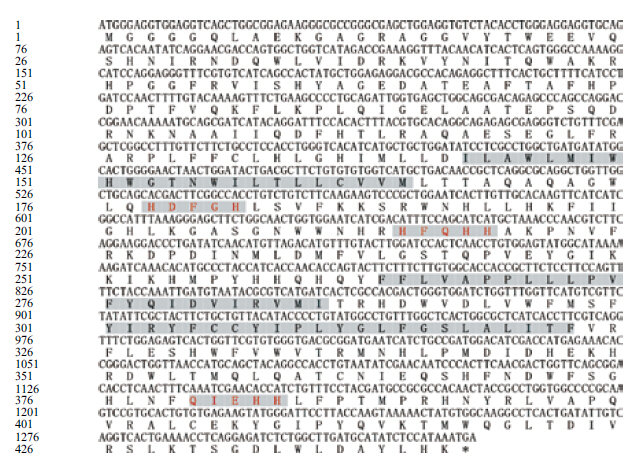 |
| 阴影部分为该推测氨基酸序列预测的跨膜螺旋区;阴影加红色字体为3个组氨酸的富集区域 图 2 卵形鲳鲹△ 6FAD 基因cDNA 开放阅读框及推测编码的氨基酸序列 |
Protparam预测该编码氨基酸理论分子质量约为52 kD,理论等电点8.88,其中Leu最多,有47个,占总氨基酸数的10.6%,其次分别是His和Phe,分别为32个和29个,占总氨基酸数的7.2%和6.6%,最少的为Cys,只有6个,占总氨基酸的1.4%。蛋白质序列中不存在Pyl和Sec,含正电荷残基数42个,负电荷残基数36个,不稳定指数为40.05,被分类为不稳定蛋白。该蛋白的理论疏水值和总平均亲水性分别为87.81和-0.167,属于一种疏水性蛋白,脂肪族氨基酸指数也因序列中含有较多的Leu而高达87.81。 2.4 卵形鲳鲹△6FAD氨基酸序列信号肽和亚细胞定位
SignalP预测中未检测到该蛋白中存在信号肽,故该蛋白应不属于分泌蛋白(图 3)。PSORT II Prediction对△6FAD的亚细胞定位结果中显示,卵形鲳鲹△6FAD定位于细胞质中的可能性最高,为39.1%,其次分别为内质网34.8%、线粒体13%,细胞外、分泌囊泡和高尔基体中可能性最低,均为4.3%。
 |
| 图 3 △ 6FAD 蛋白的信号肽预测分析 |
PredictProtein和SPOMA对卵形鲳鲹△6FAD氨基酸二级结构的预测中呈现出相似的结果,都显示螺旋结构(helix)和无规则卷曲结构(Beta turn)为该蛋白质二级结构中的主要构成部分,分散存在于整个蛋白质结构中。其中在SPOMA的预测结果中显示α螺旋(Alpha helix)和无规则卷曲(random coil)分别有170处和145处,占总二级结构的38.46%和32.81%;其次,链延伸结构(Extended strand)有90处,占20.36%,而β转角(Beta turn)在整个蛋白的二级结构中含量最少,只有37处,占8.37%(图 4)。在PredictProtein的结果中还显示该蛋白可能存在3个跨膜区螺旋,4个跨膜区,共形成4个跨膜区拓扑结构。在TMHMM在线服务器反馈的结果中也明显看到在氨基酸序列的143-165、264-286、301-323这3个区域存在3个跨膜螺旋区,这一结果与PredictProtein中预测的跨膜螺旋区数目一致。在Prosite和NCBI的CDD的预测结果中均显示该编码蛋白在位置为16-93上含有一个属于细胞色素b5家族的血红素结合结构域(heme-binding domain);此外,NCBI的CDD分析显示,该蛋白具有膜结合脂肪酸去饱和酶超家族的保守脂肪酸去饱和酶结构和一个类△ 6脂肪酸去饱和酶结构(图 5)。
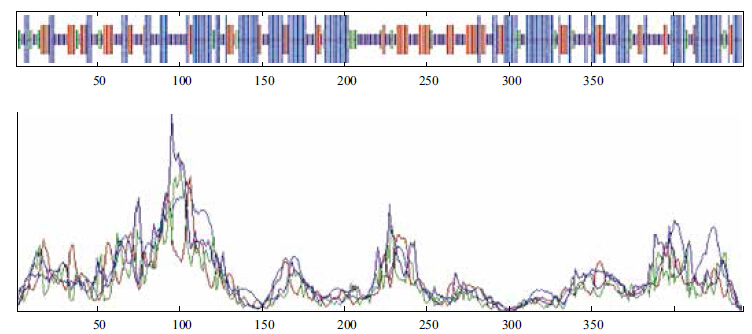 |
| 蓝线表示α-螺旋(Alpha helix);红线表示延伸链(Extended strand);绿线表示β-转角(Beta turn);黄线表示无规则卷曲(random coil) 图 4 △6FAD 蛋白的二级结构预测图 |
 |
| 图 5 CDD 预测的△6FAD 蛋白的结构域分析图 |
应用MEGA6软件将推测的卵形鲳鲹△6FAD氨基酸序列及从GenBank下载的其他物种的同种基因推测的氨基酸序列进行比对分析并按NJ法构建该基因在这些物种中的进化树。结果(图 6)表明,卵形鲳鲹与尖吻鲈(Lates calcarifer)、军曹鱼(Rachycentron canadum)在进化关系上最为接近,其次是大菱鲆(Scophthalmus maximus)、蓝鳍金枪鱼(Thunnus thynnus)和点带石斑鱼(Epinephelus coioides),但却与斑马鱼(Danio rerio)、小鼠(Mus musculus)和人(Homo sapiens)表现出较远的进化关系,这一结果与氨基酸序列相似性比对结果一致。
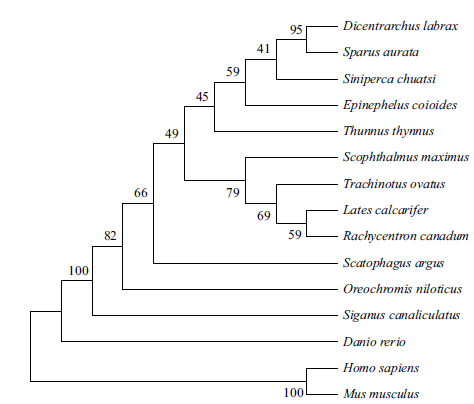 |
| 图 6 △6 FAD 蛋白同源序列的分子进化树 |
在卵形鲳鲹△6FAD基因随温度变化的相对表达分析中,各实验组降到目标温度12 h后卵形鲳鲹肝脏中△6FAD基因的表达量被测定。结果(图 7)显示,该基因的表达量在28℃到13℃范围内随温度的降低先缓慢降低后又迅速升高,13℃时达到峰值,并与其他各温度下的表达量存在显著性差异(P < 0.05),而对照组中则基本保持平衡,各组间表达量差异不显著(P>0.05)。而不同低温下随时间变化的相对表达分析中,该基因的时序表达模式在不同低温下不同,其中13℃时表现出的时序表达模式与16℃和19℃出现明显差异。13℃下,△6FAD的表达量随时间的增加先降低后升高,最终恢复至原来水平,与0 h时差异不显著(P>0.05),而16℃和19℃下,该基因的表达量则表现出一种反馈式的调节方式且逐渐随时间降低(图 8)。
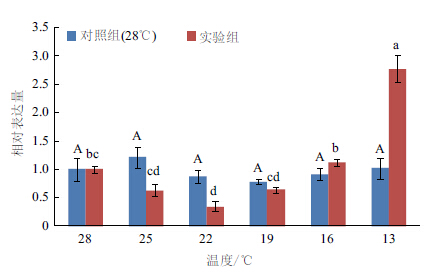 |
| 不同大小写字母表示各组内差异显著(P<0.05) 图 7 △6 FAD 基因随温度变化的相对表达分析 |
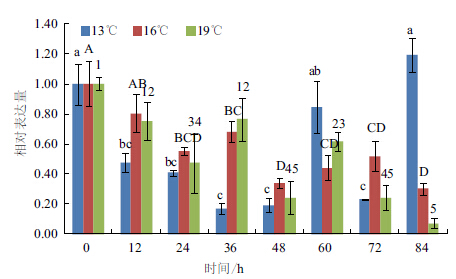 |
| 不同大小写字母表示各组内差异显著(P<0.05) 图 8 △6 FAD 基因在不同低温下随时间的相对表达分析 |
△6FAD是一种膜结合脂肪酸去饱和酶,属于脂肪酸去饱和酶家族中的一员,是生物体内参与多不饱和脂肪酸合成的关键酶。在n-3或n-6途径合成多不饱和脂肪酸的过程中,△ 6FAD主要以NADH、细胞色素b5氧化还原酶作为电子供体,催化甘油酯中的脂肪酸脱氢[12]。鱼类脂肪酸代谢对环境温度的变化极为敏感,温度胁迫下发生的生物膜膜脂结构重组及成分变化等温度补偿机制普遍存在于鱼体中。当水温急剧下降时,鱼类肝、肾、心脏等组织的细胞膜膜脂流动性和弹性减弱,膜脂的不对称性使膜体紧缩不均匀而造成破损渗漏或通透性增加,胞内溶质外流入血,引起鱼的血清生化指标的变化[13];Lyons等[14]的"膜脂相变"学说指出低温下首先伤害的是细胞膜膜相,膜脂从液晶相变为了凝胶相,因此影响了膜的流动性。低温下生物膜能否保持适当的流动性与生物耐寒性之间有一定的相关性,而生物膜的流动性主要取决于膜脂的脂肪酸组成[15]。膜脂中的不饱和脂肪酸成分在增加膜脂流动性和黏滞性方面起着重要作用,因此,膜脂中的不饱和脂肪酸可能成为物种抗寒能力的一个关键机制。 3.2 卵形鲳鲹△6FAD基因全长cDNA的克隆及生物信息学分析
本实验中获得的卵形鲳鲹△6FAD基因全长1 908 bp,编码442个氨基酸。序列结构分析显示,卵形鲳鲹△6FAD基因具有典型的脂肪酸去饱和酶家族的结构特性,即1个细胞色素b5区、3个组氨酸富集区(HDFGH、HFQHH和QIEHH)和3个跨膜结构域。序列同源性比对分析发现,该酶基因的N端和C端缺乏明显的同源性,仅中间序列相对保守,由8个保守的组氨酸残基构成了3个保守的组氨酸富集区。研究认为3个保守的组氨酸富集区是维持酶活性所必需的,且其中HisI和HisII区与酶-底物结合位点的形成有关,而3个保守的组氨酸富集区和1个Fe2+结合形成催化活性中心[16];由3个组氨酸富集区与细胞色素b5区域相结合共同在脂肪酸的去饱和电子传递链中完成电子传递的作用。△6FAD基因编码的氨基酸序列同源性比对分析发现,该氨基酸序列片段与其他鱼类的△6FAD基因所编码的氨基酸序列具有较高的相似度,存在较近的亲缘关系,但与斑马鱼、小鼠和人等哺乳动物在进化关系上却表现出较远的亲缘关系,这与已有的报道结果一致。 3.3 卵形鲳鲹肝脏中△6FAD基因在不同处理下的差异
表达已有研究报道低温能增加硬骨鱼中△6FAD基因的表达量与酶活性[17, 18, 19],但目前有关脂肪酸去饱和酶家族和鱼类抗寒性的研究还较少。Ren等[20]研究表明低温能促进鲤(Common carp)△6FAD-a基因表达量明显的增加;遮目鱼(Chanos chanos)△9FAD的mRNA表达量在低温胁迫下呈先稳定增加后明显下降的趋势,而草鱼(Grass carp)在胁迫21 d后才明显检测到△9FAD mRNA的表达[21];鲤鱼(Common carp)低温(6℃)应激下,△9FAD基因的表达水平是常温条件下(23℃)的13.9倍,表明了△9FAD基因的表达与低温刺激密切相关[22]。此外,也有研究表明在微生物和高等植物中△9FAD是导致细胞膜膜脂冷适应的主要蛋白,与其冷适应性有关[23]。本研究中该基因在降温过程表达量的变化和不同低温下的时序表达模式表明该基因的表达与环境温度和胁迫时间存在一定相关性。鱼类是变温动物,不同的环境温度可能造成鱼体不同的新陈代谢方式,并出现不同的生理回应。根据本研究中卵形鲳鲹△6FAD基因在不同温度下的相对表达分析结果推测,鱼体的新陈代谢水平随着水温的下降而下降,但随着温度的继续下降,鱼体开始出现冷应激反应,激发体内一切抗寒机制以应对外界的低温刺激,最终使得该基因的表达量在整个降温过程中出现先下降后上升的趋势;而不同低温下的时序表达模式则可能是低温刺激和鱼体对环境的自然适应共同作用的结果。
硬骨鱼类通过增加不饱和脂肪酸在细胞膜膜脂中的比例来维持低温下的正常生理活性[24, 25]。有研究表明,低温能增加去饱和酶mRNA的合成与稳定性,进而增加胞内酶的数量,加强膜脂的去饱和作用[26]。因此,在多不饱和脂肪酸合成过程中的脂肪酸去饱和酶基因家族对增加膜脂中的不饱和脂肪酸成分、提高细胞膜在低温下的流动性都有着重要的作用,其也可能是卵形鲳鲹在抗寒过程中的关键基因成员,而有关脂肪酸去饱和酶基因家族和物种耐寒性状之间的联系还有待进一步的研究。 4 结论
本研究克隆了卵形鲳鲹△ 6脂肪酸去饱和酶(△6FAD)基因,全长共1 908 bp,并提交至NCBI基因库(GenBank登录号KP295471),低温胁迫表达实验表明,该基因在28℃到13℃范围内表达量随温度降低先缓慢降低后又迅速升高,并于13℃时达到峰值;在不同低温下该基因表达量呈现出不同的时序表达模式,13℃时随时间增加先降低后升高,最终恢复至原来水平,而16℃和19℃时则表现出一种随时间逐渐降低的反馈式调节方式。
| [1] | 冉长城. 不同饲料脂肪水平养殖卵形鲳鲹在低温胁迫下生理生 化指标的变化[D] . 湛江:广东海洋大学, 2013. |
| [2] | 常玉梅, 孙效文, 梁立群, 等. 鲤鱼耐寒性状研究[J] . 上海水 产大学学报, 2003, 12(2):102-105. |
| [3] | Cossins AR, Macdonald AG. Homeoviscous adaptation to temperature :Ⅲ. Fatty acid composition of liver mitochondrial phosphor lipids of deep sea fish[J] . Biochim Biophys Acta, 1986, 860 :325-335. |
| [4] | Farkas T. Metabol iam of fatty acids in fish Ⅲ combined effect of enviromental temperature and diet on formation and deposition of fatty acids in the carp, Cyprineus carpio Limaeus 1758[J] . Aquaculture, 1980(20):29-40. |
| [5] | Hsieh SL, Chen YN, Kuo CM. Physiological responses, desaturase activity, and fatty acid composit ion in milkfish(Chanos chanos) under cold acclimation[J] . Aquaculture, 2003(220):903-918. |
| [6] | Wodtke E, Cossins AR. Rapid cold-induced changes of membranc order and D9-desaturaseactivityin endoplasmic reticulumof carp liver a time -course study of thermal acclimation[J] . Biochim Biophys Acta, 1991, 1064 :343-350. |
| [7] | 张亮. 黄斑篮子鱼参与HUFA 合成的三个关键酶基因的克隆及其特性[D] . 汕头:汕头大学, 2010. |
| [8] | Zhang YM, Wang CC, Hu HH, et al. Cloning and expression of three fatty acid desaturase genes from cold-sensitive lima bean(Phaseolus lunatus I)[J] . Biotechnol Lett, 2011, 33 :395-401. |
| [9] | Tasseva G, Davyde VJ, Cantrel C, et al. Changes in the endoplasmic reticulum lipid properties in response to low temperature in Brassica napus[J] . Plant Physiol Biochem, 2004, 42 :811-822. |
| [10] | Matteucci M, D'Angelina S, Errico S, et al. Cold affects the transcription of fatty acid desaturases and oil quality in the fruit of Oleaeuropaea L genotypes with different cold hardiness[J] . J Exp Bot, 2011, 62(10):3403-3420. |
| [11] | Teixeira MC, Clelho N, Olsson ME, et al. Molecular cloning and expression analysis of omega-6 desaturase genes from purslane (Portulaca oleracea L. )[J] . Biotechnol Lett, 2009, 31 :1089- 1101. |
| [12] | Sprecher H, Luthria DL, Mohammed BS, et al. Reevaluation of the pathways for the biosynthesis of polyunsaturated fatty acids[J] . J Lipid Res, 1995, 36(12):2471-2477. |
| [13] | 许友卿, 陈哲, 丁兆坤. 低温对鱼类的影响及其预防[J] . 广 东农业科学, 2012, 15 :132-135. |
| [14] | Lyons JM, Raison JK. Oxidative activity of mitochondria isolated from plant tissues sensitive and resistant to chilling injury[J] . Plant Physiol, 1970, 45(4):386. |
| [15] | 程汉良, 夏德全, 吴婷婷. 营养对鱼类抗寒力影响的研究进 展[J] . 水产科学, 2005, 24(9):41-44. |
| [16] | Libisch B, Michaelson LV, Lewis MJ, et al. Chimeras of Δ6-fatty acid desaturase and Δ8-sphigolipid desaturases[J] . Biochem Biophys Res Commun, 2000, 279(3):779-785. |
| [17] | Bell JG, Tocher DR, Farndale BM, et al. The effect of dietary lipid on polyunsaturated fatty acid metabolism in Atlantic salmon(Salmo salar)undergoing parr-smolt transformation[J] . Lipids, 1997, 32 :515-525. |
| [18] | Tocher DR, Bell JG, Henderson RJ, et al. The effect of dietary linseed and rapeseed oils on polyunsaturated fatty acid metabolism in Atlantic salmon(Salmo salar)undergoing parr-smolt transformation[J] . Fish Physiol Biochem, 2000, 23 :59-73. |
| [19] | Tocher DR, Fonseca-Madrigal J, Dick JR, et al. Effects of water temperature and diet containing palm oil on fatty acid desaturation and oxidation in hepatocytes and intestinal enterocytes of rainbow trout(Oncorhynchus mykiss)[J] . Comp Biochem Physiol B, 2004, 137 :49-63. |
| [20] | Ren HT, Zhang GQ, Li JL, et al. Two △6-desaturase-like genes in common carp(Cyprinus carpio var. Jian):Structure characterization, mRNA expression, temperature and nutritional regulation[J] . Gene, 2013, 525(1):11-17. |
| [21] | Hsieh SL, Kuo CM. Stearoyl-CoA desaturase expression and fatty acid composition in milkfish(Chanos chanos)and grass carp(Ctenopharyngodon idella)during cold acclimation[J] . Comparative Biochemistry and Physiology, Part B, 2005, 141 :95- 101. |
| [22] | 常玉梅, 徐丽华, 李世国, 等. 鲤耐低温候选基因CcSCD 的克 隆及功能预测[J] . 水产学杂志, 2012, 25(3):1-6. |
| [23] | Murray P, Hayward S, Govan G, et al. An explicit test of the phospholipid saturation hypothesis of acquired cold tolerance in Caenor habditis elegans[J] . PNAS, 2007, 104(13):5489- 5494. |
| [24] | Cossins AR, Bowler K. Rate compensation and capacity adaptation[M] // Cossins AR. Temperature Biology of Animals. New York :Chapman and Hall Press, 1987 :155-203. |
| [25] | Wodtke E, Cossins AR. Rapid cold-induced changes of membrane order and activity in endoplasmic reticulum of carp liver :a timecourse study of thermal acclimation[M] . Biochim Biophys Acta, 1991, 1064 :343-350. |
| [26] | 马晶晶. n_3 高不饱和脂肪酸对黑酮幼鱼生长及脂肪代谢的影 响[D] . 杭州:浙江大学, 2008. |