土壤盐渍化已成为制约现代农业生产的一个重要因素,目前全球盐碱地已达 9.54 亿 hm2,约占到耕地总面积的 2/3。我国的盐碱地近 1 亿 hm2[1] ,并且由于不合理使用,数量还在逐年增加。土壤盐渍化是由于土壤中的盐碱成分过多,使农作物严重失水而对其生长发育产生巨大影响,不仅大大降低其生物产量,而且对产品品质也有很大影响。如何利用如此之多的盐渍化土地以解决全球性日益严重的粮食问题当然引起人们极大的关注。目前,盐碱地的开发利用已越来越受到各国政府的重视,支持科学家探索出一条既经济又高效的途径。
盐渍化土地的开发利用主要通过以下两种途径[2]:一是通过物理或化学的方法,如合理灌溉、淡水冲洗、施用化学改良药剂等方法来改良土壤,以便为农作物生长创造良好和适宜的环境 ;二是利用基因工程或遗传育种等技术培育具有耐盐碱性的作物新品种。实践证明,前者不仅成本高,而且即使有效果,也会造成土壤中营养成分的流失,不利于农业的可持续发展。因此,要想合理地解决土地盐渍化问题,最经济和有效的办法之一是培育耐盐碱的优良品种。由于常规育种存在着时间长、工作繁重及遗传性状不稳定等缺点,因而利用转基因技术培育耐盐碱新品种成为人们的首选。现在,越来越多的科研工作者正在利用基因工程方法培育各种农作物耐盐碱新品种,通过提高盐碱地农作物的产量,以期缓解全球面临的日益严重的粮食危机。1 植物的耐盐碱机制
耐盐性是指植物体通过自身生理反应和代谢调节耐受高浓度盐分而仍能正常生长发育的特性。近年来,科研工作者利用分子育种技术、定点突变技术等研究方法深入了解植物耐盐碱的分子机制。利用运行信号的感知、转导和下游调控因子[3]作用模式,为了解植物非生物胁迫应答机制的细胞通路提供了可能,并由此提出了很多假说。这些基础性探索工作为人们利用转基因手段,培育农作物耐盐碱新品种提供了很多有用的信息。土壤高盐浓度对植物本身造成损害的分子机理目前还不完全清楚,有待进一步深入研究。实际上,植物的耐盐碱分子机制是相当复杂的,本文主要介绍以下 5 个假说。 1.1 渗透压调节机制盐碱地由于含有过多的盐碱成分,造成植物根系部位的细胞外渗透压高于胞内渗透压,最终致使大量细胞失水,引起植物的干枯、甚至死亡。而耐盐碱植物的渗透压调节机制会使植物体细胞内一些小分子物质增加,从而能提高细胞的内渗透压,防止细胞内大量失水对植物造成的伤害,维持细胞内外渗透压的平衡。参与渗透压调节的物质有很多,主要分为两大类 :一类是细胞从外界吸收的无机离子,如 :Na+、K+、Ca2+、Cl-等 ;另外一类是细胞内自身合成的相容性物质,如脯氨酸、甜菜碱、胆碱、甘露醇及蔗糖等[4]。这些相容性物质不仅可以调节渗透压,而且并不进入蛋白质的水化膜内从而破坏蛋白质的结构。这些物质被排斥在膜的外表而有益于保护和稳定细胞蛋白质结构,使蛋白质正常行使功能。
植物体内甜菜碱根据其化学结构与生物合成途径不同分为甘氨酸甜菜碱(Gly betaine)、脯氨酸甜菜碱(Pro betaine)、丙氨酸甜菜碱(β-Ala betaine)、硫酸酯胆碱(Choline-O-Sulfate)等多种甜菜碱[5]。其中甘氨酸甜菜碱分布在大多数植物体内,且催化合成甘氨酸甜菜碱酶是目前研究最为清楚的。甘氨酸甜菜碱是甜菜碱脱氢酶(Betaine aldehyde dehydrogenase,BADH)催化甜菜碱醛合成的,而甜菜碱醛是由胆碱催化合成的,但不同植物体内参与此步酶促反应的生化酶不尽相同,分为胆碱单氧化物酶(Choline monooxygenase,CMO),胆碱脱氢酶(Choline dehydrogenase,CDH) 和 胆 碱 氧 化 酶(cholineoxidase,COX)[6]。甜菜碱脱氢酶(BADH)作为高等植物甜菜碱生物合成的关键酶之一,很多科研工作者通过研究 BADH 的表达与盐胁迫的相关性,将耐盐碱微生物、植物获得的 BADH 基因导入受体植物中以增强其耐盐碱性。植物体内谷氨酸在(Pyrroline-5-carboxylate,P5C) 和 △ 1-吡咯啉-5-羧酸合成 酶(Δ1-pyrroline-5-carboxylate synthetases,P5CS)催化下合成脯氨酸[7],其中 P5CS 是脯氨酸合成的限速酶,目前研究表明 P5CS 基因的表达与植物逆境胁迫应答相关,如盐胁迫、干旱胁迫、强光胁迫及氧化胁迫等[8]。1.2 离子区隔化
盐碱地的高盐碱环境会使植物根系细胞造成盐胁迫,不仅破坏了细胞内 Na+和 Cl-的平衡,Na+还会与细胞膜上的 Ca2+发生竞争,破坏细胞膜的结构与功能,从而最终影响细胞的正常生理代谢。植物为了消除 Na+对细胞造成的危害,可通过降低细胞离子吸收、离子外排或离子区隔化等机制。然而,Na+的外排并不能从根本上解除植物的盐胁迫,所以要降低细胞内离子浓度,Na+的离子区隔化就显得尤为重要。离子区隔化是指细胞内过高的 Na+会通过细胞膜或液泡膜上的 Na+/H+逆向转运蛋白进入液泡内,从而降低了细胞质内 Na+的浓度。因此,Na+/H+逆向转运蛋白也成为目前许多科研工作者的关注的对象。目前,人们推测,离子的区隔化是由 SOS 信号途径调控[9],主要通过以下步骤 :(1)SOS3 基因编码一个 Ca2+结合蛋白,与细胞内游离的 Ca2+结合 ;(2)刺激 SOS2 编码 Ser/Thr 蛋白激酶,活化 SOS2-SOS3 蛋白复合体磷酸化活性 ;(3)启动 SOS1 基因编码的 Na+/H+逆向转运蛋白将 Na+泵到细胞外或液泡内,降低细胞质内 Na+浓度,解除盐胁迫,见图 1。
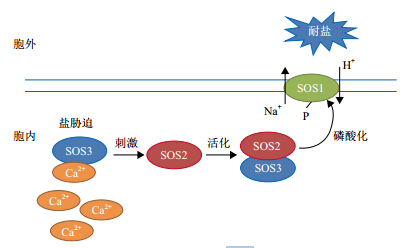 |
| 图 1 盐胁迫条件下SOS调控途径 |
土壤的高盐浓度会对植物细胞膜的完整性、各种蛋白酶的活性、植物体的营养吸收以及光合反应的功能等产生破坏作用[10]。破坏这些功能的一个重要原因是植物体的盐胁迫使细胞内,尤其是线粒体和叶绿体,产生多种形式的活性氧(ROS):氧自由基(O2-)、过氧化氢(H2O2)和羟基自由基(OH-)等,这些成分通过破坏细胞膜及细胞内膜系统,使细胞内酶失活,核酸降解,进而对细胞造成氧化胁迫[11]。植物在盐胁迫下会产生复杂的分子反应,包括应激蛋白以及渗透压物质的产生,许多未知功能的渗透剂应激蛋白(各种抗氧化酶,如超氧化物歧化酶、过氧化氢酶及抗坏血酸过氧化物酶等[12])通过清除活性氧,解除 ROS 对细胞结构造成的损害而对植物达到解毒的作用。目前,C. Sudhakar等[13]研究发现非生物胁迫下,植物体细胞内首先会通过产生小分子 CO 提高自身抗氧化酶含量,其次可以作为信号分子与其他激素协同作用应答环境压力。Ozfidan-Konakci 等[14]发现使用 GLA 能提高水稻抗氧化酶(SOD、POX 和 APX)的活性,缓解盐胁迫下 ROS 产生的毒害作用。非生物胁迫下植物自身的解毒作用十分复杂,抗氧化机制还有待进一步研究。 1.4 植物自身生长调节机制
盐胁迫与其他非生物胁迫一样,主要通过关闭植物叶片气孔限制 CO2进入体内,降低植物光合作用速率,抑制细胞分裂与生长,从而达到减缓植物生长的目的[15]。反过来说,植物放慢生长也是解除自身胁迫的一种重要方式,它主要是利用本身的多种物质减缓生长来应答这些非生物胁迫。在自然界中,植物抗盐或耐旱的程度往往与生长率呈负相关,甚至也会造成植物生长缓慢、农作物产量降低,但其相关的作用机理还有待进一步研究。细胞增殖依赖于细胞周期依赖性蛋白激酶(cyclin-dependent kinase,CDK),细胞周期蛋白依赖性激酶抑制剂(Cyclin-dependent-kinase inhibitor,ICK1)作为 CDK的抑制因子与 CDK 结合抑制其蛋白酶活性,降低细胞增殖速度,减缓植物生长速率[16]。逆境胁迫时,植物体内 ICK1 含量增加,CDK 活性降低,生长缓慢。1.5 转录调控机制
植物体内基因的表达会受到很多因子的调控,其中转录前转录因子对基因表达调控是主要的途径。它作用于基因中的顺式作用元件,启动或调节基因的表达[17]。抗逆机制研究中,转录调控作为目前研究较热的方向之一,通过调控以上几种耐盐碱机制中相关物质含量来应答胁迫。虽然转录因子起步较晚,但越来越多的实验室克隆出调控耐盐碱相关基因的转录因子基因,然后使其在目标植物中表达,并获得了一些相关抗逆植株[2]。其中干旱应元件结合蛋白(Dehydration-responsive element binding protein,DREB)类转录因子是逆境胁迫中研究最广泛的相关转录因子之一,在植物耐受非生物胁迫中具有十分重要的作用[18]。DREB 依赖逆境胁迫下两个独立的信号转导通路分为 DREB1、DREB2,都属于乙烯效应元件结合因子(Ethylene responsive element binding factors,ERF)家族成员。ERF 家族具有与两个cis元件和 GCC 框结合的 58-59 氨基酸的保守结构域,DREB1、DREB2 根据不同植物在不同位置均具有保守的结构域[19]。2 植物的耐盐碱基因
近年来,随着分子生物学与转基因技术的迅速发展,植物耐盐碱转基因的研究已成为目前耐盐碱植物研究的最主要途径。科研工作者利用基因沉默、定点突变技术从多种耐盐碱微生物与植物中研究发现了多种耐盐碱基因,并通过分子克隆技术克隆出相关基因[20]。于此同时还通过研究调控耐盐碱基因转录表达的转录因子来提高表达量,增强转基因植物的耐盐碱度。目前,科研工作者利用转基因技术将耐盐碱基因导入到许多种农作物改善其耐盐碱性,并取得了丰富的研究成果。2.1 渗透调节基因研究进展
渗透调节是目前研究较清楚的植物耐盐碱机制,其基因调控机理研究也较为成熟。目前研究已利用此机制获得了多种转基因耐盐碱植物。董云洲等[21]构建了ImtI基因的植物高效表达载体,然后利用农杆菌介导法转化烟草,并检测 F1 代植株在 1.5%NaCl 条件下较为粗壮结实。王慧中等[22]将mtID和gutD双价基因转入水稻并获得阳性植株,检测 F1代在 0.75% NaCl 的盐胁迫下比对照生长明显良好。而科学家将 BADH、P5CS 这两个研究最为深入的植物耐盐碱相关基因从各种盐生植物中克隆获得,并利用转基因技术在目的农作物中过表达,获得了多种抗盐性品质资源[6, 7, 8]。 2.2 离子区隔转基因研究进展
离子区隔化是目前研究较成熟的耐盐碱机制,已经研究获得了多种转基因高表达植物。与此同时,对此机制的研究越来越成熟,从多个角度获得多种多样的耐盐碱基因,其在植物中的表达也相当高效,是提高植物耐盐碱性的主要机制。Lv 和 Zhang 等[23]将花椰菜花叶病毒(CaMV)的 35S 作为启动子的TsVP 基因(编码的焦磷酸酶位于液泡膜上具有质子泵的作用)转入棉花,经试验证明转基因植株的液泡高表达 H+-PPase,比野生型植株耐 NaCl 高 250 mol/L。Li 等[24]利用 FLP/FRT 特定位点的重组系统将AtNHX1基因导入玉米中获得不带筛选标记的耐盐性转基因玉米。另外,Pasapula 等[25]将拟南芥液泡的AVP1基因(焦磷酸酶基因)转入到棉花中,在大田里具有抗旱耐盐碱功能提高了纤维产量。此外,Yang 等[26]获 得 AtNHX1、SOS3、AtNHX1+SOS3、SOS1、SOS2+SOS3 及 SOS1+SOS2+SOS3 六种不同转基因拟南芥植株,利用 Northern blot 分析表明转基因植株中存在高表达的相关基因转录体。
细胞内的高离子浓度引起的氧化胁迫,而编码抗氧化酶的基因会诱导产生各种抗氧化酶的编码,通过减少细胞内活性氧缓解其造成的氧化胁迫,改善植物的高耐盐性。跟据目前研究报道,大多数转基因植物已经实现了通过解毒作用机制改善其耐盐碱性。Zsigmond 等[27]将线粒体上与电子转移相关基因 PRP40 导入拟南芥并使其高效表达。Zhang等[28]利用基因敲出与基因沉默研究出拟南芥AtERF98基因与合成抗坏血酸(AsA)相关,又因抗坏血酸是植物体内重要的抗氧化剂,可解除由盐碱胁迫对植物体造成的氧化胁迫,故对提高植物耐盐碱性具有重要作用。Sultana 等[29]从红树林 cDNA文库中克隆单脱氢抗坏血酸还原酶(MDHAR)基因导入水稻并检测耐盐碱性,在体外利用潮霉素、PCR、定量 PCR 和酶活力测定技术筛选出 3 个高表达转基因珠系。2.4 生长调节相关基因研究进展
植物耐盐碱与自身生长调节机制的相关性是近年来刚刚开始研究的一种途径,还处于浅显阶段,许多与生长调节机制相关的耐盐碱基因还有待人们去发现。但目前已克隆出相关基因并得以表达,Baisakh 等[30]通过表达盐生植物互花米草液泡上 H+-ATPase 的亚基 c1 基因(SaVHAc1)来提高水稻的耐盐碱性,SaVHAc1 表达的植物通过叶片气孔早期的关闭和气孔密度的降低来维持盐胁迫下自身相对较高的含水量。同时 ICK1 作为植物耐胁迫与自身生长调节之间一种重要的蛋白,将是研究植物耐盐碱一个重要的方向。而与细胞生长增殖相关的一些植物激素(如生长激素、细胞分裂素和赤霉素等)也都是研究植物耐盐碱新的创新点[16]。2.5 转录调控作用研究进展
Zhou 等[31]从杨树中克隆的转录因子DREB转入到拟南芥中获得了高表达植株。Gao 和 Chen 等[32]克隆棉花的绑定转录因子的DRE基因(GhDREB)在转基因小麦中表现出高的耐盐碱性。水稻编码鞘氨醇-1-磷酸裂解酶(Sphingosine-1-Phoshpate Lyase)的 OsSPL1 基因在转基因烟草中能解除盐渍化土地对其造成的盐胁迫和氧化胁迫。Ying 等[33]从玉米中克隆 ZmbZIP72 基因和 bZIP 转录因子(在玉米基因组中仅有一个拷贝隐藏在 3 个内含子内),并鉴定其在拟南芥表达可提高耐盐碱性和抗旱能力。目前科学家发现越来越多耐盐碱相关转录因子,通过调控植物体内复杂的耐胁迫系统达到耐受的能力,转录因子更是研究植物体内看似独立的耐盐碱机制实则交相互做复杂系统的纽带。 2.6 其他除了上述几种耐盐碱机制研究植物耐盐碱新品种,许多科研工作者还从许多其他相关机制寻找耐盐碱基因,以期获得更好的耐盐碱植物品种。如Zhang 等[34]将先前从构建的盐介 cDNA 文库中克隆出TsLEA1基因,将其转化到酵母和拟南芥中,并研究证实其表达可在盐胁迫条件下保护自身细胞。 Zou 和 Liu[35]将OsHsp17.0和OsHsp23.7基因导入到了水稻中,证实在盐碱条件下转基因植株种子要比野生型的发芽率高,而盐胁迫下植物萌芽率是一项判定其抗耐盐碱最主要的指标之一。3 植物耐盐碱的未来发展方向
虽然目前转基因安全问题一直制约着植物尤其是农作物的转基因研究,但是人们在转基因的研究上仍然取得了巨大的研究成果。基因工程被认为是提高植物耐盐碱性极有前途的一种新的育种途径,它替代了传统的分子标记辅助育种和种间杂交育种。通过转基因手段使农作物获得其不具备的优良品种,用于农业生产,不仅很大程度上缩短了常规育种的新品种的育种年限,而且转基因的优良性状表现比常规育种高出很多倍。
要利用转基因技术获得高抗盐作物品种,首先从自然界筛选获得抗盐生物,通过研究其抗盐机制,克隆相关抗盐基因 ;其次,从基础研究开始,深入研究盐生植物的耐盐机制,发现新的耐盐途径。近来许多科学家发现 microRNA 在植物耐盐、抗旱等非生物胁迫具有巨大的潜能,如 Xie 等[36]通过对棉花 microRNA 深度测序、生物信息学分析发现其在应答干旱、盐胁迫时具有十分重要的作用。Zhou 等[37]更是使 miR319(microRNA)在匍匐翦股颖中组成型表达,提高了匍匐翦股颖的耐盐性。最重要的是要将已发现的植物耐盐碱机制贯通起来,发现植物自身的耐盐系统体系。最近,埃及科学家 Badran 等[38]研究发现小麦中的甘氨酸能在盐胁迫下,通过提高植物体内甘氨酸甜菜碱含量改善体内离子平衡、清除体内活性氧(ROS),由此表明,植物体内耐盐机制的相通性。因此,我们要想获得转基因耐盐碱作物新品种,还应该从基础研究出发,深入研究盐生植物、微生物的耐盐碱系统,为今后研究新品种奠定坚实的理论基础。
| [1] | 林聪 , 屠乃美 , 易镇邪 , 等 . 耐盐碱能源植物研究进展[J]. 作物研究 , 2012, 26(3):304-308. |
| [2] | 王奕 , 任贤 , 于志晶 , 等 . 玉米耐盐碱转基因研究进展[J]. 安徽农业科学 , 2012, 40(7):3908-3911. |
| [3] | Sreenivasulua N, Soporyb SK, Kavi Kishorc PB, et al. Deciphering the regulatory mechanisms of abiotic stress tolerance in plants by genomic approaches[J]. Gene, 2007, 388(1-2 ):1-13. |
| [4] | 任伟 , 王志峰 , 徐安凯 . 碱茅耐盐碱基因克隆研究进展[J]. 草业学报 , 2010, 19(5):260-266. |
| [5] | 江香梅 , 黄敏仁 , 王明庥 . 植物甜菜碱合成途径及基因工程研究进展[J]. 中国生物工程杂志 , 2002, 22(4):49-55. |
| [6] | McCue KF, Hanson AD. Salt-inducible betaine aldehyde dehydrogenase from sugar beet :cDNA cloning and expression[J]. Plant Mol Bio, 1992, 18(1):1-11. |
| [7] | Hu CA, Delauney AJ, Verma DPS. A bifunctional enzyme(delta 1-pyrroline-5-carboxylate synthetase)catalyzes the first two steps in proline biosynthesis in plants[J]. Proc Natl Acad Sci USA, 1992, 89(19):9354-9358. |
| [8] | Szabados L, SavouréA. Proline :a multifunctional amino acid[J]. Trends Plant Sci, 2010, 15(2):89-97. |
| [9] | 秘彩莉 , 郭光艳 , 齐志广 , 等 . 植物盐胁迫的信号传导途径[J]. 河北师范大学学报 :自然科学版 , 2007, 31(3):375-379. |
| [10] | 付寅生 , 崔继哲 , 陈广东 , 等 . 盐碱胁迫下碱地肤 Na+/H+逆向转运蛋白基因 KsNHX1 表达分析[J]. 应用生态学报 , 2012, 23(6):1629-1634. |
| [11] | Noreen S, Ashraf M, Hussain M, et al. Exogenous application of salicylic acid enhances antioxidative capacity in salt stressed sunflower(Helianthus annuusL .)plants[J]. Pakistan Journal of Botany, 2009, 41(1):473-479. |
| [12] | 程继东 , 安玉麟 , 孙瑞芬 , 等 . 抗旱、耐盐基因类型及其机理的研究进展[J]. 华北农学报 , 2006, 21(专辑):116-120. |
| [13] | He HY, He LF. The role of carbon monoxide signaling in the responses of plants to abiotic stresses[J]. Nitric Oxide, 2014, 42 :40-43. |
| [14] | Ozfidan-Konakci C, Yildiztugay E, Kucukoduk M. Upregulation of antioxidant enzymes by exogenous gallic acid contributes to the amelioration in Oryza sativaroots exposed to salt and osmotic stress[J]. Environ Sci Pollut Res, 2015, 22(2):1487-1497. |
| [15] | Zhu JK. Plant salt tolerance[J]. TRENDS in Plant Science, 2001, 6(2):66-71. |
| [16] | Wang H, Zhou Y, Bird DA, Fowke LC. Functions, regulation and cellular localization of plant cyclin-dependent kinase inhibitors[J]. J Microsc, 2008, 231(2):234-246. |
| [17] | 江香梅 , 黄敏仁 , 王明麻 . 植物抗盐碱、耐干旱基因工程研究进展[J]. 南京林业大学学报 :自然科学版 , 2001, 25(5):57-62. |
| [18] | Gupta K, Jha B, Agarwal PK. A dehydration-responsive element binding(DREB)transcription factor from the succulent halophyte Salicornia brachiataenhances abiotic stress tolerance in transgenic tobacco[J]. Mar Biotechnol, 2014, 16(6):657-673. |
| [19] | Agarwal PK, Agarwal P, Reddy MK, Sopory SK. Role of DREB transcription factors in abiotic and biotic stress tolerance in plants[J]. Plant Cell Rep, 2006, 25(12):1263-1274. |
| [20] | 孙兰菊 , 岳国峰 , 王金霞 , 等 . 植物耐盐机制的研究进展[J]. 海洋科学 , 2001, 25(4):28-31. |
| [21] | 董云洲 , 王雪艳 . 转肌醇甲基转移酶基因烟草的耐盐性及其遗传分析田[J]. 农业生物技术学报 , 2000, 8(1):53-55. |
| [22] | 王慧中 , 黄大年 , 鲁瑞芳 , 等 . 转mtID和gutD双价基因水稻的耐盐性[J]. 科学通报 , 2000, 45(7):724-729. |
| [23] | Lv S, Zhang KW, Gao Q, et al. Overexpression of an H+-PPase gene from Thellungiella halophilain cotton enhances salt tolerance and improves growth and photosynthetic performance[J]. Plant Cell Physiol, 2008, 49(8):1150-1164. |
| [24] | Li B, Li N, Duan XG, et al. Generation of marker-free transgenic maize with improved salt tolerance using the FLP/FRTrecombination system[J]. J Biotechnol, 2010, 145(2):206-213. |
| [25] | Pasapula V, Shen G, Kuppu S, et al. Expression of an Arabidopsisvacuolar H+-pyrophosphatase gene(AVP1)in cotton improves drought-and salt tolerance and increases fibre yield in the field conditions[J]. Plant Biotechnol J, 2011, 9(1):88-99. |
| [26] | Yang A, Dai X, Zhang WH, et al. A R2R3-type MYB gene, OsMYB2, is involved in salt, cold, and dehydration tolerance in rice[J]. J Exp Bot, 2012, 63(7):2541-2556. |
| [27] | Zsigmond L, Szepesi A, Tari I, et al. Overexpression of the mitochondrial PPR40 gene improves salt tolerance in Arabidopsis[J]. Plant Sci, 2012, 182 :87-93. |
| [28] | Zhang Z, Wang J, Zhang R, et al. The ethylene response factor AtERF98 enhances tolerance to salt through the transcriptional activation of ascorbic acid synthesis in Arabidopsis[J]. Plant J, 2012, 71(2):273-287. |
| [29] | Sultana S, Khew CY, Morshed MM, et al. Overexpression of monodehydroascorbate reductase from a mangrove plant(AeMDHAR)confers salt tolerance on rice[J]. J Plant Physiol, 2012, 169(3):311-318. |
| [30] | Baisakh N, RamanaRao MV, Rajasekaran K, et al. Enhanced salt stress tolerance of rice plants expressing a vacuolar H+-ATPase subunit c1(SaVHAc1)gene from the halophyte grass Spartina alternifloraL?isel[J]. Plant Biotechnol J, 2012, 10(4):453-464. |
| [31] | Zhou ML, Ma JT, Zhao YM, et al. Improvement of drought and salt tolerance inArabidopsisand Lotus corniculatus by overexpression of a novel DREB transcription factor from Populus euphratica[J]. Gene, 2012, 506(1):10-17. |
| [32] | Gao SQ, Chen M, Xia LQ, et al. A cotton(Gossypium hirsutum)DRE-binding transcription factor gene, GhDREB, confers enhanced tolerance to drought, high salt, and freezing stresses in transgenic wheat[J]. Plant Cell Rep, 2009, 28(2):301-311. |
| [33] | Ying S, Zhang DF, Fu J, et al. Cloning and characterization of a maize bZIP transcription factor, ZmbZIP72, confers drought and salt tolerance in transgenic Arabidopsis[J]. Planta, 2012, 235(2):253-266. |
| [34] | Zhang Y, Li Y, Lai J, et al. Ectopic expression of a LEA protein gene TsLEA1from Thellungiella salsugineaconfers salt-tolerance in yeast and Arabidopsis[J]. Mol Biol Rep, 2012, 39(4):4627-4633. |
| [35] | Zou J, Liu C, Liu A, et al. Overexpression of OsHsp17. 0and OsHsp23. 7enhances drought and salt tolerance in rice[J]. J Plant Physiol, 2012, 169(6):628-635. |
| [36] | Xie F, Wang Q, Sun R, Zhang B. Deep sequencing reveals important roles of microRNAs in response to drought and salinity stress in cotton[J]. J Exp Bot, 2015, 66(3):789-804. |
| [37] | Zhou M, Li D, Li Z, et al. Constitutive expression of a miR319 gene alters plant development and enhances salt and drought tolerance in transgenic creeping bentgrass[J]. Plant Physiol, 2013, 161(3):1375-1391. |
| [38] | Badran EG, Abogadallah GM, Nada RM, Nemat Alla MM. Role of glycine in improving the ionic and ROS homeostasis during NaCl stress in wheat[J]. Protoplasma, 2015, 252(3):835-844. |





