2.西南科技大学生命科学与工程学院,绵阳 621010;
3.中国农业科学院生物技术研究所,北京 100081
2. College of Life Science and Technology,Southwest University of Science and Technology,Mianyang 621010;
3. Biotechnology Research Institute,Chinese Academy of Agricultural Sciences,Beijing 100081
易丰’女贞(Ligustrum lucidum‘Yi Feng’)是一种野生变异的新品种,由于其种质资源极为有限,通过常规的繁育方法难以在较短时间内实现大规模扩繁,公司科研人员于2008年5月在浙江省天目山自然保护区发现一自然变异的女贞突变体(图 1)。该突变体小枝棕绿色,无毛;叶片软革质7,卵形、椭圆形或宽椭圆形,叶长1-3 cm,宽 0.7-1.7 cm,长宽比约为2:1,先端渐尖或钝,叶全缘,新叶的边缘黄绿色(RHS-12A),中间绿色(RHS-144A),而老叶边缘浅黄色(RHS-8C),中间深绿色(RHS-146C),叶上面光亮,两面无毛,中脉在上面凹入,下面凸起,侧脉2-4对,叶柄长0.1-0.2 cm,上面具沟,无毛;圆锥花序顶生,长2-7 cm,宽2-4 cm,花序轴无毛。将该突变体命名为‘易丰’女贞,并选取其中优良单株,种植到公司的种质资源圃。

|
| 图 1 ‘易丰’女贞的野生优良单株 |
由于‘易丰’女贞是雌雄同株异位,导致自花授粉困难,坐果率极低,因此难以用种播的方式进行繁育。用扦插进行繁育,会受到季节及插穗质量、数量的限制,难以在短时间内获得大量种苗。通过组织培养快速繁殖技术进行繁育,所需要的试验材料少,能够在较短时间内获得大量规格一致、保持亲本优良变异性状、质量上乘的苗木。
该研究以腋芽繁芽的方式进行大量的后代扩繁,而之前有关女贞属物种组培技术的相关报道大都是以茎段或种子为外植体材料,诱导获得愈伤组织,然后愈伤组织再分化成芽的方式进行的[1, 2, 3]。在植物组培快繁的过程中采用茎尖或者腋芽诱导(丛生)芽的方式进行,比外植体经过脱分化形成愈伤组织,然后愈伤组织再分化成幼苗的途径更能很好地遗传亲本的优良性状,不容易发生变异[4, 5]。迄今为止,关于女贞组培的相关报道均是停留在基础研究的水平上,并未形成大规模的工厂化生产,而本研究首次针对‘易丰’女贞的组培快繁技术进行系统的探索,建立一套完整的组培快繁技术体系,以期能成功进行大规模的工厂化生产。
1 材料与方法 1.1 材料 1.1.1 实验材料以公司种质资源圃中野生优良的‘易丰’女贞(Ligustrum lucidum‘Yi Feng’)植株为取材母株,在4-5月的晴天上午,选取健壮、无病虫害、当年新发带腋芽的幼嫩半木质化茎段为外植体材料。
1.1.2 消毒处理先将嫩梢的叶片沿叶柄基部剪掉,再将嫩梢切成几段。茎段用0.3%新洁尔灭溶液浸泡,在磁力搅拌器上旋转处理40 min。然后在流水下冲洗1 h,转入超净工作台上,用无菌水冲洗一遍,再用75%的酒精浸泡30 s左右,然后用1%的次氯酸钠溶液消毒处理10 min,最后用无菌水冲洗4-5次,其间不断摇动,保证消毒液、无菌水与外植体充分接触。
1.2 方法 1.2.1 诱芽(启动)培养基的筛选将消毒后的外植体茎段剪成1.5 cm左右的小段,每段上有1个腋芽,接种到诱芽培养基上,诱导腋芽萌发。诱芽培养以MS、WPM、B5培养基为基本培养基,分别添加KT(0.1、0.2和0.3 mg/L)、6-BA(0.1、0.5和1.0 mg/L),NAA(0.01、0.05和0.1 mg/L),蔗糖用量为30 g/L,琼脂用量为6 g/L,pH为5.8-6.0。采用L9(34)的正交试验设计筛选最佳的诱芽培养基配方,每个处理接种50瓶,每瓶接种2个外植体茎段,重复3次。培养30 d后,统计腋芽萌发率。以腋芽萌发率为评价指标,筛选最佳诱芽培养基。
1.2.2 增殖培养基的筛选外植体茎段在诱芽培养基上培养1个月左右,外植体茎段上的腋芽在诱芽培养基上萌发,抽出新的侧芽,将新抽出的侧芽剪成1.5 cm左右的小段,每段上有1个腋芽,接种到增殖培养基上。
增殖培养以WPM为基本培养基,分别添加KT(0.3、0.5和1.0 mg/L)、6-BA(0.5、0.8和1.0 mg/L),NAA(0.05、0.1和0.2 mg/L),蔗糖用量为30 g/L,琼脂用量为6 g/L,pH为5.8-6.0。采用L9(34)的正交试验设计筛选最佳的增殖培养基配方,每个处理接种20瓶,每瓶接种5个腋芽小段,重复3次。培养50 d后,统计平均增殖系数、侧芽平均高度。平均增殖系数=增殖培养后所获得的腋芽总数/增殖培养前腋芽总数。以平均增殖系数为主要评价指标,以侧芽平均高度为次要评价指标,筛选最佳增殖培养基。
1.2.3 生根培养基的筛选经过1.5-2个月以后,腋芽经过增殖培养长成3 cm左右的健壮小苗,将小苗基部的愈伤组织切除,接种到生根培养基上。
生根培养分别以WPM、1/2WPM和1/4WPM为基本培养基,分别添加IBA(0、1.5和2.0 mg/L)、NAA(0、0.05和0.1 mg/L),活性炭(AC)的用量为1 m/L,蔗糖用量为20 g/L,琼脂用量为6 g/L,pH为5.8-6.0。采用L9(34)的正交试验设计筛选最佳的生根培养基配方,每个处理接种20瓶,每瓶接种5棵小苗,重复3次。培养40 d后,以生根率为主要评价指标,以平均单株苗生根条数和单株生根苗根系平均长度为次要评价指标,筛选最佳生根培养基。
1.2.4 培养条件以上所有培养基和超净工作台内所用器皿均是经过121℃高温高压灭菌20 min。诱芽(启动)培养、增殖培养和生根培养的培养条件为:(25±2)℃,光照12 h/d,光照强度2 000-2 500 Lx,湿度60%-65%。
1.2.5 炼苗及移栽(精练方法,部分数据放在结果中)将生根的组培苗转移到炼苗坑道中的苗床上,自然环境下炼苗15-20 d。移栽前3-4 d,将组培瓶的瓶盖松动,但不要完全打开,移栽前1-2 d,将组培瓶的瓶盖完全打开,并往组培瓶内灌入少量的无菌水。生根组培苗移栽前,先用镊子将生根苗轻轻地从培养基内夹出来,将根部所带的培养基用清水完全清洗干净,不要损伤苗的根部。将清洗好的生根苗轻轻插入炼苗基质。生根苗不宜种的过深,尽量使根部舒展地分布于基质中,不要使其弯曲。然后用塑料薄膜做成封闭的小拱棚,保温保湿。
2 结果 2.1 外植体的消毒处理该研究针对‘易丰’女贞带有腋芽的半木质化茎段所进行的外植体消毒处理方案是在特定季节、特定环境和特定的取材母本材料下制定的,经过消毒处理后,外植体的污染率可以基本控制在10%-15%,外植体死亡率可以基本控制在5%-10%。
2.2 最佳诱芽(启动)培养基的筛选经过消毒处理后,大部分带有腋芽的外植体茎段能保持腋芽的活性。外植体茎段接种到合适的诱芽培养基上以后,经过7 d左右,腋芽开始萌动。经过20-30 d左右,腋芽抽出约5 cm左右的侧芽(图 2)。从表 1中可以明显地看出,休眠腋芽在9种诱芽培养基上,经过一定时间以后,均能萌发,但腋芽开始萌动抽芽的时间和萌发率存在较大的差异。其中处理4、处理5和处理6三种培养基上的外植体茎段,接种约5 d后,大部分腋芽就开始萌动;约20 d后,腋芽就能分化成6-8 cm左右的侧芽,腋芽萌发率均很高,在90%以上,且长势良好。处理1、处理2和处理3三种培养基上的外植体茎段,接种约7-14 d后,大部分腋芽开始萌动;约30 d后,腋芽能分化成5 cm左右的侧芽,腋芽萌发率均较高,在70%以上,且长势良好。处理7、处理8和处理9三种培养基上的外植体茎段,接种约7-14 d后,大部分腋芽开始萌动;约30 d后,腋芽就能分化成5 cm左右的侧芽,但腋芽萌发率最低,均低于35%,且长势一般。

|
| 图 2 ‘易丰’女贞的诱导腋芽萌发 |
不同诱芽(启动)培养基因对‘易丰’女贞外植体茎段胶芽萌发的影响如表 1所示,极差值大小表现为基本培养基>KT浓度>6-BA浓度>NAA浓度,说明基本培养基的选择对易丰女贞腋芽萌发率的影响最大,KT的浓度影响次之,而6-BA 和NAA的浓度影响均很小,因此,在诱芽培养的过程中,选择WPM作为诱芽培养的基本培养基,腋芽萌发率最高,处理6上接种的外植体,腋芽萌发率达到峰值,为95.6%,结合腋芽开始萌动的时间及侧芽的长势来综合考虑,处理6(WPM+ 0.3 mg/L KT + 0.1 mg/L 6-BA + 0.05 mg/L NAA)为最佳的诱芽培养基。
2.3 最佳增殖培养基的筛选接种到增殖培养基上的腋芽茎段,经过1.5-2个月左右的生长,增殖产生了大量的侧芽(图 3-A),部分分化产生了不定芽(图 3-B)。而这些侧芽或不定芽经过伸长生长,分化为侧枝,继而可以将侧枝再剪成若干带有腋芽的小段,继续进行增殖培养,经过若干代的增殖培养,便可以通过这种芽繁芽的方式得到大量子代植株。增殖培养可以理解为更大规模的启动培养,因此启动培养过程中所选择的基本培养基和相关激素的种类、配比及浓度等与增殖培养具有一定的相关性,基于这个原理,我们在增殖培养的试验设计过程中借助了启动培养的试验结果,并进行了相关分析。

|
| 图 3 ‘易丰’女贞的增殖培养 |
通过以上对启动培养试验结果的分析,在增殖培养的过程中,继续选择WPM作为基本的培养基。表 2显示,KT浓度对于侧芽增殖效果的影响作用最大,NAA浓度次之,6-BA浓度最小。因此,在增殖培养的过程中,KT浓度的选择至为关键。当KT浓度为0.5 mg/L时,平均增殖系数在4以上,侧芽平均高度达到了8 cm以上,增殖效果较好;当KT浓度提高到1.0 mg/L时,平均增殖系数明显提高,达到5.5以上,但侧芽的长势很差,平均高度只有1.5 cm左右,而且幼苗出现了一定程度的玻璃化现象;KT浓度为0.3 mg/L时,平均增殖系数在3以上,侧芽平均高度也较理想,但部分叶片出现卷曲黄化的现象。因此,以平均增殖系数为主要评价指标的基础上,结合侧芽的长势情况来综合考虑,处理6(WPM+ 0.5 mg/L KT + 1.0 mg/L 6-BA + 0.05 mg/L NAA)为最佳的增殖培养基。
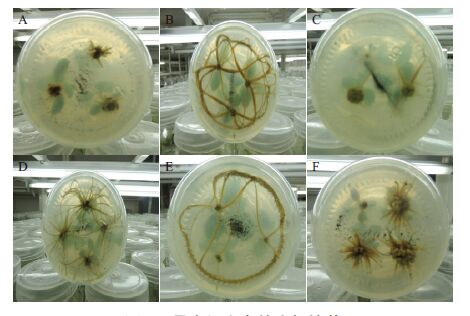
增殖培养结束以后,挑选健壮、生长状况良好,叶片数量较多的再生苗,将其剪成3 cm左右,接种到生根培养基上。40 d左右以后,大部分苗会在愈伤基部产生不定根,但不同处理的培养基上再生苗生根的时间存在很大的差异。在处理6和处理8中,接种后约5 d,基部开始产生不定根(图 4-A),约20 d后,大量的根系产生(图 4-B),而且生根率和根系数量也较为理想,但最终产生的根系过长,不利于后续的移栽,降低炼苗成活率;在处理2、处理3、处理5和处理9中,接种后约7-10 d,基部开始产生不定根(图 4-C),约20 d,大量的根系产生,但只有处理5(图 4-D)产生的根系长度比较合适,其他几个处理产生的根系长度也过长(图 4-E);处理4和处理7,接种后约14-20 d,伤口基部才开始产生不定根,约50 d后,大量的根系产生,而且在伤口基部产生大量的愈伤组织块,根系数量相比其他几个处理多,但根系很短粗(图 4-F),极易发生折断现象;处理1是空白培养基对照,生根时间很长,直到接种后约2个月产生根系,且生根效果也较差。
|
| 图 4 易丰’女贞的生根培养 |
表 3显示,基本培养基的极差值最大,亦即对生根效果的影响最大;NAA浓度的极差值次之,对生根效果的影响较大;IBA浓度的极差值最小,对生根效果的影响最小。在实验过程中,一个很重要的现象引起了我们的注意:只添加NAA的生根培养基上,苗基部的伤口产生大量的愈伤组织,在愈伤组织上产生数量非常庞大的不定根,但是根系很短且粗,极易发生折断;而只添加IBA的生根培养基上,苗基部的伤口几乎不产生愈伤组织,直接在基部产生根系,但根系过长;IBA和NAA配合使用,生根效果较好。
综合考虑,处理5(1/2WPM+ 1.5 mg/L IBA + 0.1 mg/L NAA+1 mg/L AC)为最佳的生根培养基。
2.5 组培苗驯化及炼苗移栽炼苗基质由珍珠岩和泥炭充分混匀组成(珍珠岩:泥炭=1:1,V/V),移栽前1周左右,用0.8%的高锰酸钾溶液对其消毒处理,然后用塑料薄膜覆盖。生根苗清洗干净以后(图 5),轻轻插入炼苗基质(图 6),对移栽的生根苗均匀喷施0.3%的多菌灵溶液,以基质完全浸湿为宜,然后密闭小拱棚内保温保湿约40 d。待生根小苗长出新的须状根并恢复正常生长后(图 7),将小拱棚的两端打开,缓慢放风,约1周后,将小拱棚完全打开,使其在自然条件下生长,此后,约每2周对生根苗喷施一次0.5%的硫酸亚铁溶液,持续约2个月,组培苗成活率可以达到95%以上。

|
| 图 5 易丰’女贞待移栽的组培苗 |

|
| 图 6 ‘易丰’女贞移栽到炼苗基质上的组培苗 |

|
| 图 7 ‘易丰’女贞炼苗后成活的组培苗 |
自然环境下取材的外植体消毒处理是否成功,取决于亲本生长环境、温度湿度、季节、取材时机和取材部位等很多因素,包括消毒剂的类型选择、消毒剂的浓度和消毒时间等也极为关键,消毒剂不仅影响外植体的表面消毒效果,而且对随后外植体的腋芽生长也有较大影响[6],这就决定了难以形成统一的消毒处理方式和方法,均需要结合一定的实际经验加以摸索[7],但不管采用何种消毒方式和方法,最终都以实现有效彻底地消除外植体表面所附带的细菌、真菌及其他污染物的同时,最大限度地保持外植体的活性为标准。
3.2 诱导腋芽萌发和增殖培养在‘易丰’女贞诱导腋芽启动培养的研究过程中,根据自身多年的实践经验,考虑到尽量节约后期的生产成本,所以首先采用6-BA +NAA较为常规的使用浓度进行预实验,但是效果很差,继而在此基础上分别提高和降低了原来的使用浓度,而且浓度跨度范围很大,但是腋芽的萌发率也只有10%左右,而且生长状况较差。在后续的研究过程中,又采用了KT +NAA的组合,按照之前的研究思路继续进行试验,启动培养的效果依然没有太大改观。因此在正式的试验方案设计过程中,试着采用了KT +6-BA+NAA的组合,依然采用了较为常规的使用浓度,这种研究方案成功地诱导了绝大多数的腋芽萌发,且新抽出的侧芽生长状况极好。在接下来的增殖培养研究过程中,继续采用此种激素配比模式,在启动培养的基础上调整了其浓度,结果也取得了很好的增殖效果。
植物腋芽萌发和芽的增殖,往往是其体内不同种激素相互促进或拮抗的过程,多种激素的综合作用影响了植物细胞的生长和定向分化[8]。激素浓度、种类及不同组合对外植体的诱导和分化起着重要的作用[9]。对大多数植物来说,为了达到腋芽萌发或者芽增殖的目的,采用单一的细胞分裂素+单一的生长素,配合使用一定浓度,就可以取得不错的试验效果,王港等[10]在杉木无性系规模化组培繁育技术研究中发现1.0 mg/L 6-BA+ 0.3 mg/L IBA的组合就能产生较高的增殖系数,李晓玲等[11]在山樱花组培快繁技术研究中提出0.4 mg/L 6-BA + 0.02 mg/L NAA的组合就能使其增殖系数达到4.0以上,但是这种方式并不适用于‘易丰’女贞。针对这种现象,研究者推测,‘易丰’女贞的植物体内所含有的内源生长素的量远远超过了内源细胞分裂素,二者的比值形成了一种稳定的动态平衡。当用单一种外源的细胞分裂素来刺激植物体时,即使所用的浓度较高,也很难打破这种内在的动态平衡,也就无法使它按照预期的设想来定向分化(腋芽萌发、增殖)。只有用一定浓度两种或两种以上的细胞分裂素结合较低浓度的生长素,才有可能打破这种内在的动态平衡,从而实现预期的结果。由于受试验条件、人力物力、生产成本等一些客观因素的制约,并没有采用两种以上其他的细胞分裂素组合来验证以上这种设想的机制,因此该研究所提到的最佳启动培养基和最佳增殖培养基,仅是在现有特定的条件下最科学、高效、完善的,除此之外,亦可能有其他较为高效的培养基配方,本研究未做更深入的研究。
3.3 诱导组培苗生根在生根体系的研究过程当中,试验结果分析中所提到的重要现象,亦或许在一定程度上验证了以上所设想的机制,‘易丰’女贞的植物体内所含有的内源NAA的量非常高,所以当只加入较低浓度NAA时,茎基部伤口就会先产生大量的愈伤组织,低浓度的NAA就能打破内源激素的动态平衡。当加入浓度适量的NAA,使NAA/细胞分裂素达到一定值的时候,就能诱导茎基部产生大量粗短的不定根。但所产生的这种不定根,是在愈伤组织的基础上分化出来的,称之为愈伤根。单独加入IBA来诱导生根,茎基部伤口只产生少量甚至不产生愈伤组织,直接在伤口处产生不定根,根系数量适中但很长,称之为皮部根。总体上来看,更希望得到皮部根,因为皮部根的根系与茎维管系统的连接比愈伤根更顺畅,这样就容易提高后期组培苗炼苗移栽的成活率。组培苗的炼苗成活率很大程度上与根系的质量有关,不定根粗壮、毛细根较多、根系长度适中等能够扩大根系吸收面积,增强根系吸收能量,从而也达到了提高移栽成活率的目的[12]。因此,在实际的组培生产过程中,采用IBA和NAA配合使用,更能提高生根效率。
通过该研究建立的组培技术体系所得到的组培苗后代性状稳定优良、品质高、抗逆性较强。不仅在短时间内为市场上提供了大量的新优苗木,更重要的是,为更多新优品种组培快繁技术体系的研究提供了一定的理论支持和技术指导,具有一定的经济和社会效应。
4 结论本研究建立了能够实现大规模工厂化生产的‘易丰’女贞组培快繁体系。最佳的诱芽培养基为WPM+ 0.3 mg/L KT+0.1 mg/L 6-BA+0.05 mg/L NAA;最佳的增殖培养基为WPM+ 0.5 mg/L KT + 1.0 mg/L 6-BA + 0.05 mg/L NAA;最佳的生根培养基为1/2WPM+ 1.5 mg/L IBA + 0.1 mg/L NAA+1 g/L AC。
| [1] | 罗睿. 粗壮女贞的组织培养与快速繁殖[J]. 植物生理学通讯, 2001, 37(5):422. |
| [2] | 李淑瑜, 尚爱芹, 张钢. 大叶女贞组培快繁体系的建立[J]. 林业科技, 2009, 34(2):1-4. |
| [3] | 孔青, 刘林, 李华斌. 药用植物女贞的快繁[J]. 山东林业科技, 2008(3):69-70. |
| [4] | 颜昌敬. 植物组织培养手册[M]. 上海:上海科学技术出版社, 1990. |
| [5] | 康美玲. 虎舌红组织培养技术体系研究[D]. 雅安:四川农业大学, 2003. |
| [6] | 李莹, 罗晓芳, 蒋湘宁. 美国红枫外植体选择及启动培养研究[J]. 黑龙江农业科学, 2010(8):6-9. |
| [7] | 李乃伟, 李云龙, 蔡小龙, 等. 4种(品种)冬青属植物组织培养的研究[J]. 江苏农业科学, 2010(6):73-75. |
| [8] | 詹亚光. 白桦的组织培养和遗传转化研究[D]. 哈尔滨:东北林业大学, 2001. |
| [9] | 唐丽, 钟秋平, 刘显梅, 等. 红翅槭的组织培养及快繁技术[J]. 生物技术, 2010(9):136-138. |
| [10] | 王港, 陈骏, 侯娜, 等. 杉木无性系规模化组培繁育技术研究[J]. 湖北林业科技, 2014, 43(5):8-9. |
| [11] | 李晓玲, 卢绪志, 边震, 等. 山樱花组培快繁技术研究[J]. 林业科, 2014, 39(5):1-3. |
| [12] | 沈海龙. 树木组织培养微枝试管外生根育苗技术[M]. 北京:中国林业出版, 2009. |