大豆富含蛋白质和油脂,是我国极重要的粮食作物和经济作物[1]。通过基因工程改良大豆育种是现在的研究热点。第一例转基因植物就是采用的就是农杆菌介导法,通过这一方法已获得的转基因植物占转基因植物总数4/5,已成为植物基因转化首选方法[2]。虽然农杆菌介导的大豆遗传转化技术日趋成熟,但有很多瓶颈问题急需优化改良,转化效率低,重复性差,转化周期很长等,目前提高转化效率和相对稳定性依然是现在转基因研究的重点[3, 4, 5]。转基因技术改变人们生活的同时,转基因植物生物安全性受到社会各界关注,其中最主要的问题是选择标记,目前切除选择性标记的方法包括共转化系统、同源重组、转座子系统和位点特异性重组系统等[6, 7, 8]。Cre/loxp 标记去除(位点特异性重组系统)具有较高的可控性,是目前转基因研究中应用广泛较理想的标记去除方法。
本研究以4个栽培品种豫豆22、冀豆16、中黄13、吉林35为转化受体材料,探究共培养天数、共培养温度、单壁碳纳米管(NM)对诱导率和转化效率的影响,以期为根癌农杆菌介导的大豆子叶节转化体系的优化提供参考,获得的AtPHR1转化植株,以期为耐低磷大豆培育提供基础材料。
1 材料与方法 1.1 供试材料 1.1.1 大豆品种豫豆22、冀豆16、中黄13、吉林35。
1.1.2 菌株和质粒根癌农杆菌菌株为LBA4404,质粒为PX6-PHR1(图 1),含AtPHR1基因(南开大学李明刚教授提供)。
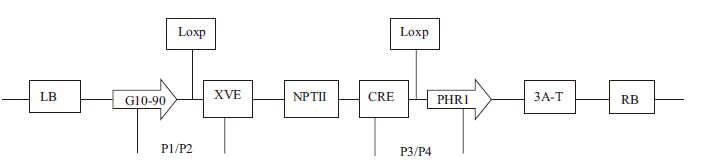
|
| 图 1 质粒的T-DNA 区 |
见表 1。
从4℃保存的平板上挑取单菌落接种到LB液体培养基中,28℃培养OD600=0.6-0.8时取1 mL菌液转入新鲜LB培养基中二次活化,培养至OD600=0.6-0.8,5 000 r/min,离心10 min,去上清液,菌体重悬于共培养液体中调整OD600=0.3-0.5。
1.2.1.2 共培养将无菌苗制备的子叶节放入上述制备好的菌体悬浮液中,侵染30-60 min后近轴面朝下接种到共培养基上培养。本研究在共培养阶段设置了以豫豆22无菌苗的子叶节为转化外植体的3个单因素试验。(1)共培养温度试验:培养温度分别设置为19、22、24和25℃;(2)共培养天数:设置了共培养时间分别为7、10和13 d的单因素试验,每个处理接种200个外植体;(3)单壁碳纳米管分散液(NM)对外植体芽诱导率的影响:选取3个大豆品种(豫豆22、中黄13、吉林35)的子叶节为外植体放入含0和40 mg/L NM的不含km、carb、cef的芽诱导培养基中,选出芽诱导率最高的品种;(4)含40 mg/L NM浸染液对诱导率的影响:以豫豆22子叶节为试验材料,OD600=0.5的菌液离心后重悬于含40 mg/L NM的共培养液体培养基中作为浸染液,以无任何添加物的浸染液做对照,比较两种浸染液对芽诱导率的影响;(5)含不同浓度NM对外植体芽诱导率的影响:以豫豆22子叶节为试验材料,在共培养固体培养基中加入单壁碳纳米管,设置4各处理,浓度分别为0、20、40和60 mg/L,每个处理接种150个外植体;(6)以豫豆22子叶节为试验材料,在共培养液体培养基中加入40 mg/L NM,同时在固体培养基中加入20 mg/L NM,以无添加的培养基为对照,统计两种试验条件下芽诱导率和转化效率的差异。
1.2.1.3 植株再生共培养后的子叶节用无菌水冲洗后接种于芽诱导培养基,每15 d继代一次。经过两次继代后将长出的抗性芽转入芽伸长培养基中,待抗性芽生长至2-4 cm后转入生根培养基中,根系健壮,炼苗3-5 d后移栽到草炭土:蛭石=3:1的营养土中。
1.2.2 转PHR1基因植株的检测选用SDS法提取卡那霉素抗性植株叶片的基因组DNA,进行目的基因的扩增和琼脂糖凝胶电泳的检测。扩增设计的引物为:P1:5'-CCATCTCCACTGACGTAAGGGAT-3';P2:5'-CTCGTCAATTCCAAGGGCATCGGT-3'。P3:5'-CTGGACACAGTGCCCGTGTCGGA-3';P4:5'-AC-AGCCTCAACAAAAGCCTCGTG-3'。PHR1:5'-CCTC-ACACGCACTTCTTCAA-3';PHR2:5'-GCTCTTTCA-CTACCGCCAAG-3'其中P1/P2为载体扩增引物,P1在G10-90处,P2在第一个Loxp site下游,片段长度是653 bp;P3设计在Cre上游,P4在第二个Loxp site下游的基因内部,P3/P4片段长度为1.3 kb。PHR1/PHR2为ATPHR1基因内部特异性引物,扩增片段长度为710 bp。
1.2.3 数据统计芽诱导率(%)=出芽外植体数/总外植体数×100%。
阳性率(%)=PCR阳性株数/总外植体数×100%。
2 结果 2.1 转AtPHR1植株的获得采用农杆菌介导子叶节的遗传转化方法,将AtPHR1基因分别转入豫豆22、冀豆16和中黄35中,设计P1/P2、P3/P4和PHR1/PHR2引物(1.2.2方法)PCR检测转基因植株。P1/P2扩增结果(图 2)如预期大小,目的片段长度约为650 bp,P3/P4扩增(图 3)片段长度为1.3 kb,符合预期大小。PHR1/PHR2扩增结果(图 4)符合预期大小,片段长度约为710 bp。

|
| 图 2 部分转基因植株以P1/P2 引物的PCR 扩增结果 |
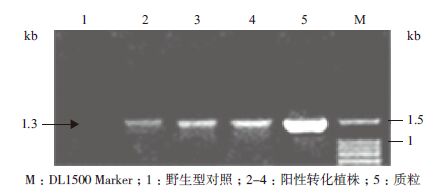
|
| 图 3 部分T1 转基因植株以P3/P4 引物的PCR 扩增结果 |

|
| 图 4 部分T1 转基因植株以PHR1/PHR2 引物的PCR 扩 增结果 |
本实验以豫豆22为材料,设计浸染菌液浓度分别为OD600=0.2、0.3、0.4、0.5、0.6,将子叶节外植体分别浸染在不同的菌液浓度中,研究不同浸染菌液浓度对转化效率的影响。结果(表 2)显示,随菌液和侵染液浓度的增加,转化阳性率的变化较大,当浸染液OD600=0.5时,转化效率达到最高,达10.4%。故本研究其他后续实验均采用菌液浓度OD600=0.5,侵染液浓度OD600=0.5 的组合进行处理。
不同共培养时间培养后的阳性转化率,以共培养10 d的转化率是最高的,达8.06%,共培养7 d和13 d的转化效率则分别是3.01%和3.39%(图 5),表明适宜的共培养时间为10 d。
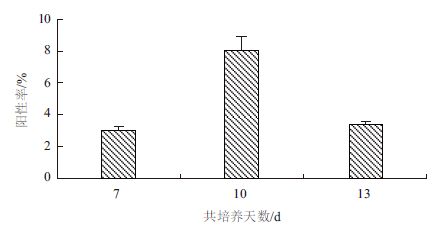
|
| 图 5 共培养天数对阳性率的影响 |
当共培养温度为19℃和22℃时的转化效率偏低,仅为1.45%和1.73%,而共培养温度为24℃时培养的外植体有最高转化效率,为4.12%,当温度继续升高至26℃时转化效率又有降低趋势(图 6),结果表明共培养24℃时更有利于提高转化效率。

|
| 图 6 不同共培养温度对转化效率的影响 |
以中黄13、吉林35、豫豆22为实验材料,在芽诱导培养基中加入40 mg/L的NM,结果见表 1,吉林35子叶节外植体的40 mg/L NM处理的芽诱导率比对照低24.9%,而其他两个品种的芽诱导率都高于对照,其中豫豆22芽诱导率比对照高124.5%,效果最明显,试验表明在豫豆22中添加40 mg/L的NM明显促进子叶节分化,后续NM探究实验均使用豫豆22为实验材料。
2.4.2 浸染液添加NM对芽诱导率的影响 以豫豆22子叶节为实验材料,OD600=0.5的菌液离心后重悬于含40 mg/L NM的共培养液体培养基中作为浸染液,以无任何添加物的浸染液做对照,统计两种浸染液对芽诱导率的影响。结果(表 4)显示,加入40 mg/L NM的浸染液芽诱导率为18.8%,对照为4.4%,相比对照的芽诱导率高337.3%,实验表明共培养液体培养基添加40 mg/L NM对芽诱导率有促进作用。
NM对芽诱导率的影响 在共培养阶段加入不同浓度的NM对卡那霉素抗性不定芽的诱导(图 5),加入20 mg/L NM后芽诱导率(14.18%)比对照高81.8%,NM浓度升高至40 mg/L后,芽诱导率降到6.19%低于对照,NM加至60 mg/L后,芽诱导率为9.20%与对照相近,。说明加入20 mg/L NM后的共培养基有利于抗性不定芽的诱导分化。
2.4.4 共培养基与浸染液中分别添加适宜浓度NM对转化效率的影响以豫豆22子叶节为试验材料,在共培养液体培养基中加入40 mg/L NM,同时在固体培养基中加入20 mg/L NM,以无添加的培养基为对照,统计两种实验条件下芽诱导率和转化效率的差异。结果(表 4)显示,加入适宜浓度的NM处理后的芽诱导率与对照相差不多,但阳性率比对照低,说明在固体和液体培养基中都加NM对遗传转化无促进作用。
3 讨论本研究在参考前人对农杆菌介导大豆子叶节转化的优化改良经验基础上,进一步探究了重要影响因素浸染液浓度、共培养天数、共培养温度和单壁碳纳米管液对芽诱导率的影响。
农杆菌侵染效率是影响植物转化效率的重要因素,主要与菌株种类、菌液浓度、侵染液浓度和侵染时间有关[9]。其中,农杆菌菌液浓度代表着菌液生长时期,而处于对数生长期的菌液被认为是侵染能力最强、侵染效率最高的状态。侵染液浓度代表着一定体积内菌体的含量,浓度过低则没有足够的外源DNA进入外植体,侵染效果差,而侵染液浓度过高,则会使多余的菌体附着在外植体伤口周围,导致后期农杆菌生长旺盛、难以抑制,对植物细胞造成毒害。本研究结果发现,以菌液和浸染液的OD600=0.5的抗性芽诱导率最高,处理效果最佳,武小霞等[10]研究显示浸染液的OD600=0.5的芽诱导率最高,与本研究结果一致。

|
| 图 7 不同NM 浓度对抗性芽诱导率的影响 |
共培养阶段是建立高效转化体系的重要参数,在此阶段是子叶节和农杆菌共生时期,所涉及到的因素都是影响转化效率的关键。合适的共培养温度能使农杆菌和外植体均处于遗传转化的最佳状态,共培养温度过低或过高都直接影响了外植体的转化效果,关于这方面的研究仍然不断进行,但结果不尽相同[11]。本研究显示共培养温度为24℃,转化效率最好,是农杆菌与外植体均处于适宜的转化状态的温度,使二者都能达到较理想的转化状态。共培养天数同样是共培养阶段极重要的转化效率影响因子,理论上讲随共培养时间增长,农杆菌繁殖越多,转化就越容易完成,但是农杆菌的过量繁殖反而会对子叶节造成毒害,降低转化效率[12]。目前普遍认为以大豆子叶节遗传转化的最佳共培养天数为3-5 d[12, 13, 14],本研究就共培养时间对转化率的影响进行探究,结果显示共培养10 d的阳性率更高,7 d和13 d的转化效果不及10 d,可能是由于共培养时间较短时,影响了T-DNA转移到植物细胞的几率,而共培养时间过长时农杆菌的过量繁殖对子叶节外植体造成影响,子叶节受到毒害,使转化效率降低,而且共培养后期农杆菌抑制困难,本研究中取得最优转化效率的共培养天数为10 d。
纳米材料尺寸为1-100 nm,在电子机械、农业化工、生物医药等方面都应用广泛,人工纳米材料伴随科技发展引起人们高度关注[15]。目前纳米材料对植物生长发育或促进或抑制或无影响的作用都有报道[16],但都尚在起步阶段。关于人工纳米材料可以促进大豆萌发[17],提高光合反应效率[18],增加某些胁迫相关基因的表达[19],制成纳米增效肥料等时有报道,综合发现纳米材料对植物生长的影响与纳米材料的种类、浓度、形态以及植物的类型有关。纳米材料最主要的特点是尺寸小,处于单个原子或分子与宏观粒子交界的过渡区域,纳米材料有小尺寸效应,粒子无周边边界,使其产生的磁场与植物本身的磁场具有宏观量子隧道的主动靶向性,将会携带大量的养分离子进入植物体内,因此相应地提高了植物吸收养分和水分的能力。本研究将单壁碳纳米管分散液加入共培养基中,探究其对大豆子叶节不定芽诱导率的影响。结果表明不同品种的子叶节外植体在中添加40 mg/L NM[20]诱导培养基诱导分化的效果不同,本研究中豫豆22和中黄13的诱导率比对照高,吉林35低于对照;在浸染液中添加40 mg/L NM和固体培养基中加入的20 mg/L NM可提高芽诱导率,可能原因是NM的小尺寸效应。
本研究应用的载体具有Cre/loxp系统,可删除除卡那抗性标记。PHR1基因是耐低磷相关的正向调控转录因子基因,是高等植物中的磷信号调控体系核心转录因子,参与植物磷素运输和再利用[21, 22]P1/P2、P3/P4 和PHR1 /PHR2引物扩增结果说明启动子G10-90、Cre/loxp系统及AtPHR1基因完整的整合进大豆基因组中,为进一步获得删除卡那抗性标记的转PHR1基因大豆奠定材料基础。
4 结论本研究探讨的农杆菌介导子叶节影响因素结果显示菌液和浸染液OD600=0.5,共培养温度为24℃,共培养10 d的转化效率最高,诱导培养基和共培养基中加入NM可提高芽诱导率。
| [1] | 余永亮, 梁慧珍, 王树峰, 等.中国转基因大豆的研究进展及其产业化[J].大豆科学, 2010, 29(1):143-150. |
| [2] | 任海祥, 南海洋, 曹东, 等. 大豆转基因技术研究进展[J]. 东北农业大学学报, 2012, 43(7):6-12. |
| [3] | Somers DA, Samac DA, Olhoft PM. Recent advances in legume transformation[J]. Plant Physiology, 2003, 131:892-899. |
| [4] | 刘圣君, 黄健秋, 卫志明.影响农杆菌介导的大豆子叶节遗传转化的因素[J].分子细胞生物学报, 2007, 40(5):286-292. |
| [5] | 刘翠, 李喜焕, 常文锁, 等.农杆菌介导大豆不同外植体遗传转化研究]J].华北农学报, 2012, 27(3):35-40. |
| [6] | Bertolla F, Kay E, Simonet P. Potential dissemination of antibiotic restistace genes from transgenic plants to microorganisms[J]. Infect Control Hosp Epidemiol, 2000, 21(6):390-393. |
| [7] | Losey JE, Rayor LS, Carter ME. Transgenic pollen harms monarch larvae[J]. Nature, 1999, 399:214-215. |
| [8] | 祁永斌, 刘庆龙, 陆艳婷, 等.转基因植物中删除选择标记基因的研究进展[J].浙江农业学报, 2014, 26(5):1387-1393. |
| [9] | 周思军, 李希臣, 刘昭军, 等. 大豆农杆菌介导转化系统的优化研究[J]. 大豆科学, 2001, 32(4):313-319. |
| [10] | 武小霞, 李静, 刘伟婷, 等. 大豆农杆菌子叶节转化菌株适宜生长时期及浸染浓度的研究[J]. 东北农业大学学报, 2010, 41(1):1-6. |
| [11] | 刘海坤 卫志明. 利用农杆菌介导转化大豆成熟种子胚尖获得转基因植株[J[. 植物生理与分子生物学学报, 2004, 30(6):631-636. |
| [12] | 段莹莹, 赵琳, 陈李淼, 等.农杆菌介导的大豆子叶节和下胚轴转化方法的比较及优化[J].大豆科学, 2010, 29(4):590-593. |
| [13] | Meurer CA, Dinkins RD, Collins GB. Factors affecting soybean cotyledonary node transformation[J]. Plant Cell Rap, 1988, 18:180-186 |
| [14] | 应珊, 何晓薇, 王秀荣, 寿惠霞.影响农杆菌介导的大豆转化效率的因素研究[J].分子植物育种, 2008, 6(1):32-40. |
| [15] | Masciangioli T, Zhang WX. Environmental technologies at the nanoscale[J]. Environ Sci Technol, 2003, 37:102a-108a. |
| [16] | 吕继涛, 张淑贞. 人工纳米材料与植物的相互作用:植物毒性、吸收与传输[J]. 化学进展, 2013, 25(1):156-163. |
| [17] | 陆长梅, 张超英, 温俊强, 等. 纳米材料促进大豆萌发, 生长的影响及其机理研究[J]. 大豆科学, 2002, 21:168-172. |
| [18] | Ma LL, Liu C, Qu CX, et al. Rubisco activase mRNA expression in spinach:Modulation by nanoanatase treatment[J]. Biological Trace Element Research, 2008, 122(2):168-178. |
| [19] | Khodakovskaya M, Dervishi E, Mahmood M, et al. Carbon nanotubes are able to penetrate plant seed coat and dramatically affect seed germination and plant growth[J]. American Chemical Society Nano, 2009, 10:3221-3227. |
| [20] | 王晓红. 单壁碳纳米管对大豆子叶节外植体分化与再生影响的研究[D]. 北京:中国农业科学院, 2013. |
| [21] | 杨致荣, 王兴春, 李西明.高等植物转录因子的研究进展[J]. 遗传, 2004, 26(3):403-408. |
| [22] | 张彩英, 李喜焕, 常文锁, 等.大豆 GmPHR1 基因及其编码的蛋白和应用:中国, ZL 201010528355.X[P].2012-09-05. |








