肿瘤坏死因子(TNF-α)是由单核巨噬细胞激活后分泌的一种细胞因子,能够与特异受体结合后发挥多种生物学效应,包括免疫激活、炎症反应。类风湿性关节炎(Rheumatoid arthritis,RA)是一种以慢性侵蚀性关节炎为特征的自身免疫炎性疾病,致残率较高。在RA 患者的关节的滑膜液中TNF-α呈高表达,它会引起病理性炎症,并且破坏关节,因此TNF-α 抑制剂可以用于治疗RA,因此能中和TNF-α的抗TNF-α单克隆抗体成为研究的热点。
现在工业领域单克隆抗体纯化的方法主要包括离心、过滤以及柱层析等方法,其中柱层析的方法又包括亲和层析、离子层析、疏水层析和复合层析等[2, 3, 4, 5, 6]。工业上纯化单克隆抗体通常采用三步纯化法[7],即通过三步串联的层析来获得达到质量标准的原料药。而两步串联层析工艺比较少见,因为两步串联层析工艺往往很难达到原料药的质量要求。本研究通过亲和层析与阳离子层析串联的两步串联层析,对CHO细胞表达的人源化抗TNF-α单克隆抗体进行纯化,旨在提高回收率和纯度,为进一步的工艺放大提供实验依据。
1 材料与方法 1.1 材料参比制剂(全人源抗TNF-α抗体,原研美国Abbvie);抗TNF-α单克隆抗体由本实验室制备(CHO细胞系由本实验构建表达),通过两次离心后过0.2 μm滤膜获得;GE avant 25中低压层析仪(检测波长为280 nm)、PALL层析柱2根(1. 0 cm ×20 cm,内填装GE MabSelect SuRe填料以及GE Source30阳离子填料)、Agilent1260 HPLC(安捷伦公司)、BECKMAN PA800 Plus毛细管电泳系统(BECKMAN 公司),其他试剂均为分析纯试剂。
1.2 方法 1.2.1 亲和层析柱纯化将装填好的protein A层析柱连接到层析系统上,用3倍柱体积上样缓冲液(25 mmol/L PBS pH7.0)平衡柱子,然后样品进行直接上样(原样品经过3 000×g 两次离心过0.2 μm滤膜),用2倍柱体积平衡缓冲液冲洗柱子(基线平稳),然后用不同pH值(3.4、3.6、3.8、4.0和4.2)的洗脱缓冲液(50 mmol/L柠檬酸缓冲液)进行洗脱,收集洗脱组分,检测。
1.2.2 阳离子层析柱纯化将装填好的阳离子Source30 层析柱连接到层析系统上,用3倍柱体积上样缓冲液(50 mmol/L PBS pH6.0)平衡柱子,然后进行上样(上样量30 mg/mL,样品被调节pH6.0),用3倍柱体积平衡缓冲液冲洗柱子(基线平稳),然后用不同pH值及不同盐浓度的洗脱缓冲液进行洗脱,收集洗脱组分,检测。洗脱步聚为:先用pH为6.5、6.0、5.5的50 mmol/L PBS条件进行洗脱,选出最佳pH值,然后在此pH上加入不同浓度盐进行洗脱优化。
1.2.3 HPLC测定抗TNF-α单克隆抗体浓度用0.1 mol/L磷酸缓冲液以2 mL/min流速平衡HPLC系统15 min至基线平稳,于系统程序中设置标准曲线法程序。进样25 μL于进样器,以2 mL/min流速洗脱,记录所检测的标准品对应浓度的峰面积和样品峰面积,计算样品浓度。计算公式:Ci=Ai/As*Cs,Ci:测定样品浓度( mg/mL);Cs:标准品浓度( mg/mL);Ai:供试品峰面积;As:标准品峰面积。溶液抗体含量公式:M=Ci*V,M为溶液抗体含量(mg);V为溶液体积(mL)。
1.2.4 毛细管电泳系统测定抗TNF-α单克隆抗体纯度毛细管电泳系统分别用1 mol/L NaOH 洗5 min、水洗5 min 及分离缓冲液洗10 min 。每次进样前,分别用0.1 mol/L NaOH 及分离缓冲液洗1 min 后即可进样。
1.2.5 HPLC测定多聚体含量取25 μL样品加缓冲液1 mL稀释,上样10 μL,流速0.5 mL/min;检测波长为280 nm。
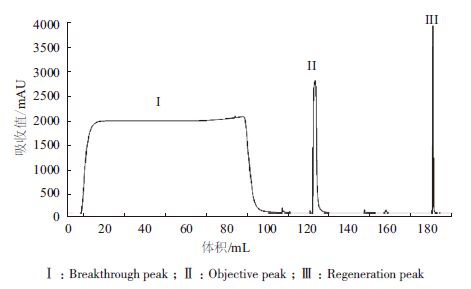
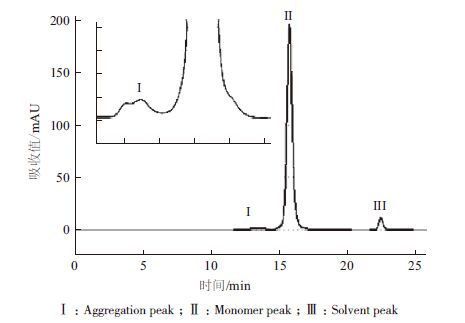
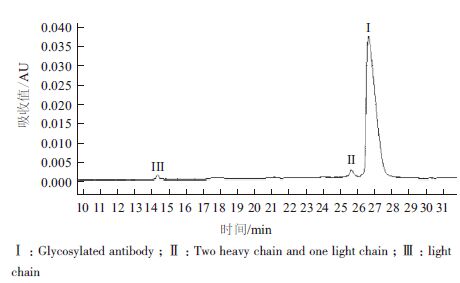
2 结果 2.1 亲和层析优化及鉴定在前期预实验中,保留时间、电导及缓冲液对纯化效果的影响不大,不是关键参数。只有pH的影响较大,是关键性参数,所以在实验中针对pH进行一定的优化。表 1中,此亲和填料的上样载量为20 mg/mL,样品经离心过滤处理后无需调节直接上样,实验了不同的洗脱pH值3.4、3.6、3.8、4.0及4.2,结果表明,除pH4.2,回收率无显著差别,而pH4.0时纯度与多聚体最佳,达到了95.3%及2.0%。选取pH4.0作为亲和层析的洗脱条件(图 1-3)。
|
| 图 1 protein A 在洗脱pH4.0 纯化色谱图 |
|
| 图 2 protein A 在洗脱pH4.0 纯化样品多聚体检测图 |
|
| 图 3 亲和层析在洗脱pH4.0 纯化样品非还原纯度图 |
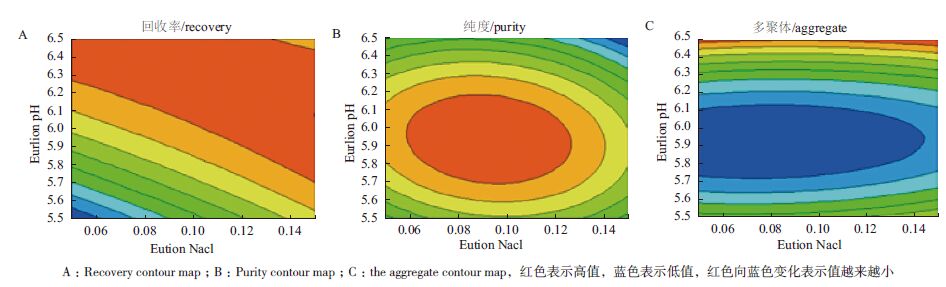
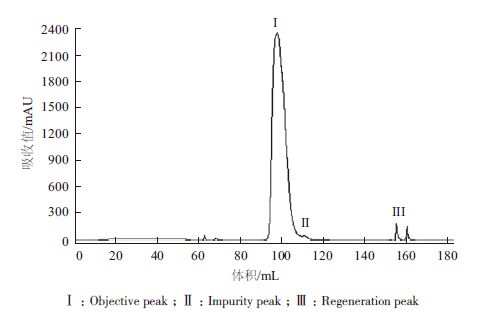
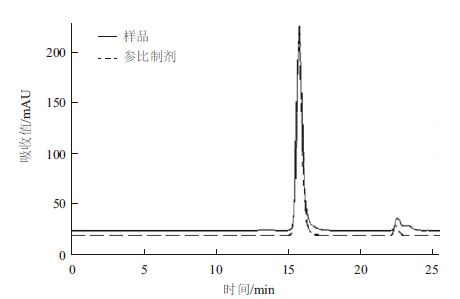
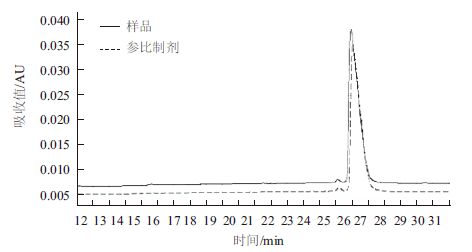
对阳离子Source 30的两个洗脱参数(洗脱pH、洗脱盐浓度)进行DoE设计优化,两个参数设计区间分别洗脱pH(5.5-6.5)以及洗脱盐浓度(0.05-0.15 mol/L NaCl),利用GE avant 25自带的DoE程序进行实验设计,采用的中心复合表面设计(Central Composite Face,CCF),共11个实验(包含3个中心点),并对结果进行DoE分析。对回收率、纯度及多聚体来说,模型拟合参数R2分别为0.930、0.931以及0.954,表明数据与拟合模型的拟合度很高。图 4表示二因素影响关于回收率、纯度、多聚体的等高线图。最佳的条件是需要满足纯度高、多聚体含量低,而且回收率尽量高。DoE的优势之一在于:通过拟合模型以及制定的因变量范围,预测自变量取值区间。为达到参比制剂质量水平(纯度97%以上,回收率90%以上,多聚体0.3以下),合适的条件范围为0.05-0.13 mol/L NaCl以及pH5.7-6.0。 可以选定pH6.0与0.10 mol/L NaCl作为Source 30的洗脱条件(表 2),图 6与图 7是实验10的结果,实验10的质量与参比制剂基本一致,且回收率有94.3%,回收率相对较高(图 5)。
|
| 图 4 DoE CCF 设计等高线图 |
|
| 图 5 实验10 纯化色谱图 |
|
| 图 6 实验10 洗脱样品多聚体图 |
|
| 图 7 实验10 洗脱样品非还原纯度图 |
随着多种“重磅炸弹”治疗性单抗专利到期,越来越多的生物药公司加入到单克隆抗体药物的仿制大军之中。目前,约70%-80%的抗体纯化使用了protein A、protein G亲和层析,因为该法可一步从细胞培养上清液中几乎完全纯化抗体,绝大多数的药厂都采用亲和层析作为捕获层析,有研究表明protein A一步亲和层析纯度能达90%-95%[8, 9, 10, 11, 12, 13, 14, 15, 16, 17]。实验中对protein A填料的不同洗脱pH值进行了优化,得到pH4.0时为最佳。此时回收率为98.5%,非还原纯度为95.3%,多聚体含量为2.0%。
由于上游发酵工艺的控制,电荷异质性已达到参比制剂的水平,所以无需进一步在下游纯化工艺上进一步优化。而宿主蛋白(Host cell protein,HCP)、DNA经过两步层析已达到参比制剂的水平(数据末在文中列出)。另外,在亲和层析后有一步病毒灭活以及在阳离子之后有一步病毒的过滤(未在文中表述),经过这些措施后病毒去除已达法规要求。 阳离子层析是纯化过程中常用的一种层析技术,它的原理主要是抗体与杂质基于不同带电性质与带电量差异进行分离,与配基所带电荷相反的物质被结合,相同的电荷不结合。而盐与抗体则是竞争性的结合配基,盐浓度越大,结合力越大,意味着抗体越容易被洗脱[18, 19, 20]。决定离子层析的纯化效果的一个很重要的因素就是分辨率,而分辨率受多种因素的影响,包括填料粒径、配基、孔径和缓冲液环境等,其中粒径对分辨率的影响很显著,粒径越小,分辨率越高,选取GE 制备性填料中粒径最小的阳离子填料Source30,接在亲和填料protein A之后进一步优化,它的粒径为30 μm,且其基质为复合物聚苯乙烯/二乙烯苯,可以耐受很高压力,适合工业放大。多聚体的形成机理复杂且种类较多,根据不同的分类方式有可逆的多聚体及不可逆的多聚体;也可以分为二聚体、三聚体及多聚体等等;多聚体是由单体聚合产生,它的形成相对于单体而言在电荷及分子大小上发生了改变,本研究选用的阳离子Source30基于抗体电荷差异来分离单体与多聚体;同时由于Source30粒径越小,填料的分子筛效应越明显,通过分子量差异分离的效果也就更明显。DoE分为很多类型,有全因子设计、中心复合序贯设计(CCC)、中心复合设计(CCI)、中心复合表面设计(Central composite face,CCF),Box-behnken设计等等,本实验采用的是CCF设计,探讨了洗脱pH值及盐浓度对纯化的影响,通过阳离子Source DoE优化,为达到参比制剂质量水平(纯度97%以上,回收率90%以上,多聚体0.3以下),筛选出最佳条件范围为0.05-0.13 mol/L NaCl以及pH5.7-6.0,选定pH6.0与0.10 mol/L NaCl作为Source洗脱条件。此时回收率94.3%,纯度97.3%,多聚体0.3%,其质量与参比制剂接近。本研究中建立的采用protein A 串联阳离子Source30两步层析法纯化抗TNF-α单克隆抗体,有回收率高、纯度高的特点,为其进一步的工业放大提供了实验依据。
4 结论通过优化,亲和层析的最佳洗脱条件为pH4.0。第二步的阳离子填料Source30的筛选出最佳洗脱范围为0.05-0.13 mol/L NaCl及pH5.7-6.0,选定pH6.0与0.10 mol/L NaCl作为Source洗脱条件,此时回收率94.3%,纯度97.3%,多聚体0.3%。
| [1] | Tsuji S, Higashiyama M, Inaoka M, et al. Effects of adalimumab therapy on musculoskeletal manifestations and health-related quality of life in patients with active psoriatic arthritis[J]. Modern Rheumatology, 2013, 23(3):529-537. |
| [2] | 吕若芸, 程立均. 新型混合模式层析技术在单克隆抗体精细纯化中的应用[J]. 中国生物制品学杂志, 2011:609-612. |
| [3] | Gagnon P. Technology trends in antibody purification[J]. Journal of Chromatography A, 2012, 1221:57-70. |
| [4] | Ayyar BV, Arora S, Murphy C, et al. Affinity chromatography as a tool for antibody purification[J]. Methods, 2012, 56(2):116-129. |
| [5] | Hober S, Nord K, Linhult M. Protein A chromatography for antibody purification[J]. Journal of Chromatography, 2007, 848(1):40-47. |
| [6] | 沈泓, 林琼秋, 易喻, 等. 应用疏水层析法纯化hCG单克隆抗体[J]. 药物生物技术, 2012, 19(5):401-405. |
| [7] | 马泓冰, 孙中文, 徐颖, 等. 两步串联层析法纯化鼠抗人CD28单克隆抗体2F5[J]. 细胞与分子免疫学杂志, 2007(2):152-154. |
| [8] | 范丽君, 吕立力, 刘煜, 等. 阿达木单抗抗原结合片段在大肠杆菌中的共分泌表达和纯化[J]. 药物生物技术, 2014(3):204-158. |
| [9] | Liu Q. Fully human antibody to human TNF-α, molecular evolution and use thereof:US, 8354108[P]. 2013-01-15. |
| [10] | 周华蕾, 吕茂民, 王娜, 等. 应用A蛋白亲和层析法纯化单克隆抗体[J]. 生物技术通报, 2005(5):72-74. |
| [11] | 马泓冰, 庄羽美, 徐颖, 等. 阳离子交换一步层析法纯化抗gp130单克隆抗体[J]. 细胞与分子免疫学杂志, 2005(3):337-339. |
| [12] | 崔文禹, 李计来, 凌媛, 等. 抗人肿瘤坏死因子-α人源单克隆抗体在CHO细胞中的表达及鉴定[J]. 中国生物制品学杂志, 2014, 12:1547-1550. |
| [13] | 李亚南. 重组人肿瘤坏死因子受体融合蛋白(rhTNFR:FC)对脓毒症大鼠心肌损伤的保护作用[D]. 合肥:安徽医科大学, 2013. |
| [14] | 吕自明. 重组人肿瘤坏死因子α影响人脐静脉内皮细胞活性及PD-L1蛋白表达的研究[D]. 广州:南方医科大学, 2013. |
| [15] | Lathem WW, Price PA, Miller VL, et al. A plasminogen-activating protease specifically controls the development of primary pneumonic plague[J]. Science, 2007, 315(5811):509-513. |
| [16] | Li B, Guo Y, Guo Z, et al. Serologic survey of the sentinel animals for plague surveillance and screening for complementary diagnostic markers to F1 antigen by protein microarray[J]. Am J Trop Med Hyg, 2008, 79(5):799-802. |
| [17] | 徐翠香, 胡志明, 李金龙, 高基民. SA-TNF-α融合蛋白高效表达、纯化及复性研究[J]. 南方医科大学学报, 2009, 3:412-415. |
| [18] | 缪小牛, 陈卫, 张娟, 等. 重组人TNF-α在大肠杆菌中的表达、纯化及生物学活性研究[J]. 药物生物技术, 2013, 2:95-99. |
| [19] | 邹岳奇, 阎静辉, 刘玉翠. 国产羟基磷灰石纯化单克隆抗体的探讨[J]. 生物化学与生物物理进展, 1991, 2:164-165. |
| [20] | 杜春红, 唐雪, 石丽媛, 等. 应用羟基磷灰石层析分离纯化鼠疫菌Pla蛋白的研究[J]. 疾病预防控制通报, 2011, 5:10-12. |






