肿瘤坏死因子(Tumour necrosis factor,TNF),又叫恶病质因子(Cachectin)[1]。TNF按其结构分两型:TNF-α和TNF-β。TNF-α参与的多种致病机制,包括内皮细胞的激活、细胞因子的诱导、白细胞的聚集、破骨细胞的活化与软骨的破坏等[2]导致炎症反应持续发生、软骨与骨的渐进性破坏[2, 3, 4]。黏附分子是一类介导细胞与细胞间或细胞与基质间相互作用的分子。白细胞表面黏附分子(E-Selectin)、白细胞细胞间黏附分子-1(Intercellular adhesion molecule-1,ICAM-1)和血管细胞黏附分子-1(Vas-cular celladhesion molecule-1,VCAM-1)属于免疫球蛋白超家族成员。研究认为,VCAM-1和ICAM-1在介导的炎症发生过程中起到了极其重要的作用[5, 6],其中在病变形成早期和进展期,黏附分子促进内皮黏附、迁移并与其他细胞作用,在整个病变过程中起到了关键性的作用 [7, 8]。
近些年来,针对TNF-α的药物研究倍受关注,其中中和TNF-α的抗体生物药成为研究热点。生物药结构复杂,理化分析不能完全诠释它的功能与活性,所以在研究生产中,建立简单准确的活性分析方法十分必要。针对TNF-α抗体的常用活性分析方法为TNF-α诱导L929细胞毒性实验,鉴于单抗生物药的特殊性,单一检测方法不够科学,采用多种体外活性试验方法评价生物药的生物活性显得越来越重要。虽然,国内外有不少文献资料[5, 6, 7, 8, 9, 10]报道可以用HUVEC细胞检测抗TNF-α抗体活性,但还没有文章对该检测方法有详细、系统的描述。本研究采用TNF-α刺激HUVEC细胞产生白细胞黏附因子(ELAM-1),通过抗体抑制细胞表面ELAM-1的表达,建立抗TNF-α抗体的活性检测方法,对其进行系统验证,以期研究该方法的可行性。
1 材料与方法 1.1 材料 1.1.1 试剂抗TNF-α 单克隆抗体(美国雅培)、HUVEC细胞(ATCC CRL-1730)、F-12K培养液(GIBCO 21127022)、内皮细胞生长因子、吐温-20和肝素均来自SIGMA;胎牛血清、青霉素和链霉素溶液、胰蛋白酶溶液、DPBS溶液均采自HYCLONE;TNF-α冻干粉(GIBCO PHC3011)、戊二醛、鼠抗人ELAM-1和HRP标记的羊抗鼠IgG采自Abcam公司;TMB反应液(AB000802)来自广州怡雅;PBS粉末来自博士德。
1.1.2 仪器超净工作台(苏净安泰)、倒置显微镜(OLYMPUS IX71)、二氧化碳培养箱(Thermo 150i)、酶标仪(Molecular Devices MD M2E)、洗板机(Thermo)。
1.2 方法 1.2.1 细胞Elisa法检测ELAM-1的方法建立取对数生长期的HUVEC细胞,消化重悬计数并种植于96孔板中,100 µL/孔,每孔2 500个细胞,37℃,5% CO2培养箱中培育贴壁。加TNF-α溶液,200 µL/孔,37℃,5%CO2培养箱孵育刺激,加戊二醛溶液固定细胞;PBS洗板后,加入3%BSA 37℃封闭;PBS洗板3次,加稀释的鼠抗人ELAM-1单抗(一抗)50 µL/孔,37℃孵育;PBST洗板3次,加稀释的HRP标记的羊抗鼠IgG(二抗),每孔100 µL,37℃孵育;PBST洗板3次,加TMB溶液100 µL/孔,37℃显色;最后用1 mol/L硫酸终止反应,酶标仪450 nm读取光密度值。
1.2.2 TNF-α刺激细胞浓度摸索实验将TNF-α干粉溶于1 mL全培养液中,配制90 ng/mL的TNF-α溶液。将上述的TNF-α溶液进行梯度倍比稀释,得系列浓度的TNF-α溶液:0.35、0.70、1.40、2.81、5.62、11.25、22.50、45.00和90.00 ng/mL,各浓度设定3个复孔,设置细胞阴性对照孔,细胞Elisa法检测ELAM-1的表达量。
1.2.3 抗TNF-α抗体活性测定方法建立用一定浓度TNF-α和系列浓度抗体的混合溶液共同孵育贴壁后的HUVEC细胞,200 µL/孔。抗体标准溶液为640 ng/mL,将其倍比稀释,浓度范围为:2.5、5、10、20、40、80、160、320和640 ng/mL。设置细胞对照、TNF-α阳性对照、抗体对照及空白对照。各浓度均设3个复孔,依照1.2.1步骤通过细胞Elisa法检测450 nm处的光密度值。数值以四参数拟合回归方程Y=(A-D)/[1+(x/C)B]+D计算抗体与ELAM-1之间的剂量关系,得出抗体的生物学活性IC50值。
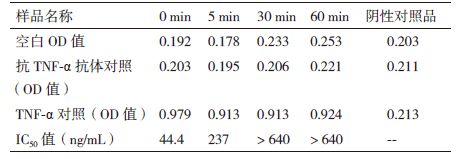
1.2.4 抗TNF-α抗体活性测定的验证 1.2.4.1 方法特异性分别配制系列浓度抗TNF-α抗体标准溶液和非抗TNF-α抗体样品溶液,并将抗TNF-α抗体70℃高温变性处理5 min、30 min、60 min。分别按1.2.3方法检测各条件下溶液的IC50值。
1.2.4.2 线性及准确度配制浓度为320 ng/mL(50%)、480 ng/mL(75%)、640 ng/mL(100%)、800 ng/mL(125%)、960 ng/mL(150%)的抗TNF-α抗体溶液,再按1.2.3实验方法分别倍比稀释并检测ELAM-1的值。每浓度水平溶液平行测定3条曲线,并将理论水平相对实际水平作直线拟合,得出线性方程。
1.2.4.3 精密度和中间精密度平行配制6份640 ng/mL的抗TNF-α抗体标准溶液,按1.2.3的抗体检测方法检测各份溶液的IC50值,计算得出抗体的活性。按抗体检测IC50与100%浓度抗体IC50比值得出相对活性。另一实验人员同样平行配制6份抗TNF-α抗体标准溶液,检测各份的IC50值,并同样计算出相对活性值。
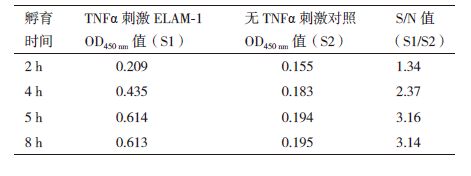
2 结果 2.1 细胞Elisa法检测ELAM-1方法建立逐一摸索细胞Elisa法检测ELAM-1的条件:细胞种植密度2 500 个/孔,细胞培育24 h贴壁后进入对数期。由表 1可知,5 h时ELAM-1表达量基本稳定,此时信噪比最佳,故选择TNF-α孵育时间为5 h。1%戊二醛固定30 min、3%BSA封闭1 h,一抗、二抗最佳稀释比例分别为1:1 500、1:4 000(图 1),孵育时间依次为2 h和1 h,TMB显色20 min,测定450 nm的光密度值。
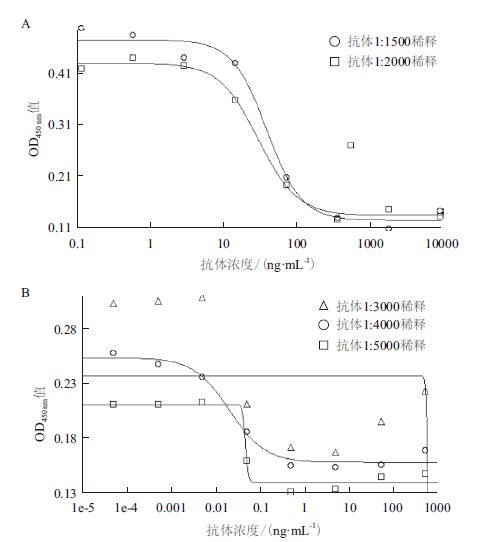
|
| 图 1 细胞Elisa 实验一抗(A)和二抗的稀释优化实验(B) |
根据1.2.2实验摸索TNF-α的刺激浓度,结果如图 2所示,随着TNF-α溶液浓度加大,细胞表面ELAM-1的表达量也呈现明显增大。当其浓度达到22.5 ng/mL时,ELAM-1的量基本达到平台,表明此条件下细胞表达达到饱和,因此在随后的实验中TNF-α刺激浓度被选择为22.5 ng/mL。

|
| 图 2 不同浓度的TNF-α 刺激细胞的ELAM-1 表达 |
根据2.1、2.2的结果,确定了TNF-α浓度及刺激孵育细胞的时间,同时也确定了一抗、二抗的稀释比例,由此建立了检测ELAM-1的实验方法。选择抗体初始浓度为640 ng/mL,以3倍稀释使终浓度为:2.5、5、10、20、40、80、160、320和640 ng/mL,检测结果(图 3)表明ELAM-1表达量与抗体浓度呈现一定的剂量关系。报告检测结果的绝对IC50值(38.5 ng/mL)体现抗体对TNF-α中和效力。

|
| 图 3 细胞Elisa 法检测抗体活性的剂效曲线 |
方法的专属性结果(表 2)表明,此方法只针对抗TNF-α抗体的活性检测,对于非抗TNF-α抗体(阴性对照品为贝伐单抗)在TNF-α对照和贝伐抗体对照的孔中,OD值没有任何变化,其结果曲线图也无明显剂效关系。此外,我们考察了高温破坏对于该类抗体活性的影响,如表 2所示抗体在70℃的高温下,时间越久,活性降低越多,当加热时间增至30 min时,抗体几乎完全聚合变性而失活。
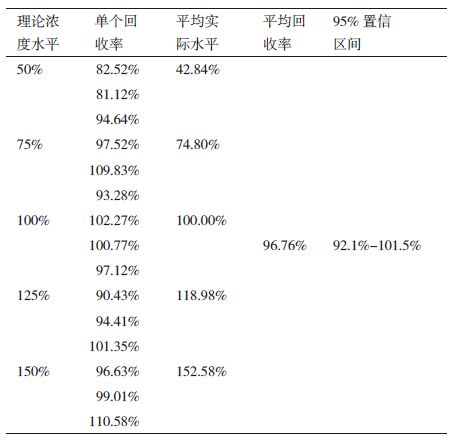
如表 3所示,实际水平即测定的相对活性,理论水平即配制浓度的相对比例。将5个实际水平平均值对理论水平做直线拟合,该方法在50%-150%之间呈现良好的线性关系。线性拟合方程为y=1.054 6x-0.076 2,R2=0.992 5。
将各浓度水平50%、75%、100%、125%和150%平行测定3条曲线,根据吸光度均值和对应浓度进行四参数拟合得到生物活性的实验测得值、理论值并计算回收率。单个回收率在81%-110%之间,而15个检测结果的平均回收率为96.76%。所有结果的95%置信区间在92%-101%。
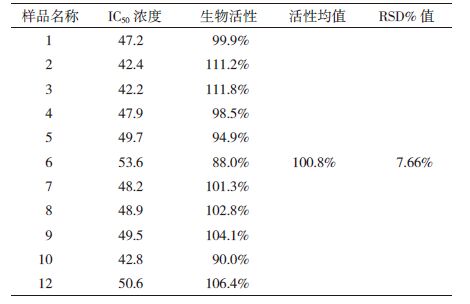
2.4.4 抗体活性检测方法精密度检测平行配制6份抗TNF-α抗体溶液,按抗体活性检测方法测吸光度值并计算IC50值,得出生物活性(表 4)。结果表明,6次平行的RSD%为9.25%。另一实验员同样方法另行配制检测6份抗体溶液,得出生物活性,12份的RSD为7.66%。
该实验方法在国内外关于HUVEC细胞表面粘附分子研究的基础上,利用抗TNF-a抗体可以抑制TNF-a刺激HUVEC细胞表达ELAM-1来检测抗体的生物学活性。该方法的建立基于Thorne等首次阐明细胞因子(TNF-a和IL-1β)增加单核细胞-冠状动脉平滑肌细胞黏附是通过ELAM-1、VCAM-1和ICAM-1机制。抗TNF-α药物抑制介导内皮细胞表面粘附分子的表达是控制细胞在血管壁积聚的关键调控点[5, 10]。相比常规的细胞毒性实验,该法结合了酶联免疫的高度灵敏性及准确性特点,为实验提供了更准确的结果。
人脐静脉内皮细胞HUVEC经TNF-α处理后,细胞表面ELAM-1的表达有明显增高,且细胞在孵育5 h时ELAM-1表达量达到稳定。实验中还发现细胞在正常生长条件下也会表达该黏附分子,只是量比较少,这一发现也与文献报道相符。对于细胞表达ELAM-1因子的检测,采用Elisa法,本实验一抗的选择在于保证实验结果准确性,信噪比更高的情况下方法更稳定,故以1:1 500稀释一抗。实验中二抗则以1:4 000稀释比例得到最佳的剂量曲线。
在专属性实验中,抗体经高温破坏,活性明显降低。猜测与抗体在高温下迅速聚合有关,经SEC(分子排阻色谱柱)分析实验发现,经70℃处理超过5 min或更长时间时,抗体多聚体含量显著提高,这与推测相符。由此说明,多聚体的产生对生物抗体药物的活性会有明显的影响。在方法准确度及线性实验的验证中,我们发现抗体浓度为50%时,单个点的回收率低于平均回收率,这可能与该法的缺陷有关,当抗体活性接近50%,即到达线性的最低点时,结果呈现不稳定性。由ELAM-1因子的表达检测抗体活性,我们尝试以一定浓度TNF-α作用细胞,发现黏附分子ICAM-1、VCAM-1均有一定量的表达,而且,它们在孵育相同时间时,各自的表达量有一定的差别,据此方法条件摸索出各因子最佳表达时间,并对其分别检测即可达到检测抗体活性的更多方法。
4 结论本实验室通过建立细胞-酶联免疫法检测抗TNF-a抗体的活性,克服了常规单一方法检测活性的局限性,开拓了该类抗体体外活性检测的新思路。通过对该法进行完整的验证,表明该法检测抗体活性具有一定的科学性、准确性更能反映抗体活性的真实性。此外,该方法的建立也为通过其他两个因子(ICAM-1和VCAM-1)检测抗体活性提供了思路,可以依此建立更全面反映药物体外活性的检测手段,保证药物研发生产中更好地控制产品质量。
| [1] | Spriggs DR, Zaheer T, Zhong W, et al. Tumor necrosis factor and interleukin6 mRNA expression in neonatal Lewvis rat Schwann cells[J]. Marcel Dekker Ink, 1991, 72(1):33-34. |
| [2] | Meldrum DR. Tumor necrosis factor in the heart[J]. Am J Physiol, 1998, 274(3 Pt2):R577-R595. |
| [3] | Cheng B, Hyeju N, Jaehoo L, et al. Daidzein suppresses tumor necrosis factor-α induced migration and invasion by inhibiting hedgehog/glil signaling in human breast cancer cells[J]. J Agric Food Chem, 2014, 62(17):3759-3767. |
| [4] | Wen T, Wang Z, Meng X, et al. Synthesis of novel tylophorine derivatives and evaluation of their anti-inflammatory activity[J]ACS Med Chem Lett, 2014, 5(9):1027-1031. |
| [5] | Winn R, Vedder N, Ramamoorthy C, et al. Endothelial and leukocyte adhesion molecules in inflammation and disease[J]. Blood Coagulation and Fibrinolysis, 1998, 9(2):S17-S22. |
| [6] | Tracey D, Klareskog L, Sasso EH, et al. Tumor necrosis factor antagonist mechanisms of action:a comprehensive review[J]. Pharmacol Ther, 2008, 117:244-279. |
| [7] | Muler WA, Randolph GJ. Migration of leukocytes across endothelium and beyond:Molecules involved in the transmigiration and fate of monocytes[J]. J Leukoc Biol, 1999, 66:698-704. |
| [8] | Dwivedi RC, Dhindsa N, Krokhin OV. The effects of infliximab therapy on the serum proteome of rheumatoid arthritis patients[J]. Arthritis Res Ther, 2009, 11(2):R32. 1186-2637. |
| [9] | Thorne SA, Abbot SE, Stevens CR, et al. Modified low density lipoprotein and cytokines mediate monocyte adhesion to smooth muscle cells[J]. Atherosclerosis, 1997, 127(2):167-176. |
| [10] | Fotis L, Agrogiannis G, Vlachos IS, et al. Intercellular adhesion molecule(ICAM)-1 and vascular cell adhesion molecule(VC-AM)-1 at the early stages of atherosclerosis in a rat model[J]. In Vivo, 2012, 26(2):243-250. |