腺相关病毒(Adeno-associated virus,AAV)为复制缺陷型病毒,属细小病毒家族,至今还没有发现与人类的任何疾病相关,其能定点整合到人类基因组19号染色体上[1]。另外,AAV还有免疫原性弱、宿主范围广、理化性质稳定、长期表达外源基因等优点[2, 3, 4],因此AAV被认为是介导基因治疗的理想载体之一。重组腺相关病毒载体(rAAV)源于非致病的野生型AAV,在医学研究中,rAAV被用于多种疾病的基因治疗的研究(包括体内、体外);同时作为一种有特点的基因转移载体,还广泛用于基因功能研究、构建疾病模型、制备基因敲除鼠等方面。目前有关以rAAV为载体的基因治疗临床研究报道已经超过90多项[4]。
作为基因载体,rAAV进一步从实验室走向临床应用的一个关键性问题是如何规模化制备经济、安全、质量可控的rAAV载体,文章旨在介绍几种新型规模化生产rAAV的方法,探讨基因治疗中rAAV载体规模化制备的发展趋势。
1 rAAV制备的两个重要过程 1.1 rAAV衣壳蛋白的装配 1.1.1 rAAV的包装原件AAV基因组为约4.7 kb的单链DNA,两个末端是倒转重复序列(ITR),是AAV整合、复制、拯救和包装所必须的顺式作用元件,并具转录启动子活性。ITR序列之间包含两个开放阅读框,称为Rep和Cap,分别编码4个Rep蛋白(Rep78、Rep68、Rep52和Rep40)和3个Cap蛋白(VP1、VP2和VP3)以及1个最近几年才发现的装配激活蛋白(AAP)(图 1)[5, 6],这几种蛋白均在rAAV的包装过程中扮演极其重要的角色。其中Rep78和Rep68的转录由p5启动子控制,Rep52和Rep40由p19启动子起始转录,p40启动子调节Cap蛋白VP1、VP2和VP3的转录[7]。
|
| 图 1 AAV 基因组结构 |
研究称在细胞内,rAAV病毒样粒子的装配只需Cap基因表达即可完成,且装配在细胞核内进行[8]。传统观点认为,Cap基因只编码VP1、VP2和VP3三种蛋白,但是病毒样粒子的形成究竟是需要三种蛋白、两种蛋白还是一种蛋白,一直存在争论。VP1和VP2主要定位于细胞核内,而单体的VP3在核内和细胞质内均有分布,表明VP1、VP2和VP3在装配过程中具有不同的行为。VP1和VP2上都具有核定位信号(166PARKRLNF173),可能起到运送VP3进入细胞核的作用[9]。因为衣壳表面全部由VP3序列(包括VP3、VP1和VP2的C末端)组成,VP1和VP2的N末端位于衣壳的内部,因此争论的焦点主要是VP3单独能否组装出rAAV病毒样粒子。
最初Ruffing等[10]在HeLa细胞中利用质粒单独表达VP3并不能形成rAAV病毒样粒子,但如果将VP3与VP1或VP2共表达,则可见rAAV病毒样粒子形成;利用杆状病毒载体在昆虫细胞系sf9表达VPs的研究表明,VP3单独表达也不能形成rAAV病毒样粒子。然而Warrington等[11]发现,在293细胞中单独表达VP3能产生rAAV病毒样粒子。针对这一貌似矛盾的结论,Sonntag等[5]展开研究,发现Cap基因还编码另外一种蛋白AAP,其编码框介于VP2和VP3之间。该研究显示,VP3单独不能形成rAAV病毒样粒子,但是如果与表达AAP的质粒共转染,则能形成rAAV病毒样粒子[11]。在Ruffing的研究中,VP3表达质粒只包含VP3序列本身,不能表达AAP,正是这一质粒构建上的差别导致其与Warrington实验结果不一致。AAP主要定位于细胞核内,协助VPs蛋白从细胞质进入细胞核,起到病毒装配的支架作用,还可能协助VPs进行正确折叠。
1.1.3 其他因素在rAAV病毒样粒子装配中的作用除了AAP之外,在细胞核内,可能还有其他因子协助完成rAAV衣壳的装配,包括Rep蛋白、核仁磷蛋白等。
rAAV病毒样粒子在细胞核内装配时,衣壳蛋白分子并非独立存在,而是与Rep蛋白发生交联。在rAAV制备过程中,这一交联比较容易受到破坏,故在目前制备的rAAV中检测不到Rep蛋白,但是这并不能否认Rep蛋白在rAAV病毒样粒子形成中的作用[12]。
rAAV感染后完整衣壳最初呈现于核仁中,随后遍及整个细胞核,表明核仁的某些成分在衣壳蛋白装配过程中起到重要作用。研究发现,利用siRNA干扰核仁磷蛋白,rAAV载体的基因表达效率可以提高5-15倍,表明核仁磷蛋白确实与rAAV在核内的行为存在联系[13]。另有研究表明,核仁磷蛋白可与衣壳之间存在直接的连接,而且核仁磷蛋白还具有与Rep结合的能力[14]。
除了某些蛋白成分可能影响衣壳装配外,细胞本身的环境因素也可能对rAAV病毒样粒子的装配起到至关重要的作用,如ATP、温度等。
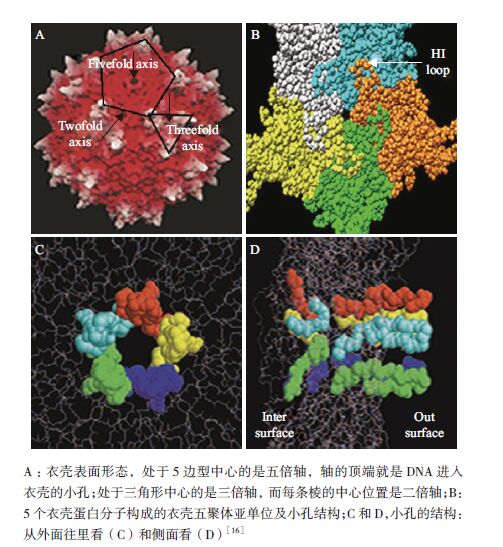
1.2 DNA的衣壳化rAAV衣壳蛋白的装配和DNA的衣壳化是rAAV包装过程中两个最为重要的过程。这两个过程目前有了总体上的认识,虽然许多细节还无法知晓,尤其是基因组进入衣壳的过程还知之甚少。现有的rAAV包装机制模型达成了以下基本共识:先是Rep蛋白连接单链DNA(ssDNA)的ITR以及Cap蛋白,将ssDNA定位于衣壳表面,接下来ssDNA借助于Rep蛋白的螺旋酶活性和ATPase活性,以3'-5'为方向,在衣壳五倍轴的顶端小孔进入衣壳。其中,ssDNA导入已经形成的病毒衣壳的具体机制还未研究清楚[15](图 2)。
|
| 图 2 AAV 衣壳以及五倍轴小孔的结构 |
从rAAV被用作基因载体开始,研究者就在尝试各种高效制备rAAV的方法,以达到方便、灵活、规模化制备能满足科研研究和临床所需rAAV的目的。目前应用最广的是三质粒共转染HEK293细胞法获得rAAV。三质粒转染法即将一个提供外源基因和ITR的质粒、一个提供rAAV辅助功能的质粒、一个提供腺病毒辅助功能的质粒共转染宿主HEK293细胞。三质粒转染法最大的优点是不用加辅助病毒,排除了辅助病毒对rAAV的污染,方便制备各种血清型的rAAV,使制备和纯化步骤大为简化,制备的rAAV基本可以满足实验室研究所用。
3 rAAV的新型包装系统 3.1 利用杆状病毒昆虫细胞系sf9来表达rAAV近些年来,杆状病毒昆虫表达系统在蛋白质表达和病毒制备等方面发挥重要的作用,特别是Bac-to-Bac系统大大简化了杆状病毒的制备过程。陈雅宁等[17]设想利用杆状病毒昆虫表达系统制备rAAV,克服传统方法中的诸多限制因素,满足临床级别rAAV的要求。将rAAV的ITR及目的基因表达框从pAAV-MCS剪切引入杆状病毒载体中构建顺式载体,rAAV的衣壳和复制蛋白基因在反式pFastBacDual中利用真核基因遗漏扫描原理表达,两者分别制备成杆状病毒,共感染昆虫细胞sf9来完成rAAV拯救、复制和包装过程。病毒滴度可达1×108-3×108 VG/mL。增强绿色荧光蛋白(EGFP)作为报告基因验证其可行性,将生产的rAAV-EGFP感染293T细胞测试得知其具有良好的生物学活性,该系统具有高效、安全、简便等特点,为临床级rAAV制备和基因治疗奠定了基础。
另外,Urabe等[18]建立的昆虫杆状病毒系统,避免了质粒转染人类细胞效率低的问题,这种方法需要3种杆状病毒,rBac-Rep、rBac-Cap、rBac-ITR-GFP-ITR分别提供Rep、Cap、ITR和目的基因,先在sf9细胞中扩增3种杆状病毒,然后将纯化的杆状病毒共感染悬浮培养的sf9细胞,就可以大规模制备rAAV。病毒感染法无需瞬时转染,也不需要建立稳定转染的细胞系,所有元件都由病毒提供。此法优点主要有:杆状病毒感染细胞后产生的子代病毒可以继续感染细胞,大大提高了制备效率;可以在制备过程中对各种参数进行监测和控制;避免了瞬时转染贴壁细胞这一限制性步骤;容易大规模培养;制备成本低[19]。但杆状病毒缺乏遗传学和物理学稳定性是此系统目前面临的最大挑战。
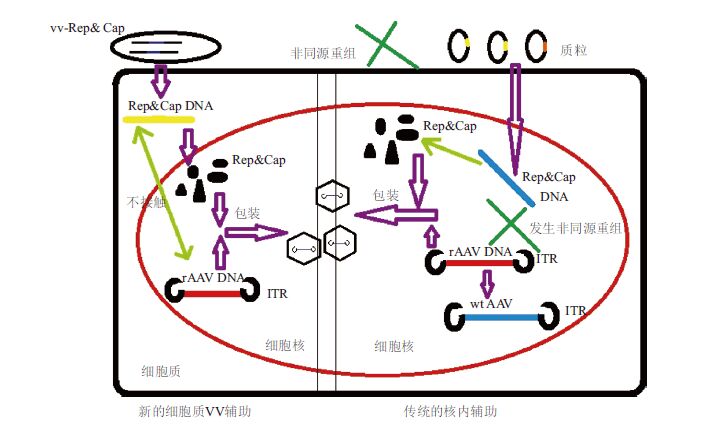
3.2 利用痘苗病毒规模化和安全化制备rAAV载体尽管最近几年以rAAV为载体基因治疗的临床研究比较成功,但是大规模化和高效的生产高质量的rAAV依然面临不少难题。Dong等[20]采用能在细胞质完成生命周期的痘苗病毒(VV)作为rAAV辅助元件Rep-Cap的表达载体,以腺病毒-腺相关病毒(Ad-AAV)杂合载体作为rAAV载体基因组和辅助病毒基因组的提供者。这样就使rAAV辅助基因位于细胞质内,而rAAV DNA能够整合到宿主的细胞核中,它们便处于两个不同的亚细胞部位,从空间上避免了普遍存在的非同源重组的发生,使得野生型有复制能力AAV(rcAAV)的污染得以首次彻底消除(图 3)。在悬浮的HeLa细胞中,每个细胞获得的rAAV载体产量接近于传统的三质粒共转染所得。由于当今分析条件的限制,很难有效发现rcAAV的污染,这种新的方法有效的解决了这一难题,无疑为rAAV载体介导的基因治疗带来了福音。新的rAAV载体制备系统不但可以应用于rAAV的生产,同样也适用于其它DNA载体的生产,至此使得大规模和有效地rAAV生产得以实现[20]。
因为AAV是缺陷型的单链DNA病毒,AAV的DNA的复制和包装发生于宿主细胞的核中,故现行的rAAV生产方法都需要rAAV辅助基因在宿主核中转录[5]。鉴于rAAV载体基因组在宿主细胞核大量的扩增,而且与辅助基因组邻近,rAAV的Rep和Cap基因以及ITRs不可避免地发生非同源重组,从而导致rcAAV的形成。在以rAAV为载体的基因治疗中,rcAAV有可能阻止转基因的高效表达,对病人造成伤害[21, 22]。
研究和临床试验中最主要的生产rAAV载体的方法就是三质粒共转染法[23],但是该法的成本和实验条件要求都比较高,在临床中很难得以广泛的应用。这一新的生产rAAV的方法,利用VV的200 kb基因组复制可在宿主的细胞质中进行,不需要进入核中[24],得以使此病毒携带生产rAAV所需的所有辅助基因。这个方法不但提高了rAAV的产量,也避免了非同源重组的发生,这样也就阻止了rcAAV的干扰。
由于避免了rcAAV的干扰,这个新的重组方法没有潜在的病毒蛋白的生成,就不会使基因治疗中的转基因治疗过程复杂化,也不会对人体有害。没有rcAAV形式的DNA干扰,也有可能对人类的基因治疗造成新的威胁[25],但是此问题现在还没有研究清楚。隔离辅助基因于细胞质,可以阻止其与核内的复制的载体基因组共定位,同样也会减少干扰,这又是此新方法的一个潜在优势。而且组装rAAV载体所需元件全由病毒提供,不但可以感染悬浮细胞,也可以模拟野生型AAV的复制和包装机制,从而高效、高质量的制备rAAV载体,为解决rAAV的规模化生产和低免疫毒性提供了可能。
新制备系统的每个细胞的载体产量相当于传统的转染方法的最佳产量,表明细胞质中VV的帮助不会影响rAAV的复制和包装。利用GFP作为报告基因可知:此法生产的载体与传统方法相比,在体内效率一样高效。独特的排除rcAAV干扰和能大规模生产使得这一新方案将替代传统的三质粒共转染法,成为rAAV载体高效生产的首选。此外,此法灵活性很强:当需要生产其他血清型的rAAV亚型时,仅仅只需要替换确定亚型的vv-VP1和vv-VP2序列,这样就可形成所需rAAV亚型的衣壳蛋白。VV也不是rAAV生产中最有效的辅助病毒,将腺病毒辅助基因整合到VV基因组中,能使生产更高效。腺病毒-痘苗病毒杂交体既有生长周期短,感染高效以及精准起始基因复制,同时也能使rAAV载体生长在许多哺乳细胞的悬浮液中,不仅仅是HEK293。总之,VV辅助的这一新方法加以有效利用,能够保证人类临床试验所需的rAAV基因载体的质量和产量,对基因治疗临床事业的发展将有巨大的贡献[20]。
3.3 利用酵母系统包装AAV衣壳,为生产重组腺相关病毒提供了新思路酿酒酵母的发育过程中支持许多不同的RNA或DNA病毒的复制,为病毒样粒子的形成提供了一种大规模、节约成本和提高时效的方法,例如,Human Parvovirus B19。Backovic等[7]近期研究表明单链的AAV2基因组能在酿酒酵母RSY12中从环状质粒起始AAV的包装。此研究报道也证实了酵母系统中包装AAV衣壳的可行性。
在酿酒酵母中进行AAV病毒样粒子的包装,至少需要AAV三个结构蛋白中的VP1和VP3参与。通过共转染两个质粒到酵母细胞而实施:YEplacRepCap质粒由p40启动子来起始VP3的表达,另外由诱导酵母启动子Gal1起始修饰的AAV2 Cap基因pYESVP1KM质粒来表达VP1蛋白。最好的方案是在含0.5%葡萄糖和5%半乳糖的培养基诱导后4.5 h得到最佳的VP1:VP3的比例。通过两步超速离心,就能从酵母中分离出AAV病毒样粒子。在CsCl密度梯度离心后,衣壳样粒子位于f8-f11部分,密度为1.386-1.394 g/cm3,有与野生型AAV2衣壳相似的衣壳蛋白。透射电子显微镜分析可知:由酵母获得的AAV病毒样粒子与人类细胞产生的空衣壳形态上相似。Backovic[7]的研究第一次表明酵母系统也能用来包装AAV衣壳,为rAAV的生产提供了新的思路,对以rAAV为载体的基因治疗临床试验意义重大。
4 展望虽然在过去的十几年中,提出了一些比较好的大规模生产rAAV载体的方法[26, 27, 28],但由于各种各样的不足始终无法得以推广。例如:杆状病毒生产系统解决了转染问题,但在昆虫细胞中生产rAAV会使得感染力下降[16, 29, 30]。细胞法生产rAAV不稳定[31],同时需要大量筛选实现最高效。所有的载体生产系统都必须考虑辅助病毒的稳定性和安全性,现今发现的新方案,VV辅助病毒稳定且生产效率高,不会被AAV Rep和Cap基因产物所抑制,这点腺病毒无法做到。本课题组之前也设计构建了一种新型的、细胞特异性的、内含多个组织特异如肝特异和造血特异序列拷贝的microRNA结合序列的基因片段,通过控制包装蛋白基因片段表达,进而清除腺相关病毒包装蛋白污染诱发的rAAV载体介导的免疫反应,从而保证基因治疗取得成功[32]。
随着rAAV在基因治疗中存在的问题被逐渐解决,如使用杂合的rAAV载体、对rAAV的外壳进行修饰等方法降低其免疫原性和提高转导效率[33, 34];使用双链rAAV基因组提高转导效率[35]等,rAAV作为一种高效、安全性的转基因载体在人类基因治疗中的优势会越发明显。随着rAAV规模化生产工艺不断成熟,rAAV在基因治疗上的诸多优点都表明rAAV在临床上的广泛应用将成为基因治疗领域不可阻挡的趋势[3]。在现今的研究基础之上,还需要去解决面临的新问题,从而有助于rAAV载体介导的基因治疗临床事业的迅速发展。
| [1] | Hüser D, Gogol-Döring A, Lutter T, et al. Integration preferences of wildtype AAV-2 for consensus rep-binding sites at numerous loci in the human genome[J]. PLoS Pathogens, 2010, 6:e1000985. |
| [2] | van der Laan LJ, Wang Y, Tilanus HW, et al. AAV-mediated gene therapy for liver diseases:the prime candidate for clinical application?[J]. Expert Opinion on Biological Therapy, 2011, 11:315-327. |
| [3] | 许瑞安, 肖卫东. 分子基因药物学[M]. 北京:北京大学医学出版社, 2008. |
| [4] | 王启钊, 吕颖慧, 肖卫东, 等. 重组腺相关病毒载体临床实验研究[J]. 中国生物工程杂志, 2010, 30:73-79. |
| [5] | Sonntag F, Schmidt K, Kleinschmidt JA. A viral assembly factor promotes AAV2 capsid formation in the nucleolus[J]. Proceedings of the National Academy of Sciences, 2010, 107:10220-10225. |
| [6] | Sonntag F, Köther K, Schmidt K, et al. The assembly-activating protein promotes capsid assembly of different adeno-associated virus serotypes[J]. Journal of Virology, 2011, 85:12686-12697. |
| [7] | Backovic A, Cervelli T, Salvetti A, et al. Capsid protein expression and adeno-associated virus like particles assembly in Saccharomyces cerevisiae[J]. Microbial Cell Factories, 2012, 11:124. |
| [8] | Wistuba A, Kern A, Weger S, et al. Subcellular compartmentalization of adeno-associated virus type 2 assembly[J]. Journal of Virology, 1997, 71:1341-1352. |
| [9] | Hoque M, Ishizu KI, Matsumoto A, et al. Nuclear transport of the major capsid protein is essential for adeno-associated virus capsid formation[J]. Journal of Virology, 1999, 73:7912-7915. |
| [10] | Ruffing M, Zentgraf H, Kleinschmidt J. Assembly of viruslike particles by recombinant structural proteins of adeno-associated virus type 2 in insect cells[J]. Journal of Virology, 1992, 66:6922-6930. |
| [11] | Warrington KH, Gorbatyuk OS, Harrison JK, et al. Adeno-associated virus type 2 VP2 capsid protein is nonessential and can tolerate large peptide insertions at its N terminus[J]. Journal of Virology, 2004, 78:6595-6609. |
| [12] | Bleker S, Pawlita M, Kleinschmidt JA. Impact of capsid conformation and Rep-capsid interactions on adeno-associated virus type 2 genome packaging[J]. Journal of Virology, 2006, 80:810-820. |
| [13] | Johnson JS, Samulski RJ. Enhancement of adeno-associated virus infection by mobilizing capsids into and out of the nucleolus[J]. Journal of Virology, 2009, 83:2632-2644. |
| [14] | Bevington JM, Needham PG, Verrill KC, et al. Adeno-associated virus interactions with B23/Nucleophosmin:identification of sub-nucleolar virion regions[J]. Virology, 2007, 357:102-113. |
| [15] | DiPrimio N, Asokan A, Govindasamy L, et al. Surface loop dynamics in adeno-associated virus capsid assembly[J]. Journal of Virology, 2008, 82:5178-5189. |
| [16] | Bleker S, Sonntag F, Kleinschmidt JA. Mutational analysis of narrow pores at the fivefold symmetry axes of adeno-associated virus type 2 capsids reveals a dual role in genome packaging and activation of phospholipase A2 activity[J]. J Virol, 2005, 79(4):2528-2540. |
| [17] | 陈雅宁, 王春荣, 杨宗灿, 等. Bac-to-Bac杆状病毒昆虫表达系统介导的重组腺相关病毒制备[J]. 中华实验外科杂志, 2012, 29:1363-1366. |
| [18] | Urabe M, Ding C, Kotin RM. Insect cells as a factory to produce adeno-associated virus type 2 vectors[J]. Human Gene Therapy, 2002, 13:1935-1943. |
| [19] | 王峰, 刁勇, 肖卫东, 等. 重组腺相关病毒规模化生物包装技术[J]. 生物工程学报, 2009, 25:1608-1613. |
| [20] | Dong B, Moore AR, Dai J, et al. A concept of eliminating nonhomologous recombination for scalable and safe AAV vector generation for human gene therapy[J]. Nucleic Acids Research, 2013, 41:6609-6617. |
| [21] | Mingozzi F, Maus MV, Hui DJ, et al. CD8+ T-cell responses to adeno-associated virus capsid in humans[J]. Nature Medicine, 2007, 13:419-422. |
| [22] | Pien GC, Basner-Tschakarjan E, Hui DJ, et al. Capsid antigen presentation flags human hepatocytes for destruction after transduction by adeno-associated viral vectors[J]. The Journal of Clinical Investigation, 2009, 119:1688-1695. |
| [23] | Allay JA, Sleep S, Long S, et al. Good manufacturing practice production of self-complementary serotype 8 adeno-associated viral vector for a hemophilia B clinical trial[J]. Human Gene Therapy, 2011, 22:595-604. |
| [24] | Moss B, Earl PL. Overview of the vaccinia virus expression system[J]. Current Protocols in Protein Science, 1998, 16.15.1-16.15.5. |
| [25] | Halbert CL, Metzger MJ, Lam SL, et al. Capsid-expressing DNA in AAV vectors and its elimination by use of an oversize capsid gene for vector production[J]. Gene Therapy, 2011, 18:411-417. |
| [26] | Qiao C, Li J, Skold A, et al. Feasibility of generating adeno-associated virus packaging cell lines containing inducible adenovirus helper genes[J]. Journal of Virology, 2002, 76:1904-1913. |
| [27] | Smith RH, Levy JR, Kotin RM. A simplified baculovirus-AAV expression vector system coupled with one-step affinity purification yields high-titer rAAV stocks from insect cells[J]. Molecular Therapy, 2009, 17:1888-1896. |
| [28] | Wright J, Qu G, Tang C, et al. Recombinant adeno-associated virus:formulation challenges and strategies for a gene therapy vector[J]. Current Opinion in Drug Discovery & Development, 2003, 6:174-178. |
| [29] | Lock M, Alvira M, Vandenberghe LH, et al. Rapid, simple, and versatile manufacturing of recombinant adeno-associated viral vectors at scale[J]. Human Gene Therapy, 2010, 21:1259-1271. |
| [30] | Clément N, Knop DR, Byrne BJ. Large-scale adeno-associated viral vector production using a herpesvirus-based system enables manufacturing for clinical studies[J]. Human Gene Therapy, 2009, 20:796-806. |
| [31] | Qiao C, Wang B, Zhu X, et al. A novel gene expression control system and its use in stable, high-titer 293 cell-based adeno-associated virus packaging cell lines[J]. Journal of Virology, 2002, 76:13015-13027. |
| [32] | Lu H, Qu G, Yang X, et al. Systemic elimination of de novo capsid protein synthesis from replication-competent AAV contamination in the liver[J]. Human Gene Therapy, 2011, 22:625-632. |
| [33] | Zaiss A, Muruve D. Immunity to adeno-associated virus vectors in animals and humans:a continued challenge[J]. Gene Therapy, 2008, 15:808-816. |
| [34] | Farris KD, Pintel DJ. Improved splicing of adeno-associated viral(AAV)capsid protein-supplying pre-mRNAs leads to increased recombinant AAV vector production[J]. Human Gene Therapy, 2008, 19:1421-1427. |
| [35] | Wang J, Xie J, Lu H, et al. Existence of transient functional double-stranded DNA intermediates during recombinant AAV transduction[J]. Proceedings of the National Academy of Sciences, 2007, 104:13104-13109. |