2.中国科学院青岛生物能源与过程研究所 青岛市单细胞油脂工程实验室,青岛 266101
2. Qingdao Engineering Laboratory of Single Cell Oil,Qingdao Institute of Bioenergy and Bioprocess Technology,Chinese Academy of Sciences,Qingdao 26601
脂肪酸(Fatty acid)是由一条长的烃链和一个末端羧基组成的羧酸,是生物体的重要储能物质和细胞组分,根据烃链上双键的有无,分为饱和脂肪酸和不饱和脂肪酸。人体过量摄取饱和脂肪酸,容易导致心脑血管疾病。而某些不饱和脂肪酸具有保护血管、预防心血管疾病和糖尿病、促进婴儿脑部发育等保健功效,如多不饱和脂肪酸二十碳五烯酸(Eicosapentaenoic acid,EPA,C20:5)和二十二碳六烯酸(Docosahexaenoic acid,DHA,C22:6),这一类属于超长链多不饱和脂肪酸,这方面的综述已经较为全面[1]。在不饱和脂肪酸中,超长链单不饱和脂肪酸(Very long chain monounsaturated fatty acid,VLCMFA)是主链碳原子数≥20并且只有一个不饱和键的类别,目前发现的有鳕油酸(Eicosenoic acid,C20:1△11c)、芥酸(Erucic acid,C22:1△13c)、神经酸(Nervonic acid,C24:1△15c)和西门木烯酸(Ximenic acid,C26:1△17c)(图 1)。与多不饱和脂肪酸相比,虽然VLCMFA受到的关注较少,但是这类不饱和脂肪酸具有独特的药效、保健功效和工业用途。本文主要综述VLCMFA的生物合成和代谢工程进展,以期为其应用研发提供参考。

|
| 图 1 超长链单不饱和脂肪酸的分子结构 |
在超长链不饱和脂肪酸中,芥酸(22:1△13c)和神经酸(24:1△15c)与人类健康和生活关系密切(表 1)。芥酸在十字花科植物种子有丰富积累,其中在油菜籽油中芥酸的含量能够占到总油量的30%-60%,旱金莲属(Tropaeolum)植物中,芥酸的含量甚至能达到80%。这种大量的脂肪酸已经证实对一些哺乳动物的心血管会造成较为严重的损害[2, 3]。虽然现在仍然没有直接证据证明芥酸对人体的极大害处,但据推测因为芥酸不能够被人体有效的代谢,可使肾、肝等中毒,造成结缔组织出现裂缝,冠状血管纤维化。世界卫生组织(WHO)规定作为食用菜油的芥酸含量必须低于5%,2003年,澳大利亚食品标准设定人体每天摄入的芥酸的上限是500 mg/d[4]。
虽然摄取一定量芥酸存在健康风险,但芥酸在工业生产中具有重要用途,它是一种重要化工原料,通常用于制备人造纤维、聚酯类纺织助剂、PVC稳定剂、油漆干性剂、表面涂料树脂,以及加工山萮酸、芥酸酰胺等。芥酸及其甘油酯可应用于食品工业或化妆品制造业,还可用于生产表面活性剂(洗涤剂)。鉴于在食用和工业上的不同要求,芥酸基因工程改造有两个不同的方向——对于用于食用植物油的作物的改造方向是降低芥酸含量,而用于工业品应用的作物的改造方向是提高芥酸含量。
神经酸是另一种重要的单不饱和脂肪酸。1927年由Tsujimoto等在软骨鱼(Elasmobranch fishe)的脂肪中发现。碎米芥(Cardamine hirsuta L.)、遏蓝菜(Thlaspi caerulescens)、蒜头果(Malania oleif-era)、元宝枫(Acer truncatum Bunge)等植物和微藻(Mychonastes afer)中神经酸含量较高[5]。对于神经酸的研究由来已久,早在20世纪,英国神经学教授Sinclar等研究发现,鲨鱼脑组织在受到重创后的短时期内能够自行修复,该现象被证明是因为鲨鱼脑组织中的神经酸在修复大脑神经信息传递通道——神经纤维上发挥作用,这一发现随即引起世界多国科学家的高度重视[6]。Yumazaki等[7]在对日本40岁男性进行大量调查后发现,神经酸在血浆中的含量比例与血液磷脂水平和代谢综合症有十分密切的联系。
神经酸是大脑神经纤维和神经细胞的核心天然成分。随着年龄的增长,身体中的神经酸缺乏将会引起脑中风后遗症、老年痴呆、脑瘫、脑萎缩、记忆力减退及失眠健忘等脑疾病[8]。因此,近年来神经酸受到制药、营养等行业的关注。在国内,对于神经酸的保健功能开发还有待提升。另外,日本等国科学家研究证明,神经酸对艾滋病逆转录酶有很强的抑制作用[9]。这一研究成果为帮助寻找抗艾滋病的有效药物开辟了一条新的途径,展示了VLCMFA广阔的应用前景。
2 超长链单不饱和脂肪酸的生物合成途径脂肪酸生物合成途径是生物体基础的新陈代谢途径之一。其中,VLCMFA的生物合成是很重要的一个分支。“超长链”和“单不饱和”是VLCMFA具有的两个性质,这也决定了它们的合成过程有别于超长链饱和脂肪酸。以植物VLCMFA的合成为例,从时间和逻辑上可以分为3个阶段:(1)脂肪酸链的基本合成(在质体基质进行);(2)油酸的形成(发生在内质网);(3)单不饱和脂肪酸链的延长(发生在内质网)。
形成单不饱和脂肪酸的前提是C18链的脂酰胺链(主碳链)的从头合成。在动物和酵母中,该反应主要在细胞质中完成,而植物细胞脂肪酸合成主要发生在质体的基质当中[14],由脂肪酸合酶复合体催化,脂肪酸合酶复合体(Fatty acid synthase complex,FAS)包含有7种酶活性和一个酰基载体蛋白(ACP)。植物在质体中合成的脂肪酸要通过转运机制将其运输到细胞的其他部位。乙酰-CoA是脂肪酸生物合成的前体,在脂酰链的延伸过程中,首先由ACP转移酶催化下实现将乙酰-CoA的乙酰基转移到ACP上,形成乙酰-ACP。随后,在丙二酸单酰-CoA-ACP转酰酶的催化下,合成丙二酸单酰-ACP。有了这两个底物之后,在可溶性的脂肪酸合成酶复合体的作用下进行(图 2)4步循环反应[15]。调节脂肪酸合成的途径可以分成两类:脂肪酸的合成是由一个多功能蛋白质起催化作用的,称为I型合成;如果是由4个单独的单功能蛋白质催化合成,则称为II型合成。一般的植物脂肪酸合成是II型合成。一般植物的饱和脂肪酸的合成在C18以下时分为3个不同的阶段:C2-C4;C4-C16;C16-C18。之所以这样将其分成3个阶段,是由于催化这3个阶段的3-酮脂酰-ACP合酶(3-ketoacyl-ACP synthase,KCS)不同,分别为KCSI型、KCSII型和KCSIII型[16]。KCSIII负责将乙酰-CoA和甲酯酰-CoA缩合成为4碳单位;接着KCSI负责将4碳单位延长到C16;最后KCSII负责将C16延长到C18。

|
| 图 2 脂肪酸合成代谢途径 |
植物中大多数的脂肪酸为C16和C18脂肪酸。其中C18:1,C18:2,C18:3,C16:0,C18:0这5种脂肪酸几乎构成了植物膜上甘油酯类的90%。油酸合成发生在内质网,是通过脂肪酸去饱和酶(Fatty acid desaturatase)的催化,以硬脂酸(C18:0)为底物氧化形成的,此过程需要以O2为电子受体,NADPH为电子供体,通过定向酶促反应合成[17]。
VLCMFA的合成是以细胞溶液中的单不饱和脂肪酸(主链碳原子数小于C20)为底物,通过多酶复合体系进行脂肪酸链的延长而合成的[18]。在超长链脂肪酸延长的过程中,植物和酵母有很多相似之处。大量研究表明,超长链脂肪酸的延长与原始的合成是完全不同的两种方式[19]。在原始合成过程中,延长酶是利用丙二酰-CoA和乙酰-CoA作为底物[20],利用NADPH作为还原力[21]。而第三阶段的VLCMFA(>C20)的合成是以第一阶段的油酸为底物,通过超长链脂肪酸链延长循环(Very long chain fatty acid elongation cycle)进行碳链的延长,每次循环能够使原有脂肪酸的碳链延长两个碳原子,从而相继形成:鳕油酸(20:1△9c),芥酸(22:1△13c),神经酸(24:1△15c)。这个延长过程受4个酶形成的酶复合体的组合催化和调控,它们分别是(图 3):①3-酮酯酰-CoA合酶(3-ketoacyl-CoA synthase),②3-酮酯酰-CoA还原酶(3-ketoacyl-CoA reductase),③3-羟酯酰-CoA脱水酶(3-hydro-xyacyl-CoA dehydrase)和④羟酯酰-CoA还原酶(enoyl-CoA reductase)。最终形成比之前多两个C原子的脂肪酸链。
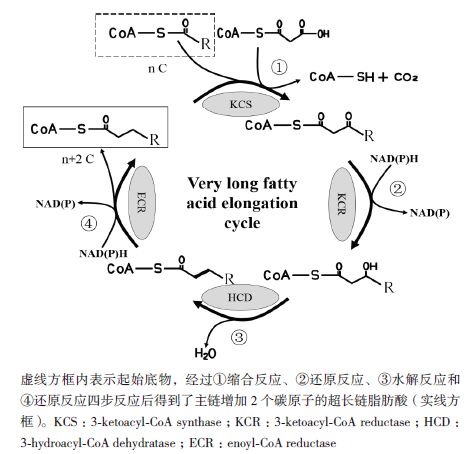
|
| 图 3 超长链脂肪酸的延长循环机制 |
参与VLCMFA延长循环反应主要包括4个酶复合体,都是膜蛋白,均在细胞的内质网(ER)[22, 23]。其中对3-酮脂酰-CoA合酶(3-ketoacyl-CoA synth-ase,KCS)和3-酮脂酰-CoA还原酶(3-ketoacyl-CoA reductase,KCR)的研究较为深入,目前被认为是关键催化步骤。
3.1 3-酮脂酰-CoA合酶3-酮脂酰-CoA合酶(KCS)属于转移酶(Transferase),在整个超长链脂肪酸延长酶复合体(Very long fatty acid elongase complex)中起到了极其重要的作用,是限速酶[12]。通常,KCS氨基酸序列有一个“组氨酸box”属于保守序列,N端存在两个膜结合位点[24]。在Vitis vinifera、C. graeca、L. annua等植物中都已经发现了KCS,并克隆了相关基因,进行了外源表达。拟南芥中的KCS基因与查尔酮合酶、葡萄芪合成酶以及酮乙酰-ACP合酶II都有一定的同源性[25]。Ketoacyl-ACP合成酶III、多肽合成酶和KCSs这3种酶被认为拥有同样的3步催化反应。
随着研究的深入,研究者们发现,在拟南芥中存在3种不同的KCS-like基因家族:FAE-like家族;ELO-like家族和 CER2-like家族。其中FAE是第一个被发现,并且只在种子中特异催化的缩合酶,在C20和C22脂肪酸的合成中起作用。另外,CER6也是FAE-like家族成员,被认为是C24脂肪酸合成所必须的KCS[26]。除了FAE和CER6之外,其他的FAE-like家族成员的功能尚不清楚。ELO-like家族由4个成员组成(AtELO1、AtELO2、AtELO3和AtELO4),其中,AtELO1、AtELO3和AtELO4特异的在叶片的内质网中表达,而AtELO2几乎在拟南芥所有组织器官中皆有表达[27]。AtELO4能够使敲除了ELO2和ELO3基因的酵母仍能生长,而且敲除了AtELO4基因的拟南芥,C26脂肪酸含量明显下降,C22和C24脂肪酸含量明显增加,说明AtELO4在C26脂肪酸的延长中起到了重要作用[28]。2013年,Pascal等[29]发现了CER2-like家族,能够参与拟南芥的大于C28脂肪酸的延长,但是根据序列的同源性,它应属于乙酰CoA依赖型的乙酰转移酶蛋白家族(BAHD),这与其在脂肪酸延长中表现出的活性完全不同。
KCS基因的表达调节与十字花科(Brassicaceae)植物产芥酸存在直接关联。2013年,Sun等[30]发现,FAE1基因的表达调节差异而不是序列变异导致了不同植物芥酸的产量不同。他们发现在高和低芥酸产量的十字花科植物中,FAE1基因保守的4个组氨酸残基和6个半胱氨酸的保守位点都存在,说明并非是保守位点的异同导致芥酸的高低。
3.2 3-酮脂酰-CoA还原酶3-酮脂酰-CoA还原酶(3-ketoacyl-CoA reduct-ase)催化3-酮脂酰-CoA还原成3-羟脂酰-CoA。
植物与酵母在脂肪酸合成方面存在不少相同点。在拟南芥中发现的3-酮脂酰-CoA还原酶1(KCR1)与酵母的YBR159有较高的同源性。虽然在拟南芥当中还有另外一个KCR2基因(与KCR1具有45%的相似性),但是酵母表达验证表明,只有KCR1在拟南芥的脂肪酸延长当中起作用[31, 32]。不过这种现象并不普遍,在玉米(Zea mays)中也存在两个KCR同源基因(GL8A和GL8B),其不仅相似性达到了97%,而且两者都在超长链脂肪酸的合成当中起作用[33]。虽然,KCS被认为是整个VLCMFA合成复合酶的限速酶,但是,Puyaubert等[34]的研究发现,KCR基因同FAE1的共表达(co-expression)在“高芥酸油菜籽”和“低芥酸油菜籽”中存在着明显的不同,说明KCR基因同KCS基因有着直接或者间接的联系。
4 芥酸和神经酸的代谢工程在油料作物的育种方面,降低芥酸在总油中的含量,可以提高食用油的质量。同时由于芥酸是很多工业产品的必不可少的原料,所以近些年关于芥酸的生物合成和生物工程改造也越来越多(表 2)。倘若植物种子芥酸的含量能够提高到总油脂的 90%,那么就可以直接用于化工产业中[35]。
Mietkiewska等[36]克隆得到T. majus的脂肪酸延长酶1(Fatty acid elongase 1,FAE1)发现,FAE1对于C20:1延长合成C22:1具有较高的酶学特异性。将FAE1基因分别导入到酵母、烟草和拟南芥中进行异源表达,使得拟南芥的芥酸产量提高了8倍,并发现C20:1所占比例明显的下降(18%下降到8%)。Rossak等[37]注意到,拟南芥中的FAE1基因的转录水平在其胚芽中最高,且在胚芽生长4 d后即开始表达,14 d后,FAE1的表达量达到最高值。据此,研究者们发现FAE1所特有的启动子在植物体外和体内的实验效果都比普通的napin启动子好,且FAE1的转录高峰期与油脂的积累在时间上十分吻合,从而给利用FAE1作为目的基因进行代谢工程改造的工作提供了很好的参考。
Jadhav等[38]的研究从另外一种思路提高芥酸含量:他们发现,在伊索比亚芥(B. carinata)中,芥酸合成的一个重要限制因素是C18:1的含量不足,而油酸去饱和酶,FAD2和FAD3是以C18:1为底物的脂肪酸脱饱和酶,使得C18:1发生氧化形成C18:2和C18:3,消耗超长链脂肪酸延长酶特异底物C18:1,导致芥酸的合成量较少。因此,他们利用共抑制法(Co-suppressed)和反义抑制法对于FAD2基因进行抑制,从而减少C18:1的去饱和,相应的C22:1所占比例也有了较为明显的提高(提高27%),同时总产油量也有提高(12%)。Li等在此基础上,结合Cao等[39]的研究得出溶血磷脂酸乙酰转移酶(Lysophosphatidic acid acyltransferase,LPAAT)在植物中的功能失活很可能是油料植物合成C22:1的又一个重要限制因素,(LPAAT能够将芥酸装配到三酰基甘油的sn-2位置,从而能够完成一次脂肪酸的延长)并进行了一系列的油料植物的基因工程。将LPAAT和BnFAE1(BnFAE1是来自B. napus的3-酮脂酰-CoA合酶,主要负责将C18:1延长形成C20:1[40])两个基因进行了过表达,并下调了FAD2基因,从而使得油料植物C. abyssinica的产芥酸量从野生型的28%提高到了73%[41]。
在确定C. abyssinica是一种理想的产芥酸植物之后,Li等[42]开发出一套高效的转化和检测方法,利用潮霉素(10 mg/L)作为筛选标记,并对Southern和qRT-PCR分析方法进行改进,更好的适合转化后C. abyssinica的分析。甘油二酯(Diacylglycerol,DAG)在甘油三酯(TAG)和膜结合脂类(Membrane lipids)起到了重要的分支点作用(Branch point)[43]。同位素标记技术已经证实在大豆的磷脂和甘油三酯合成过程中,DAG起到了不同的动力学作用[44]。据此,2014年,Guan等[45]发现DAG和PC(卵磷脂)之间较低的相互作用是C. abyssinica产芥酸的主要瓶颈。神经酸的化学合成自20世纪30年代就已实现,但这种方法得率低且难提纯,无法进行工业生产,因此亟待发掘更成熟和安全有效的方法。
虽然很多研究表明KCS基因对于底物没有很强的选择特异性,但是有研究发现,当KCS利用的底物为C22:1时,神经酸的产量比其他底物高数倍。例如,Guo等[12]的研究表明,将L. annua的KCS基因导入到拟南芥(富含C20:1)和B. carinaca(富含C22:1)之中,经过异源表达,B. carinaca所产神经酸量远高于拟南芥,使最高的神经酸含量达到了30%,但同时芥酸的含量仍然维持在25%的高水平。随后他们又进行了深入研究:从含有高达54%神经酸的C. graeca中克隆得到其KCS基因,在酵母中对基因功能进行验证,得到神经酸,并将其在“种子特异启动子”的调控下,在产油植物B. carinaca中异源表达,最终使得神经酸产量达总油脂的44%,并将其芥酸含量降低到了6%[46],这对后续利用代谢工程手段改造神经酸生产菌株提供了重要的思路及参考。
总之,目前对芥酸和神经酸的代谢工程研究已经取得了一些进展,包括找到了延长酶体系,基本了解延长机制,并对关键基因进行了克隆和异源表达。但是目前的认识还不满足理性设计提升产量的要求,主要存在以下问题:(1)虽现在当前认为KCS基因是延长循环过程的关键基因,但是,单一KCS基因对整个过程的调控机制尚不清楚;(2)还没有找到特别好的目标载体,对其进行高效、系统和有目的的改造。
5 展望VLCMFA具有独特的药效、保健功效和工业用途。目前,VLCMFA的生物合成路径已基本清楚,但是,对催化碳链延长的关键酶及其调控机制的认识还不足,如KCS、KCR的底物选择性、协同作用等。应用代谢工程方法提高植物的芥酸或神经酸含量已有尝试,但是产量有待提高。除植物组织,产油微生物是开发VLCMFA的潜在细胞工厂,如产油酵母Y. lipolytica具有产油量高、易培养、繁殖快等特点,并且该酵母属于 “生物安全性第一级微生物(Biosafety class 1 microorganism)”[47]。美国杜邦公司已经将Y. lipolytica产超长链多不饱和脂肪酸EPA产业化[48]。当前,芥酸和神经酸的代谢工程改造还没有达到工业化生产的要求,VLCMFA生物合成的深入研究将推动相关的应用开发。
| [1] | 石娟, 朱葆华, 潘克厚. 转基因植物生产超长链多不饱和脂肪酸研究进展[J]. 植物学通报, 2007, 24(5):659-666. |
| [2] | Salas JJ, Martínez Force E, Garcés R. Very long chain fatty acid syn-thesis in sunflower kernels[J]. J Agric Food Chem, 2005, 53(7):2710-2716. |
| [3] | Kramer, JKG, Sauer FD, et al. Results obtained with feeding low erucic acid rapeseed oils and other vegetable oils to rats and other species[M]// Kramer JKG, Sauer FD, Pigden WJ, et al. High and Low Erucic Acid Rapeseed Oils. Production, Usage, Chemistry, and Toxicological Examination. Toronto, Canada:Academic Press, 1983:413-474. . |
| [4] | Erucic acid in food:A Toxicological Review and Risk Assessment[S]. Food Standards Australia New Zealand, 2003. |
| [5] | Yuan C, Liu J, Fan Y, et al. Mychonastes afer HSO-3-1 as a potential new source of biodiesel[J]. Biotechnol Biofuels, 2011, 4(1):47. |
| [6] | 王性炎, 樊金栓, 王姝清. 中国含神经酸植物开发利用研究[J]. 中国油脂, 2006, 31(3):69-71. |
| [7] | Yamazaki Y, Kondo K, Maeba R, et al. The proportion of nervonic acid in serum lipids is associated with serum plasmalogen levels and metabolic syndrome[J]. J Oleo Sci, 2014, 63(5):527-537. |
| [8] | 朱东升, 何国庆. 神经酸的研究进展[J]. 粮油加工, 2008;8:65-67. |
| [9] | Kasai N, Mizushina Y, Sugawara F. Three dimensional structural model analysis of the binding site of an inhibitor, nervonic acid, of both DNA polymerase B and HIV-1 reverse transcriptase[J]. J Biochem, 2002, 132(5):819-828. |
| [10] | 陈文杰, 赵兴中, 王灏, 等. 不同甘蓝型油菜高含油量种质资源的脂肪酸成分分析[J]. 现代生物医学进展, 2009, 1(4):46-49. |
| [11] | 王幼平, 罗鹏, 李旭峰, 等. 海甘蓝种子成分分析及其利用[J]. 天然产物研究与开发, 1994, 3:55-58. |
| [12] | Guo Y, Mietkiewska E, Francis T. Increase in nervonic acid content in transformed yeast and transgenic plants by introduction of a Lunaria annua L. 3-ketoacyl-CoA synthase(KCS)gene[J]. Plant Mol Biol, 2009, 69(5):565-575. |
| [13] | 马柏林. 含神经酸植物的研究[J]. 西北植物研究, 2004, 24(13):2362-2365. |
| [14] | Katherine MS, John BO. Lipid metabolism in plants[M]// Vance DE, Vance JE. Biochemistry of lipid. the4th Edn. USA:Elsevier Science BV. 2002. |
| [15] | Ohlrogge J, Browse J. Lipid biosynthesis[J]. Plant Cell, 1995, 7:957-970. |
| [16] | Shimakata T, Stumpf PK. Isolation and function of spinach leaf 3-ketoacyl-[acyl-carrier-protein]synthases[J]. Proc Natl Acad Sci USA, 1982, 79(19):5808-5812. |
| [17] | Konrad B. Enzymatic Synthesis of Monounsaturated Fatty Acids[J]. Accounts of Chemical Research, 1969, 2(7):193-202. |
| [18] | Jenni S, Leibundgut M, Boehringer D. Structure of fungal fatty acid synthase and implications for iterative substrate shutting[J]. Science, 2007, 316(5822):254-261. |
| [19] | Cassagne C, Lessire R. Biosynthesis of saturated very long chain fatty acids by puried membrane fractions from leek epidermal cells[J]. Arch Biochem Biophys, 1978, 191(1):146-152. |
| [20] | Agrawal VP, Lessire R, Stumpf PK. Biosynthesis of very long chain fatty acid in micosomes from epidermal cells[J]. Arch Biochem Biophys, 1984, 230(2):580-589. |
| [21] | Naoki M, Nobuhiro O, Masaru G. Nature of the reaction product f[1-14C]stearoyl-CoA elongation by etiolated leek seedling microsomes[J]. Arch Microbiol, 1992, 157:223-228. |
| [22] | Kihara A, Sakuraba H, Ikeda M, et al. Membrane topology and essential amino acid residues of Phs1, a 3-hydroxyacyl-CoA dehydratase involved in very long-chain fatty acid elongation[J]. J Biol Chem, 2008, 283(17):11199-11209. |
| [23] | Haslam TM, Kunst L. Extending the story of very-long-chain fatty acid elongation[J]. Plant Sci, 2013, 210:93-107. |
| [24] | Paul S, Gable K, Beaudoin F, Cahoon E. Members of the Arabidopsis FAE1-like 3-Ketoacyl-CoA synthase gene family substitute for the Elop proteins of Saccharomyces cerevisiae[J]. J Biol Chem, 2006, 281(14):9018-9029. |
| [25] | James DW, Lim E, Keller J, et al. Direct tagging of the Arabidopsis FATTY ACID ELONGATION1(FAE1)gene with the maize transposon Activator[J]. Plant Cell, 1995, 7(3):309-319. |
| [26] | Millar AA, Clemens S, Zachgo S. CUT1, an Arabidopsis gene required for cuticular wax biosynthesis and pollen fertility, encodes a very-long-chain fatty acid condensing enzyme[J]. Plant Cell, 1999, 11:825-838. |
| [27] | Wang Q, Jianga Q, Lian JP, et al. Functional identification of ELO-like genes involved in very long chain fatty acid synthesis in Arabidopsis thaliana[J]. Russian Journal of Plant Physiology, 2014, 61(6):853-861. |
| [28] | Quist TM, Sokolchik I, Shi H, et al. HOS3, an ELO-like gene, inhibits effects of ABA and implicates a S-1-P/ceramide control system for abiotic stress responses in Arabidopsis thaliana[J]. Mol Plant, 2009, 2:138-151. |
| [29] | Pascal S, Bernard A, Sorel M. The Arabidopsis cer26 mutant, like the cer2 mutant, is specifically affected in the very long chain fatty acid elongation process[J]. Plant J, 2013, 73:733-746. |
| [30] | Sun X, Pang H, Li M, et al. Evolutionary Pattern of the FAE1 Gene in Brassicaceae and Its Correlation with the Erucic Acid Trait[J]. PLoS One, 2013, 8(12):e83535. |
| [31] | Beaudoin F, Gable K, Sayanova O, et al. A Saccharomyces cerevisiae gene required for heterologous fatty acid elongase activity encodes a microsomal 3-keto-reductase[J]. J Biol Chem, 2002, 277(13):11481-11488. |
| [32] | Beaudoin F, Wu X, Li F, et al. Functional characterization of the Arabidopsis 3-ketoacyl-Coenzyme A reductase candidates of the fatty acid elongase[J]. Plant Physiol, 2009, 150(3):1174-1191. |
| [33] | Dietrich CR, Perera MA, Yandeau D. Characterization of two GL8 paralogs reveals that the 3-ketoacyl reductase component of fatty acid elongase is essential for maize(Zea mays L.)development[J]. Plant J, 2005, 42(6):844-861. |
| [34] | Puyaubert J, Dieryck W, Costaglioli P. Temporal gene expression of 3-ketoacyl-CoA reductase is different in high and in low erucic acid Brassica napus cultivars during seed development[J]. Biochim Biophys Acta, 2005, 1687(1-3):152-163. |
| [35] | Guan R. Metabolic Engineering of Crambe abyssinica for producing high erucic acid oil[D]. Swedish:Acta Universitatis Agricultu-rae Sueciae, 2014. |
| [36] | Mietkiewska E, Brost JM, Giblin EM, et al. Cloning and functional characterization of the fatty acid elongase 1(FAE1)gene from high erucic Crambe abyssinica cv. Prophet[J]. Plant Biotechnol J, 2007, 5(5):636-645. |
| [37] | Rossak M, Smith M, Kunst L. Expression of the FAE1 gene and FAE1 promoter activity in developing seeds of Arabidopsis thaliana[J]. Plant Mol Biol, 2001, 46(6):717-725. |
| [38] | Jadhav A, Katavic V, Marillia EF. Increased levels of erucic acid in Brassica carinata by co-suppression and antisense repression of the endogenous FAD2 gene[J]. Metab Eng, 2005, 7(3):215-220. |
| [39] | Cao YZ, Oo KC, Huang AH. Lysophosphatidate acyl transferase in the microsomes from maturing seeds of meadowfoam(Limnanthes alba)[J]. Plant Physiol, 1990, 94(3):1199-1206. |
| [40] | Barret P, Delourme R, Renard M. The rapeseed FAE1 gene is linked to the E1 locus associated with variation in the content of erucic acid[J]. Theoretical and Applied Genetics, 1998, 96:177-186. |
| [41] | Li X, van Loo EN, Gruber J. Development of ultra-high erucic acid oil in the industrial oil crop Crambe abyssinica[J]. Plant Biotechnol J, 2012, 10(7):862-870. |
| [42] | Li X, Fan J, Gruber J. Efficient selection and evaluation of transgenic lines of Crambe abyssinica[J]. Front Plant Sci, 2013, 4:162. |
| [43] | Li-Beisson Y, Shorrosh B, Beisson F, et al. Acyl-lipid metabolism[J]. Arabidopsis Book, 2010, 8:e0133. |
| [44] | Bates PD, Durrett TP, Ohlrogge JB, et al. Analysis of acyl fluxes through multiple pathways of triacylglycerol synthesis in developing soybean embryos[J]. Plant Physiol, 2009, 150(1):55-72. |
| [45] | Guan R, Lager I, Li XY. Bottlenecks in erucic acid accumulation in genetically engineered ultrahigh erucic acid Crambe abyssinica[J]. Plant Biotechnology Journal, 2014, 12:193-203. |
| [46] | Taylor DC, Francis T, Guo Y, et al. Molecular cloning and characterization of a KCS gene from Cardamine graeca and its heterologous expression in Brassica oilseeds to engineer high nervonic acid oils for potential medical and industrial use[J]. Plant Biotechnol J, 2009, 7(9):925-938. |
| [47] | Groenewald M, Boekhout T, Neuvéglise C, et al. Yarrowia lipolytica:Safety assessment of an oleaginous yeast with a great industrial potential[J]. Crit Rev Microbiol, 2014, 40(3):187-206. |
| [48] | Xue Z, Sharpe PL, Hong SP, et al. Production of omega-3 eicosapentaenoic acid by metabolic engineering of Yarrowia lipolytica[J]. Nat Biotechnol, 2013, 31(8):734-740. |






