单抗类药物的出现为人类一些自身免疫病、癌症等疑难病的诊断与治疗开辟了广阔前景,在为人类健康作出突出贡献的同时也为企业带来非常可观的收入,已成为近年来销售额最高的一类生物技术药物[1, 2, 3]。虽然哺乳动物细胞培养技术要求高、抗体表达能力低、生产成本高,但具有其它表达系统无法取代的优势:能够准确的完成糖基化、折叠、链内及链间二硫键的形成等一系列翻译后修饰,因此其表达的抗体在分子结构、理化特性和生物学功能方面更接近天然产物[4]。自1996年以来,FDA批准的生物技术产品中,有2/3以上是通过哺乳动物细胞系统生产的[5]。中国仓鼠卵巢细胞(Chinese hamster ovary,CHO)由于具有抗剪切力,易于放大培养的优势,是目前使用最广泛的哺乳动物细胞表达系统[6]。目前使用最广泛的CHO表达系统是二氢叶酸还原酶(DHFR)和谷氨酰胺合成酶(Glutamine synthetase,GS)表达系统。
目前国内很多科研院校和企业的宿主细胞抗体表达水平都很低,抗体浓度多处于1 000 mg/L以内[7],很难用于实际生产。而在发达国家,宿主细胞抗体表达量往往都在1 000 mg/L以上[8, 9, 10]。其次,我国动物细胞培养技术还不成熟,与发达国家差距较大。目前我国动物细胞培养更多的工作是为了提高抗体的表达量而很少关注抗体的质量。动物细胞培养技术已成为我国抗体类药物走向产业化、实现其经济价值,满足市场需求的瓶颈[3]。
目前动物细胞大规模培养的主流方式是利用搅拌式生物反应器进行流加培养,相应的反应器放大设计和操作成为新的挑战,这其中的主要关键技术涉及剪切力、氧传递、均一性、二氧化碳分压(pCO2)控制、pH控制、渗透压及抗体的质量等问题[11, 12, 13, 14, 15]。本研究主要探究pH对CHO细胞生长、抗体表达及质量、pCO2等的影响,以期为国内细胞培养工艺和QbD方法运用时风险评估提供参考。
1 材料与方法 1.1 材料 1.1.1 CHO细胞所用CHO细胞为GS-CHO,表达抗TNFα抗体,由本实验自主构建并保藏。
1.1.2 培养基所用基础培养基为CD EfficientFeedTM B,购买至Gibco公司。所用流加培养基为Acti CHO Feed-A CD和Acti CHO Feed-B CD,均购买至PAA公司。
1.1.3 主要仪器细胞活力分析仪(上海睿钰生物科技有限公司);1 L生物反应器(荷兰Applikon生物技术公司);NOVA多参数生化分析仪(美国Nova生物有限公司);高效液相色谱安(安捷伦科技有限公司)。
1.2 方法 1.2.1 培养方法将液氮冷冻保藏的CHO细胞复苏后,装入一次性摇瓶在37℃、130 r/min、8%的CO2条件下进行扩大培养,每3 d传代1次,传代密度为5×105个/mL。最后将细胞以10×105个/ mL的密度接入1 L反应器进行发酵培养。
1.2.2 细胞计数及活力分析台盼蓝染色后由细胞活力分析仪自动计数及分析活力。
1.2.3 葡萄糖、谷氨酸、管氨酰胺、乳酸、铵根、pCO2测定使用NOVA多参数生化分析仪测定。
1.2.4 HPLC法检测抗TNFα抗体浓度用0.1 mol/L磷酸缓冲液以2 mL/min流速平衡HPLC系统15 min至基线平稳,于系统程序中设置标准曲线法程序。进样50 μL于进样器,以2 mL/min流速洗脱,记录有关数据,并进行处理。
1.2.5 HPLC法检测抗TNFα抗体电荷异质性进样体积100 μL,流速1 mL/min,检测波长280 nm,样品盘温度8℃,柱温40℃,运行时间22 min。
1.2.6 毛细管电泳测定抗TNFα单抗纯度毛细管电泳系统分别用1 mol/ L NaOH 洗5 min、水洗5 min 及分离缓冲液洗10 min。每次进样前,分别用0.1 mol/L NaOH 及分离缓冲液洗1 min 后即可进样。毛细管长30.2 cm,有效长度20 cm,检测波长220 nm,柱温25℃,样品盘15℃。
1.2.7 HPLC-MS检测抗TNFα抗体糖基化色谱条件(色谱柱:Agilent-C8,75×2.1 mm,5 μm,300埃):进样体积2 μL,检测波长280 nm,流速0.5 mL/min,柱温75℃,样品盘温度8℃;
质谱条件:仪器模式Auto MS/MS,离子模式Dual AJS ESI源,阳离子,干燥气体N2,12 L/min,325℃;碰撞电压260 V;工作电压65 V;毛细管电压4 000 V;夹套气体温度(流速):350℃,12 L/min;气体温度325℃;VCap:3 500 V;喷头电压1 000 V;分离器电压65 V;OCT 1 RF Vpp电压750 V;质量范围500-3 200 m/z。
1.2.8 HPLC法检测抗TNFα抗体多聚体含量取25 μL样品加缓冲液1 mL稀释,上样10 μL,流速0.5 mL/min;检测波长为280 nm。
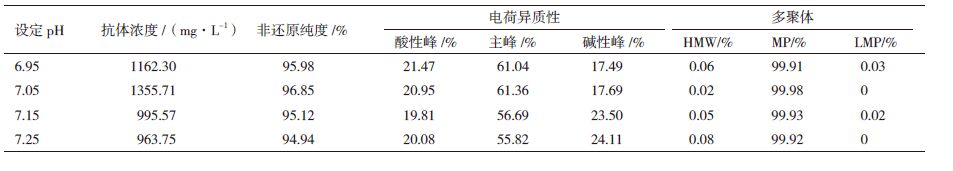
2 结果 2.1 单相pH培养对CHO细胞的影响在1 L反应器中探究pH对CHO细胞生长、抗体表达等生理代谢的影响,选择研究的pH范围为6.95至7.25,用CO2和7.5%的碳酸氢钠来控制pH,pH控制的死区范围为±0.05,实验平行数为2。1 L反应器初始培养体积为400 mL,接种密度为1.0E+06 cells/mL,OD控制在40%;转速第0天到第5天为150 r/min,之后为196 r/min,培养温度均为37℃恒温。培养初期用空气调节OD,当通入的空气量超过0.1V VM之后改通纯氧。培养至第3天后每隔24 h流加9.6 mL cti CHO Feed-A CD和0.96 mL Acti CHO Feed-B CD。共培养11 d,实验结果如图 1所示。
|
| 图 1 pH 对CHO 细胞生长的影响 |
一般pH低于6.8或者大于7.3不适于CHO细胞的生长。通过图 2发现随着pH的增加活细胞密度和抗体表达量都呈现出先增大后降低的趋势。对于本实验所用CHO细胞,最优pH为7.05,在此条件下培养第9天获得最大细胞密度1.54×107个/mL,第11天获得最高抗体浓度1 355.71 mg/L,但当pH为6.95时在第9天获得最大的每天单细胞抗体表达量(SPR)为26.04 pg。

|
| 图 2 图2 pH 对CHO 细胞抗体表达的影响 |
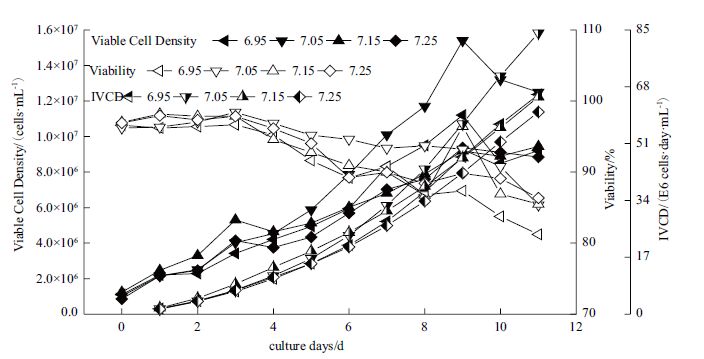
动物细胞培养时pCO2受各种因素的影响:pH、通气、培养基成分、细胞代谢等。在本实验中发现在培养的过程中pCO2呈现出先下降后上升的趋势(图 3),这主要是由于CHO细胞培养时前期产生乳酸,中和培养基中碱性物质,导致pCO2降低(图 4)。后期由于营养需求较大,乳酸产生的速率较低甚至被消耗,且细胞密度较高,细胞代谢产生大量CO2,无法及时排出,导致pCO2上升。对于相同的培养基,当培养时设定的pH值越低,pCO2值越大,可能是由于需要更多的CO2去降低培养基的pH。
|
| 图 3 pH 对pCO2 的影响 |

|
| 图 4 pH 对乳酸积累的影响 |
从表 1中可以看出pH对抗体的非还原纯度和电荷异质性有影响,对多聚体影响不大。随着pH的增大,抗体非还原纯度呈现先上升后下降的趋势,在pH为7.05时获得最大抗体非还原纯度96.85%;随着pH的增加,抗体主峰在下降,碱性峰在上升,酸性峰总体呈现下降的趋势,但变化量很小。表 2说明pH对抗体的糖基化有影响,随着pH的增大G2F、G1F含量在下降,G0F、G1F-GN含量在上升。
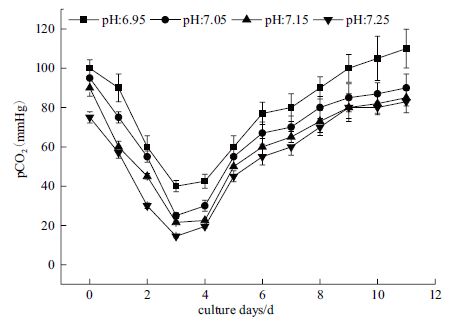
在1 L反应器中探究在第9天将pH从初始7.05转成6.95时对细胞抗体表达的影响,结果如图 5所示。pH能够影响许多酶的活性,从而对细胞的生长、抗体表达、抗体质量等有比较大的影响。图 6显示出当pH从7.05调至6.95,活细胞密度和细胞活率都有所下降,但由于pH变化幅度比较小,所以对细胞没有造成严重的损伤,活细胞密度和细胞活率下降程度不大。

|
| 图 5 pH 两项培养对细胞生长的影响 |
|
| 图 6 pH 两项培养对抗体表达的影响 |
pH调整后SPR值有所上升,使得最后获得的抗体浓度比单项pH培养时要高。这些可能是由于细胞自身的代谢和抗体表达都需要消耗营养物质和能量,而抗体在后期大量表达,导致后期营养和能量需求比较大,流加的营养和细胞自身所产生的能量不能同时满足细胞生长和抗体表达所需。当pH调至6.95后细胞密度和活率有所降低,减少了由于细胞自身生理代谢所消耗的营养和能量,就使得有更多的营养和能量用于抗体合成。
3 讨论以动物细胞为载体生产单克隆抗体已越来越受到重视,但目前国内的研究更多的停留在培养基开发[20]和工艺开发[7]上,很少关注单抗的质量属性。目前国际制药巨头已经深入理解和实施QbD 理论,将工艺与药品的质量联系起来,做到药品的质量是生产出来的而不是检测出来。而国内的企业对工艺与产品质量之间的联系研究不够深入,不能很好的实施QbD理论。本研究考察了pH对CHO的生长、活力及单抗的表达量、非还原纯度(纯化后)、电荷异质性、糖基化、多聚体的影响,将生产工艺与单抗质量建立联系。
pH设定点的不同会对细胞内许多酶的活性产生重要影响从而对细胞的生长、活力以及单抗表达有很大的影响,这在国内外有很多文献报道。pH两相培养能够降低细胞活力,从而将更多地营养和能量提供给抗体合成,提高单抗表达量。
由于CHO细胞培养时前期产生大量乳酸,中和培养基中碱性物质,使得CO2溢出培养基,导致pCO2降低。后期细胞培养营养需求大,乳酸从积累变成消耗,且细胞密度较高,细胞代谢产生大量CO2,无法及时排出,导致pCO2上升,所以pCO2呈现先上升后下降的趋势。
研究结果表明pH对单抗的电荷异质性和半乳糖糖基化有较大影响,半乳糖糖基化对抗体的ADCC和CDC效应有重要影响。随着pH的增加,抗体主峰在下降,碱性峰在上升,酸性峰总体呈现较小趋势的下降,G2F、G1F含量在下降,G0F、G1F-GN含量在上升。抗体非还原纯度对单抗的免疫源性有重要影响,pH对单抗的非还原纯度(纯化后)有影响,随着pH的增大,呈现先上升后下降的趋势,在pH为7.05时获得最大抗体非还原纯度96.85%。
由于pH对单抗的质量有重要影响,并且细胞培养时pH值偏离设计空间的可能性较大,因此在运用QbD方法生产单抗药物时,对pH进行风险评估可将pH列为关键工艺参数。
4 结论当pH为7.05时最适合本实验室CHO细胞生长和抗体表达。在本研究的pH范围内,高pH培养能够降低pCO2,但是却促进了乳酸的积累;抗体的非还原纯度随着pH的增加呈现先增高后降低的趋势;较高的pH会导致碱性峰增高,主峰降低,但对酸性峰影响不大;当培养的pH增加时G2F、G1F含量在下降,G0F、G1F-GN含量在上升。pH两项培养能够降低后期细胞活力和促进抗体表。。
| [1] | 胡显文, 陈惠鹏, 张数庸. 全球生物制药产业概况[J]. 中国医药生物技术, 2009, 4(2):85-89. |
| [2] | 张洁, 张松. 单克隆抗体药物的研究进展[J]. 中国药业, 2006, 15(14):61-62. |
| [3] | 张元兴. 动物细胞培养工程[M]. 北京:化学工业出版社. 2007. |
| [4] | Lim Y, Wong NSC, Lee YY, et al. Engineering mammalian cells in bioprocessing-current achievements and future perspectives[J]. Biotechnology and Applied Biochemistry, 2010, 55(4):175-189. |
| [5] | Chu L, Robinson DK. Industrial choices for protein production by large-scale cell culture[J]. Curr Opin Biotechnol, 2001, 12:180-187. |
| [6] | Birch JR, Racher AJ. Antibody production[J]. Adv Drug Deliv Rev, 2006, 58:671-685. |
| [7] | 范里, 赵亮, 孙亚婷, 等. 表达TNFR-Fc融合蛋白的GS-CHO细胞动态流加培养过程的设计[J]. 生物工程学报, 2010, 26(2):216-222. |
| [8] | Li J, Wong CL, Vijayasankaran N, et al. Feeding lactate for CHO cell culture processes:Impact on culture metabolism and performance[J]. Biotechnology and Bioengineering, 2012, 109(5):1173-1186. |
| [9] | Kshirsagar R, McElearney K, Gilbert A, et al. Controlling trisulfide modification in recombinant monoclonal antibody produced in fed‐batch cell culture[J]. Biotechnology and Bioengineering, 2012, 109(10):2523-2532. |
| [10] | Gilbert A, McElearney K, Kshirsagar R, et al. Investigation of met-abolic variability observed in extended fed batch cell culture[J]. Biotechnology Progress, 2013, 29(6):1519-1527. |
| [11] | Berrios J, Altamirano C, Osses N, et al. Continuous CHO cell cultures with improved recombinant protein productivity by using mannose as carbon source:Metabolic analysis and scale-up simulation[J]. Chemical Engineering Science, 2011, 66(11):2431-2439. |
| [12] | Garcia-Ochoa F, Gomez E. Bioreactor scale-up and oxygen transfer rate in microbial processes:an overview[J]. Biotechnology Advances, 2009, 27(2):153-176. |
| [13] | Martínez VS, Dietmair S, Quek LE, et al. Flux balance analysis of CHO cells before and after a metabolic switch from lactate produc-tion to consumption[J]. Biotechnology and Bioengineering, 2013, 110(2):660-666. |
| [14] | Takuma S, Hirashima C, Piret JM. Dependence on glucose limita-tion of the pCO2 influences on CHO cell growth, metabolism and IgG production[J]. Biotechnology and Bioengineering, 2007, 97(6):1479-1488. |
| [15] | Xing Z, Kenty BM, Li ZJ, et al. Scale-up analysis for a CHO cell culture process in large-scale bioreactors[J]. Biotechnology and Bioengineering, 2009, 103(4):733-746. |
| [16] | Takuma S, Hirashima C, Piret JM. Dependence on glucose limitation of the pCO2 influences on CHO cell growth, metabolism and IgG production[J]. Biotechnology and Bioengineering, 2007, 97(6):1479-1488. |
| [17] | Gray DR, Chen S, Howarth W, et al. CO2 in large-scale and high-density CHO cell perfusion culture[J]. Cytotechnology, 1996, 22(1-3):65-78. |
| [18] | Kimura R, Miller WM. Effects of elevated pCO2 and/or osmolality on the growth and recombinant tPA production of CHO cells[J]. Biotechnology and Bioengineering, 1996, 52(1):152-160. |
| [19] | Goudar CT, Matanguihan R, Long E, et al. Decreased pCO2 accumulation by eliminating bicarbonate addition to high cell-density cultures[J]. Biotechnology and Bioengineering, 2007, 96(6):1107-1117. |
| [20] | 马爱瑛, 周栋, 李敏. CHO 工程细胞株低血清培养的初探[J]. 生物技术通报, 2009(11):154-157. |