2. 南京工业大学食品与轻工学院,南京 211816
2. State Key Laboratory of Materials-oriented Chemical Engineering,College of Food Science and Light Industry,Nanjing Tech University,Nanjing 211816
类胡萝卜素是一类重要的天然色素的总称,普遍存在于动物、高等植物、真菌、藻类中的黄色、橙红色或红色的色素之中,具有抗氧化、抑制突变、降低核酸损伤、减少心血管疾病及预防癌症等多种保健功能[1, 2]。目前利用发酵法生产天然类胡萝卜素的微生物有霉菌、细菌和酵母等[3, 4, 5]。耐辐射奇异球菌Deinococcus wulumuqiensis R12是一种红色、不产孢子、非致病性的球菌,对电离辐射、干燥、紫外线、各种DNA损伤以及强氧化剂具有较强的抗性,其细胞膜富含的大量类胡萝卜素是脂质、蛋白质、多糖的抗氧化剂,因而耐辐射奇异球菌具有较强的抗氧化能力[6, 7, 8]。因此,开发利用耐辐射奇异球菌进行发酵生产类胡萝卜素具有重要的价值。
常压室温等离子体(Atmospheric and room temp-erature plasma,ARTP)育种技术是近年来兴起的一种新型有效的微生物诱变方法。采用氦气为工作气体的等离子体射流作用于微生物,从而引起微生物的突变。与传统诱变方法相比,采用ARTP技术能够有效造成DNA多样性的损伤,突变率高,并易获得遗传稳定性良好的突变株;与分子操作手段相比,ARTP技术进行微生物诱变育种具有操作安全性高、无有毒有害物质参与诱变过程等优点[9]。最近几年,ARTP技术在微生物突变育种及生物医学领域中已经引起人们越来越多的注意,已经成为当前一个相当活跃的交叉学科研究领域,得到了越来越广泛的应用[10, 11]。
实验室前期获得一株极端耐辐射奇异球菌D. wulumuqiensis R12,属于Deinococcus属,并有可能是该菌属中的一个新种[12]。D. wulumuqiensis R12合成的类胡萝卜素经过薄层层析和高效液相色谱分析表明,除主要产物deinoxanthin[13]之外,还存在其他次级代谢产物。为了使D. wulumuqiensis R12能高效、大量合成类胡萝卜素,本研究以D. wulumuqiensis R12为出发菌株,利用ARTP 技术进行诱变,筛选高产类胡萝卜素的稳定突变菌株,并研究突变菌株类胡萝卜素的抗氧化性能及菌株的抗辐射性能。
1 材料与方法 1.1 材料 1.1.1 试剂蛋白胨、酵母粉(OXOID,England);氯化钠、葡萄糖、丙酮、甲醇、盐酸(国药集团化学试剂有限公司);琼脂粉(上海化学试剂公司);K3Fe(CN)6、1,1-二苯基-2-三硝基苯肼(DPPH)(上海宝曼生物科技有限公司);三氯乙酸(永华化学科技有限公司)。
1.1.2 仪器微量移液器(Eppendorf);高压灭菌锅(YXQ.SG41.280,上海医用核子仪器厂);水浴锅(HH-4,上海国华仪器厂);烘干箱(PYX-DHS,上海实验仪器厂);培养箱(101A-2,上海跃进医疗器械厂);电子天平(BP110S,Sartorias);离心机(SIGMA 15K,SIGMA);超净工作台(JW-CJ-IF,苏州净化设备厂);数字恒温水浴锅(HH-4,常州国华电器有限公司);酶标仪(M3,Thermo);紫外光栅分光光度计(752,上海精密科学仪器有限公司);ARTP 生物育种机(北京思清源生物科技有限公司);UV灯(苏州市相城区新亚特光源厂);紫外辐射表(VLX-3W,法国Radiometer公司)。
1.1.3 菌种耐辐射奇异球菌D. wulumuqiensis R12(实验室选育保藏)。
1.1.4 培养基(g/L)TGY液体培养基:蛋白胨5,酵母粉3,葡萄糖1,pH7.2。TGY固体培养基:在TGY液体培养基中添加2.5%琼脂粉。以上培养基均在121℃灭菌20 min。
1.2 方法 1.2.1 细胞干重测定方法待测发酵液加入离心管中,12 000 r/min离心5 min收集菌体,弃去培养基,将菌体用蒸馏水洗涤3次,100℃干燥直至恒重。
1.2.2 ARTP诱变方法从-80℃的冻存菌中接种D. wulumuqiensis R12至TGY固体培养基,30℃培养3-4 d后,挑取单菌落接种至TGY液体培养基,在30℃的150 r/min摇床中培养20-30 h至对数生长期。用分光光度计测量菌液的吸光度(OD600值),用生理盐水调整菌液OD600值至1,取10 µL进行ARTP诱变。以99.99%氦气作为工作气体,在电源功率为115 W、操作温度在23.0-35.0℃的条件下分别诱变0、30、60、90、120、150 和180 s。诱变结束后用生理盐水进行梯度稀释,取10-6和10-7浓度的菌液涂布于TGY固体培养基上,放于30℃的培养箱中培养2-3 d,计算平板上菌落数,通过菌落计数法(Colony forming units,CFU)计算致死率,绘制致死率曲线。
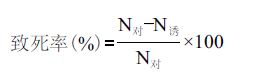
将诱变后的菌液稀释一定倍数涂布TGY平板,根据菌落生长情况挑取生长大而丰满、颜色较深的菌落,接种单菌落于装有2.4 mL TGY液体培养基的24孔深孔培养板中,于30℃、150 r/min培养48 h。利用96 孔板测定发酵液OD600,并观察菌体颜色深浅进行菌株的初筛。通过测定初筛得到的突变菌株类胡萝卜素含量进行菌株的复筛。
1.2.4 类胡萝卜素的提取与检测方法参照文献[14, 15]中方法,略加改进。将初筛筛出的突变菌株接种至含液体TGY培养基50 mL的250 mL摇瓶中进行培养,30℃、150 r/min培养72 h后6 000 r/min离心10 min收集菌体,弃去培养基,将菌体用蒸馏水洗涤3次,冻干之后,-20℃保存。取冷冻保存的菌体0.1 g至50 mL离心管中,加入4 mL HCL(3 mol/L),28℃振荡1 h。随后沸水浴中加热4 min,置于冰水浴中迅速冷却,6 000 r/min离心10 min,弃上清,沉淀以蒸馏水洗涤2次,弃上清取沉淀,最后加入4 mL有机溶剂(丙酮∶甲醇=7∶2)提取类胡萝卜素,28℃振荡30 min,6 000 r/min离心15 min,上清即为类胡萝卜素粗提取液,用0.22 µm滤头过滤后避光-20℃保存。
类胡萝卜素粗提取液含量测定采用分光光度法确定,类胡萝卜素含量的计算公式为:
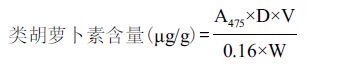
在TGY固体培养基上活化菌,转接到装有5 mL TGY液体培养基的50 mL离心管中进行一级培养,连续转接10次,测定突变菌株产类胡萝卜素能力的遗传稳定性。
1.2.6 突变菌株的抗氧化性检测方法 1.2.6.1 高铁离子还原能力测定参照文献[16, 17]中方法,略加改进。取0.5 mL 类胡萝卜素粗提取液,加入0.5 mL l%的K3Fe(CN)6,混匀,50℃孵育20 min,加入0.5 mL 10% 的三氯乙酸(TCA),然后将混合物3 500 r/min离心10 min。取1 mL上清,加入1 mL 0.1%的三氯化铁溶液。测定反应液在700 nm下的吸光度,吸光值越大说明样品对高铁离子的还原能力越强。
1.2.6.2 DPPH法测定自由基清除活性参照文献[17, 18]中方法,略加改进。取1 mL的类胡萝卜素粗提取液,加入1 mL 0.2 mmol/L DPPH乙醇溶液,振荡混合,室温下避光反应30 min。测定反应液在580 nm下的吸光度,吸光度越小说明样品对DPPH的清除能力越强。清除率计算公式为:

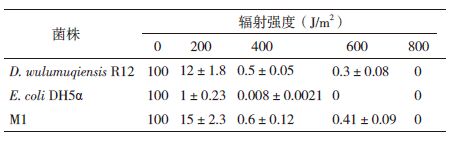
以突变菌株为测试菌株,设置原始菌株D. wulumuqiensis R12为阳性对照,设置Escherichia coli DH5α为阴性对照。将菌株培养在TGY液体培养基中生长到对数生长期,在4℃、12 000 r/min离心5 min后以生理盐水重悬菌体,分别得到浓度为107-108 CFU/mL的菌液。将菌液分别分成2 mL的小份,在25℃的环境中,暴露在0.167 kGy/min剂量的60Co的放射源下,在辐射量0-20.0 kGy范围内,以2.0 kGy为梯度进行γ辐射处理。每隔10 min,取0.1 mL的辐射菌液,用生理盐水进行梯度稀释,每个稀释梯度涂布TGY平板,置于30℃培养箱内培养。每天计数TGY培养基上的菌落形成单位,计数15 d。
1.2.7.2 UV辐射测定菌株耐辐射性能以突变菌株为测试菌株,设置原始菌株D. wulumuqiensis R12为阳性对照,设置E. coli DH5α为阴性对照。将菌株培养在TGY液体培养基中生长到对数生长期,在4℃、12 000 r/min离心5 min后以生理盐水重悬菌体,分别得到浓度为107-108 CFU/mL的菌液。将菌液分别分成2 mL的小份,在254 nm的UV灯下照射,通过紫外辐射表检测UV辐射强度,考察不同照射剂量下各菌株的存活率。每隔10 min,取0.1 mL的照射菌液,用生理盐水进行梯度稀释,每个稀释梯度涂布TGY平板,置于30℃培养箱里培养。每天计数TGY培养基上的菌落形成单位,计数15。
2 结果 2.1 ARTP诱变致死率曲线的测定对D. wulumuqiensis R12进行ARTP诱变,考察不同诱变时间菌株的致死率(图 1)。从图 1中可以看出,随着诱变时间的增加致死率上升,在90 s条件下达到致死率90%以上(93.8%),之后随时间增加致死率接近100%。为了使菌株获得较好的正向突变,本研究选用90 s作为ARTP的诱变条件。

|
| 图 1 出发菌株D. wulumuqiensis R12 在不同ARTP 照射时间下的致死率曲线 |
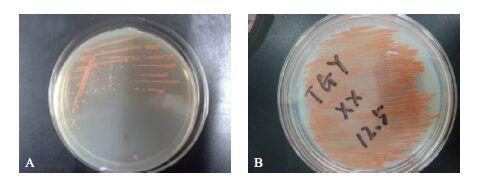
以99.99%氦气作为工作气体,在电源功率为115 W、操作温度在23.0-35.0℃的条件下诱变90 s,得到252株生长大而丰满、颜色较深的菌落。通过24孔深孔培养板和96孔板进行高通量初筛后,获得了35株生长OD600高于出发菌株D. wulumuqiensis R12且发酵颜色较深的菌株。结合类胡萝卜素含量测定进行复筛,最终筛选到了1株突变菌株,命名为M1。D. wulumuqiensis R12和突变菌株M1在30℃,培养72 h后在平板上的生长情况,如图 2所示。
|
| 图 2 出发菌株D. wulumuqiensis R12(A)和突变菌株M1(B)在TGY 平板上的生长情况 |
为了更好地掌握突变菌株M1的生长特性,本研究对出发菌株D. wulumuqiensis R12和突变菌株M1分别培养,测定在600 nm处的吸光值,进行生长曲线的测定。如图 3所示,出发菌株D. wulumuqiensis R12与突变菌株M1的延滞期都较短,能迅速进入对数期,对数期阶段突变菌株生长速度略高于出发菌株,进入稳定期后,突变菌株细胞浓度明显高于出发菌株的细胞浓度。
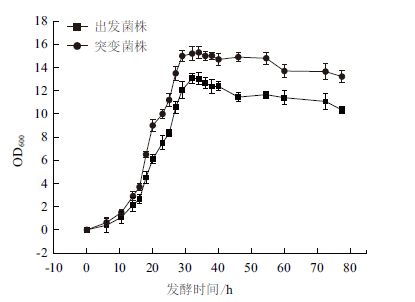
|
| 图 3 出发菌株和突变菌株M1 的生长曲线 |
利用丙酮/甲醇溶液(7∶2,V/V)对出发菌株D. wulumuqiensis R12和突变菌株中的类胡萝卜素进行了提取和测定。如图 4所示,D. wulumuqiensis R12中类胡萝卜素含量为212 μg/g DCW,M1中类胡萝卜素含量为612 μg/g DCW。突变菌株M1中的类胡萝卜素含量明显高于出发菌株D. wulumuqiensis R12,且是出发菌株类胡萝卜素含量的2.8倍。

|
| 图 4 出发菌株和突变菌株M1 的类胡萝卜素含量 |
为了鉴定筛选的突变菌株经传代后是否出现形状的衰退,将突变菌株M1连续转接10代,图 5显示M1类胡萝卜素含量稳定在601-623 μg/g DCW之间。表明突变菌株M1遗传性状稳定。
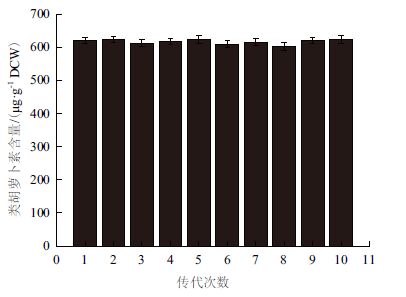
|
| 图 5 突变菌株M1 的遗传稳定性 |
通过对铁离子的还原能力来测定抗氧化物质的总还原能力,具体原理为还原剂可以将铁氰化钾(K3Fe(CN)6)还原成亚铁氰化钾[K4Fe(CN)6],Fe3+与K4Fe(CN)6作用生成亚铁氰化铁(Fe4[Fe(CN)6]3),Fe4[Fe(CN)6]3在700 nm下吸光度较高,所以可通过对吸光度的测定来衡量有多少K3Fe(CN)6被还原,其中吸光度越大还原能力越强。图 6为测定D. wulumuqiensis R12和突变菌株M1类胡萝卜素的高铁离子还原能力,经测定,在相同体积类胡萝卜素的条件下,D. wulumuqiensis R12的吸光值为0.340,而突变菌株M1的吸光值为0.52。表明在相同体积类胡萝卜素的情况下,突变菌株M1类胡萝卜素对高铁离子的还原能力比出发菌株类胡萝卜素强,说明突变菌株M1的抗氧化能力强于出发菌株。

|
| 图 6 出发菌株和突变菌株M1 类胡萝卜素的高铁离子还原能力 |
1,1-二苯基-2-苦肼基自由(1,1-diphenyl-2-picrylhydrazyl radical 2,2-diphenyl-1-(2,4,6-trinitrophenyl)hydrazyl,DP-PH)醇溶液为深紫色,是一种稳定自由基,具有一个未配对电子,可接受1个H+或者1个e-才能到稳定。当有自由基清除剂存在时,DPPH溶液的颜色会变浅,吸光值将会呈线性下降,所以可以用来评价试验样品的抗氧化能力。用清除率来表示抗氧化能力,清除率越大则抗氧化性越强。
图 7显示,出发菌株D. wulumuqiensis R12对DPPH的清除率为23.09%,突变菌株M1对DPPH的清除率为33.33%。表明出发菌株和突变菌株的类胡萝卜素提取液都具有一定的DPPH清除能力,且突变菌株M1的清除率高于出发菌株,说明突变菌株M1的抗氧化能力强于出发菌株。
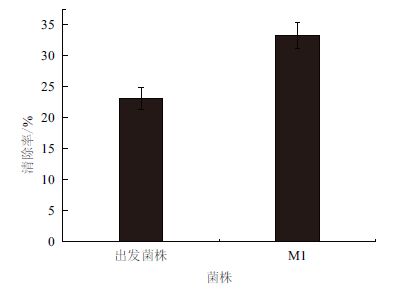
|
| 图 7 出发菌株和突变菌株M1 类胡萝卜素的DPPH 自由 基清除能力 |
从图 8中可以看出,E. coli DH5α在低辐射量下已达到100%致死率,而D. wulumuqiensis R12和突变菌株M1在16 kGy的辐射量下仍有一定存活率,并且在相同辐射量下,突变菌株的存活率高于出发菌株,说明突变菌株M1具有更强的耐γ射线辐射能力。
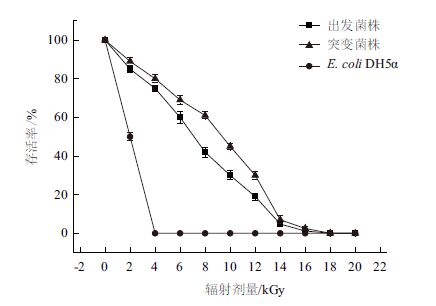
|
| 图 8 γ 射线照射下出发菌株、突变菌株M1 和E. coli DH5α存活曲线 |
考察不同UV辐射剂量下的菌株存活率,从表 1中可以看出,E. coli DH5α在辐射强度为200 J/m2条件下存活率仅为1%,在辐射剂量为400 J/m2条件下存活率已基本为0,但出发菌株和突变菌株在200-600 J/m2条件下均具有存活率,且突变菌株的存活率高于出发菌株,说明突变菌株M1具有更强的耐UV射线辐射能力。
耐辐射奇球菌代谢过程中积累的主要类胡萝卜素deinoxanthin,尽管其生物合成途径还不明确,但是研究表明,这种类胡萝卜素具有比番茄红素、β胡萝卜素、叶黄素和玉米黄质更强的清除氧自由基、单线态氧和H2O2的能力[19]。因此努力提高D. wulumuqiensis R12的类胡萝卜素生产能力具有重要意义。前期已经对D. wulumuqiensis R12进行了全基因组测序[6],通过BLAST比对初步发现与类胡萝卜素合成相关的一系列基因,将进一步通过实验验证各基因功能,并探究deinoxanthin合成途径。
ARTP诱变得到的菌株存在正突变和负突变,为了快速高效筛选到有利菌株,采用了高通量筛选(High throughput screening,HTS)技术进行初筛。郑明英等[11]采用高通量筛选手段获得16 株生长速率和脯氨酸产率变化的菌株,最终结合实验筛选到一株高产脯氨酸的突变菌株。蔡友华等[20]通过高通量筛选获得一株L-苏氨酸产量明显提高的突变株。罗莉斯等[21]建立了 96 孔板高通量筛选多杀菌素高产菌株的方法,该方法显著提高菌株的筛选效率。本研究利用24孔深孔培养板对突变菌株进行相同时间的发酵培养,通过测定OD600确定细菌生长密度,并观察菌体颜色深浅进行初筛。通过测定突变菌株类胡萝卜素产量进一步对初筛菌株进行复筛,结果表明突变菌株类胡萝卜素产量高于出发菌株,进一步证明通过细菌生长密度与菌体颜色深浅能够表明菌株发生了正突变。
类胡萝卜素是菌株D. wulumuqiensis R12中非酶类抗氧化系统中的天然化合物,在菌体抗氧化作用中发挥重要作用。胡雅萍[22]的研究表明,类胡萝卜素提取物在抗氧化活性上具有浓度依赖特征,浓度越高抗氧化性越强,因此菌株类胡萝卜素抗氧化实验的结果表明突变菌株的类胡萝卜素浓度更高,说明突变菌株的抗氧化性要强于出发菌株。
为了能更好的应用于工业化生产,对突变菌株还需进一步研究:对突变菌株进行摇瓶、发酵罐等发酵培养,优化发酵条件;对其产生的类胡萝卜素进行性质结构的鉴定;对突变菌株进行基因测序,与出发菌株相比进行基因组分析或关键酶基因分析等一系列后续实验。
4 结论本实验以耐辐射奇异球菌D. wulumuqiensis R12作为出发菌株,采用ARTP诱变育种,结合高通量筛选方法进行初筛和菌株类胡萝卜素含量复筛,得到了一株高产类胡萝卜素菌株M1。
研究D. wulumuqiensis R12和突变菌株M1的类胡萝卜素产量差异发现,相同细菌干重的突变菌株M1在发酵72 h后,类胡萝卜素含量比D. wulumuqiensis R12高,含量为612 μg/g DCW,而出发菌株只有212 μg/g DCW,是出发菌株的2.8倍,且突变菌株M1具有良好的遗传稳定性。
突变菌株M1的类胡萝卜素具有比D. wulumuqiensis R12更强的高铁离子还原能力和DPPH自由基清除能力,表明突变菌株M1具有比出发菌株更强的抗氧化能力。在相同γ射线和UV辐射剂量下,突变菌株的存活率均显著高于出发菌株,因此突变菌株具有比出发菌株更强的耐辐射能力。
| [1] | 许青. 类胡萝卜素吸收研究进展[J]. 国际病理科学与临床杂志, 1996, 16(4):249-251. |
| [2] | 李福枝, 刘飞, 曾晓希, 等. 天然类胡萝卜素的研究进展[J]. 食品工业科技, 2007, 28(9):227-232. |
| [3] | Wang Q, Luo W, Gu QY, et al. Enhanced lycopene content in Blake-slea trispora by effective mutation-screening method[J]. Applied Biochemistry and Biotechnology, 2013, 171(7):1692-1700. |
| [4] | Zhao J, Li QY, Sun T, et al. Engineering central metabolic modules of Escherichia coli for improving β-carotene production[J]. Meta-bolic Engineering, 2013, 17:42-50. |
| [5] | Ukibe K, Hashida K, Yoshida N, et al. Metabolic engineering of Saccharomyces cerevisiae for astaxanthin production and oxidative stress tolerance[J]. Applied and Environmental Microbiology, 2009, 75(22):7205-7211. |
| [6] | Xu X, Jiang L, Zhang ZD, et al. Genome sequence of a gamma- and UV-ray-resistant strain, Deinococcus wulumuqiensis R12[J]. Genome Announcements, 2013, 1(3). piie00206-e002-13. |
| [7] | Carbonneau MA, Melin AM, Perromat A, et al. The action of free radicals on Denococcus radiodurans carotenoids[J]. Achives of Biochemistry and Biophysics, 1989, 275(1):244-251. |
| [8] | Saito T, Ohyama Y, Ide H, et al. A carotenoid pigment of the radioresistant bacterium Deinococcus radiodurans[J]. Microbios, 1998, 95(381):79-90. |
| [9] | Lu Y, Wang LY, Ma K, et al. Characteristics of hydrogen production of an Enterobacter aerogenes mutant generated by a new atmospheric and room temperature plasma(ARTP)[J]. Biochemical Engineering Journal, 2011, 55(1):17-22. |
| [10] | Zong H, Zhan Y, Li X, et al. A new mutation breeding method for Streptomyces albulus by an atmospheric and room temperature plasma[J]. African Journal of Microbiology Research, 2012, 6(13):3154-3158. |
| [11] | 郑明英, 蔡友华, 陆最青, 等. 常压室温等离子体快速诱变筛选高脯氨酸产率突变株[J]. 食品与发酵工业, 2013, 39(1):36-40. |
| [12] | Wang W, Mao J, Zhang ZD, et al. Deinococcus wulumuqiensis sp. nov. , and Deinococcus xibeiensis sp. nov. , isolated from radiation-polluted soil[J]. International Journal of Systematic and Evolutionary Microbiology, 2010, 60(9):2006-2010. |
| [13] | Lemee L, Peuchant E, Clerc M. Deinoxanthin:a new carotenoid isolated from Deinococcus radiodurans[J]. Tetrahedron, 1997, 53(3):919-926. |
| [14] | 王飞, 封琼, 刘程智, 等. 奇球菌属类胡萝卜素提取物的抗氧化活性研究[J]. 核农学报, 2012, 26(6):900-905. |
| [15] | 封琼. Deinococcus radiopugnans类胡萝卜素的提取纯化、特性和生物活性的研究[D]. 杭州:浙江大学, 2013. |
| [16] | Benzie IFF, Strain JJ. The ferric reducing ability of plasma(FRAP)as a measure of “antioxidant power”:the FRAP assay[J]. Analytical Biochemistry, 1996, 239(1):70-76. |
| [17] | 陈君. 高抗氧化微生物筛选及其延缓小鼠衰老的研究[D]. 南昌:南昌大学, 2012. |
| [18] | 韩伟, 刘文群, 黄丽婵, 等. 5株微生物抗氧化作用的初步研究[J]. 食品与机械, 2008, 24(5):45-47. |
| [19] | Tian B, Xu ZJ, Sun ZT, et al. Evaluation of the antioxidant effects of carotenoids from Deinococcus radiodurans through targeted mutagenesis, chemiluminescence, and DNA damage analyses[J]. Biochimica et Biophysica Acta(BBA)- General Subjects, 2007, 1770(6):902-911. |
| [20] | 蔡友华, 李文锋, 卢伟宁, 等. 新型常压室温等离子体(ARTP)快速诱变高产苏氨酸的突变株[J]. 现代食品科技, 2013, 29(8):1888-1892. |
| [21] | 罗莉斯, 李能威, 李丽, 等. 96孔板高通量筛选多杀菌素高产菌株的研究[J]. 中国农业科技导报, 2010, 12(2):133-137. |
| [22] | 胡雅萍. 耐辐射奇球菌特种类胡萝卜素deinoxanthin药理学活性的初步研究[D]. 杭州:浙江大学, 2011. |