蝗虫(Locust)属于直翅目(Orthoptera)、蝗科(Locustidae)的昆虫,包括多个种(Species)。在历史上蝗灾给世界带来的生态平衡破坏与经济损失是极其惊人的,属于世界性的灾害;粮食作物一旦发生蝗灾,可使产量降低30%-70%,在1 d内就能吞食掉12万人1个月的口粮。在全球除南极洲、欧亚大陆北纬55°以北地区外均有蝗灾发生,常年发生面积达4 680 km2,全球有1/8的人口经常受到蝗虫的袭扰[1, 2]。近年来,全国不少地方开始人工养殖蝗虫用作高蛋白食物,并有逐渐形成产业的趋势,养殖品种主要是东亚飞蝗(Locusta migratoria manilensis),利用大棚温室养殖相对比较多见。随着蝗虫人工养殖生产的出现,成批的蝗虫发病死亡现象也时有发生。为探讨蝗虫发病死亡的原因,本研究对1起飞蝗虫病害进行病原学检验,对分离的病原菌株进行表观性状和分子生物学等鉴定,旨在对养殖东亚飞蝗感染病进行有效检验、预防与控制,为蝗灾进行生物防治提供候选菌株。
1 材料与方法 1.1 菌株来源2012年7月,河北某实验养殖场养殖的5龄东亚飞蝗发生大量的死亡;死亡蝗虫主要表现发病死亡急剧,虫体发红褐色和软化。在7月上旬的发病死亡高峰期时,取发病后刚刚死亡虫体,蒸馏水清洗75%酒精消毒,在无菌的条件下内,取其腔体内组织为材料,在生理盐水中捣碎,平铺接种于普通营养琼脂、血液(含7%家兔血液)营养琼脂培养基,置30℃培养24-48 h;对分离菌平板画线做纯培养并统一编号后,进行检验与分析。
1.2 分离菌株的表观分类学指征检验对分离保存的纯培养菌株,分别进行形态特征、培养特征、生理生化特性等这些表观分类学指征的系统检验。生理生化特性检验,采用法国BioméRieux细菌自动鉴定仪(ATB1525-expression),并对一些项目内容进行补充试验[3]。
1.3 分离菌株的16S rRNA基因序列测定与系统发育学分析选择经表观分类学指征检验后的代表菌株,进行16S rRNA基因序列测定与系统发育学分析。将供试菌株接种于LB肉汤培养基中,28℃(110 r/min)振荡培养16 h作为供试菌液,采用北京赛百盛基因技术有限公司生产的树脂型TM基因组DNA提取试剂盒,参照相应的方法提取细菌DNA作为PCR模板。
以对应于大肠埃希氏菌(Escherichia coli)16S rRNA基因第8-27个碱基位置的5'-AGAGTTTGATC(C/A)TGGCTCAG-3'为正向引物、对应于大肠埃希氏菌16S rRNA基因第1492-1510 个碱基位置的5'-TACGG(C/T)TACCTTGTTACGACTT-3'为反向引物(1492R),按常规方法对供试菌株进行16S rRNA基因序列的PCR扩增[4]。在50 μL反应体系中含有2×PCRmix缓冲液25 μL、引物各 1 μL、模板DNA 4 μL、无菌蒸馏水19 μL。PCR反应条件为95℃预变性3 min、接94℃变性1 min、55℃复性1 min、72℃延伸 2 min,经30个循环后72℃温育6 min。所扩增的PCR产物经纯化后,提交上海生工生物工程股份有限公司进行基因序列测定。
对所测定的基因序列,通过NCBI的BlAST检索系统进行序列同源性分析,使用DNASTAR软件与GenBank数据库存中获得的相似性较高的基因序列进行多序列匹配排列(Multiple alignment),采用邻接法(Neighbor joining method)构建分支系统树。
1.4 菌株分类位置确定根据细菌形态特征、理化特性等表观分类学指征的检验结果,主要参照第2版《Bergey’s Manual of Systematic Bacteriology》及有关资料,并结合16S rRNA基因序列与系统发育学的测定结果,对供试菌株进行分类学的归类判定[3, 5]。
1.5 人工感染试验选择经分类鉴定后的代表菌株,以其纯培养物分别移接普通营养肉汤培养基,经 30℃培养18 h作为供试菌液,分别对5龄健康的养殖东亚飞蝗进行人工感染实验并将试验重复3次。方法是取同批养殖东亚飞蝗,分组养殖于实验箱中;将供试菌液涂布或喷洒到鲜嫩玉米叶上,使蝗虫自然采食(相当于通过消化道途径接种感染)。接种后每天定时观察记录发病或死亡情况,以被感染发病、死亡,呈现出同自然病(死)蝗虫的发病特征、并能从死亡虫体重新分离回收到原感染菌作为致病作用的判定指标,同时设立仅接种无菌普通营养肉汤的实验对照。供试蝗虫在实验前统一养殖于实验箱中,养殖观察3 d且健康才可用于实验。
2 结果 2.1 菌株与编号取发病后刚刚死亡的养殖东亚飞蝗50只进行细菌分离,从其腔体内组织中,均分离到了多量细菌,且明显存在呈优势生长的同种细菌。从不同虫体的分离菌,各取1个呈优势生长的同种细菌的菌落移接于普通营养琼脂斜面培养基,置30℃培养24 h作为纯培养菌共10株,于4℃普通冰箱保藏供实验用。菌株编号系按分离地与日期,依次为HC120710-1至HC120710-10。
2.2 形态与培养特征 2.2.1 形态特征取保藏的10株纯培养菌,分别移接于普通营养琼脂斜面培养基,置30℃培养24 h后做涂片标本进行革兰氏染色检查,均为革兰氏染色阴性、两端钝圆、散在(个别成双)、无芽孢的杆菌。做负染色的透射电子显微镜标本观察(图 1),菌体杆状、表面光滑但不平整、有微泡(Micorovesicale)、周生鞭毛及菌毛。
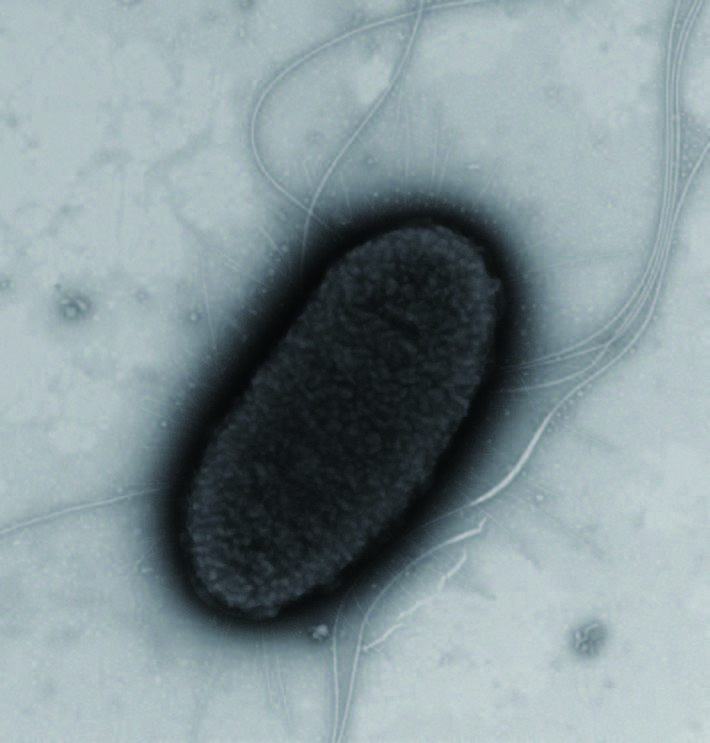
|
| 图 1 褪色沙雷氏菌透射电子显微镜照片(×8 000) |
取保藏的10株纯培养菌分别移接于普通营养琼脂、血液(含7%家兔血液)营养琼脂、沙门氏菌-志贺氏菌琼脂(Salmon-ella-Shigella agar,SS agar)培养基,置30℃培养24-48 h培养后检查生长情况及菌落特征。结果在普通营养琼脂、血液(含7%家兔血液)营养琼脂培养基上,与用这两种培养基从病死东亚飞蝗虫体所分离的一致,表现为在普通营养琼脂培养基上,培养24 h检查菌落呈圆型光滑、边缘整齐、较隆起、酱红色、不透明、直径多在1.5 mm(培养48 h的多在2.0-2.5 mm),生长丰盛;在血液(含7%家兔血液)营养琼脂培养基上,生长情况、菌落特征与在普通营养琼脂上的基本相同,β-溶血;在SS琼脂培养基上,生长情况、菌落特征与在普通营养琼脂上的基本相同,呈浅玫瑰红色。
2.2.3 适宜生长的温度取保藏的10株纯培养菌,分别移接于普通营养琼脂斜面培养基,置37℃培养24-48 h检查,表现与在30℃培养的生长情况相同,但不能明显产生红色色素。
2.3 理化特性供试10株纯培养菌,对所测项目的结果表现一致。主要为:氧化酶、酯酶、精氨酸双水解酶、L-天冬氨酸芳胺酶、尿素酶等阴性,过氧化氢酶、β-葡萄糖苷酶、β-半乳糖苷酶、鸟氨酸脱羧酶、赖氨酸脱羧酶等阳性;吲哚阴性,V-P阳性,利用柠檬酸盐,不利用丙二酸盐。分解葡萄糖、阿拉伯醇、海藻糖、麦芽糖、蔗糖、侧金盏花醇、肌醇、山梨醇等,不分解纤维二糖、棉籽糖、甘露醇、鼠李糖、阿拉伯糖等。
2.4 16S rRNA基因序列与系统发育选择经表观分类学指征检验后的HC120710-1作为代表菌株,进行的16S rRNA基因序列测定与系统发育学分析,结果得到了长度为1 428 bp的基因序列。将此菌株的16S rRNA序列在NCBI上进行同源性检索,发现其与沙雷氏菌属细菌的16S rRNA基因序列自然聚类;在检索出的沙雷氏菌属细菌序列中,此菌株与它们的同源性都在99%-98%。选取17株沙雷氏菌属细菌的16S rRNA基因序列进行系统发育学分析(图 2),此菌株与编号为JQ308604的褪色沙雷氏菌聚为一个分支。

|
| 图 2 褪色沙雷氏菌16S rRNA基因序列系统发生树 |
根据对10株供试菌表观分类学指征的检验、结合16S rRNA基因序列与系统发育学分析结果,综合分析判定为沙雷氏菌属的褪色沙雷氏菌[3, 4, 5, 6, 7]。参考菌株:HC120710-1。
2.6 致病作用将同批5龄健康的养殖东亚飞蝗,分为每组约100只的两组隔离养殖于两个实验箱中;其中的1组接种供试菌株HC120710-1的菌液为感染实验组,另外1组接种普通营养肉汤为实验对照组,接种时间为2013年7月8日(7-8),接种后分别养殖观察至7月13日共6 d(144 h),每天观察发病与统计死亡情况。结果为实验组的95只共死亡73只(死亡率76.84%),对照组的96只共死亡31只(死亡率32.29%),死亡时间及数量,见表 1。
接种感染试验组的蝗虫,多数具有行动迟缓(不活跃),少食甚至停食,有的还出现轻微的痉挛现象等发病表现;病死蝗虫多数表现为虫体逐渐变软、变黑褐色,与自然发病死亡的表现基本一致。对照组中死亡的蝗虫,一般缺乏明显的发病特征。随机择感染试验组及对照组死亡的蝗虫各5只,分别取其腔体内组织为材料,接种于普通营养琼脂、血液(含7%家兔血液)营养琼脂培养基,置30℃培养24-48 h;结果从感染试验组的5只中均分离出了呈优势生长的原感染用褪色沙雷氏菌,对照组的5只均未检出。对照组后期死亡数增加,有可能是饲养条件不适引起的死亡。
3 讨论对从发生死亡的养殖东亚飞蝗虫体分离的10株细菌,经比较系统的检验表明为褪色沙雷氏菌;人工感染养殖的五龄健康东亚飞蝗的实验结果,显示具有一定的致病作用。这些结果,可以为对褪色沙雷氏菌的有效检验提供有价值的参考。
肠杆菌科[Enterobacteriaceae(Rahn 1937)Ew-ing Farmer and Brenner 1980],首先由德裔-美国微生物学家奥托·拉恩(Otto Rahn)于1937年所建立。追溯历史,褪色沙雷菌是最早发现和研究的肠杆菌科细菌成员。早在公元前322年,就已有在食物中自然出现“血”的记载;19世纪初,在欧洲认为这种“血”的现象,是发酵的终产物或是由在当时定名为“Zaogalactina imetropha”的真菌(fungi)所致。1819年,在意大利东北部港市威尼斯的药剂师巴尔托洛梅奥·比兹奥(Bartolomeo Bizio),通过对这种生长在意大利大麦粥上“血粥”的检验,发现了能够产生这种红色物质的细菌,并于1823年将其命名为“Serratia marcescens”(褪色沙雷氏菌),但没有发现该菌具有病原学意义。属名“Serratia”(沙雷氏菌属),是以意大利物理学家拉塞菲诺·沙雷(Serafino Serrati)的姓氏命名的[7]。
在褪色沙雷氏菌的致病作用方面,已有的报告显示在人的医院感染中具有一定的病原学意义;另外是Garcia等[12]曾报告该菌在1名儿童所引发的腿部溃疡和皮肤肉芽肿病例,Langrock等[8, 9, 10, 11, 12, 13]报告了该菌在1名73岁患者所引发的腿部溃疡和脓肿病例,但这些都是罕见的。对动物的致病,有记述该菌是与母牛的乳腺炎和脓毒性流产有关的;Plavec等[14]曾报告该菌引发了1例犬的坏死性筋膜炎,Nam等[15]报告在朝鲜的牛乳腺炎病原菌中包括该菌。对昆虫类动物的致病性,有记述该菌能引起家蚕的细菌性败血症;程瑞春等[16]报告,通过对利用柞蚕繁蜂时蛹内组织液化后呈粉红色这一未知软化病的典型症状进行病原细菌的研究,表明其病原菌为褪色沙雷菌。本次通过人工感染实验及对感染死亡虫体进行的感染菌复核检验,初步表明了褪色沙雷菌在养殖东亚飞蝗的原发病原学意义,其感染发病死亡的高峰期在接种后的24-72 h这与细菌感染的致病作用特征也是比较符合的;至于在实验观察期内对照组东亚飞蝗的死亡,最可能的原因是与养殖环境的改变相关联的,但也不能排除在实验组中也有因这种情况出现的死亡。
从另外一个角度来看,目前国内外对蝗灾的生物学防治研究与实验应用,主要包括绿僵菌(Metarhazium spp.)、蝗虫微孢子虫(Nosema locustae)等,尚存在难于克服的时效性、产业化及实际效果等方面问题[17, 18, 19, 20];在细菌方面,已先后有对产碱假单胞菌(Pseudomonas alcaligenes)、类产碱假单胞菌(Pseudomonas pseudoalcaligenes)、产碱杆菌(Alcaligenes sp.)、苏云金芽孢杆菌(Bacillus thuringiensis)、蜡样芽孢杆菌(Bacillus cereus)等的研究,认为在对蝗虫的生物防治领域具有潜在的应用前景,但还均未进入实际应用阶段[21, 22, 23, 24, 25, 26, 27]。综合分析,褪色沙雷氏菌对人、养殖及野生动物并不具有发生流行病的病原学意义;如果从发病死亡养殖东亚飞蝗分离获得的这种褪色沙雷氏菌,进一步研究确定在蝗虫的致病作用与强度,则不排除可能成为对蝗灾进行生物学防治研究的直接或构建基因工程菌的候选菌株。
4 结论从病死蝗虫中分离纯化的细菌10株,通过回归感染实验验证其病原性,利用表观学特征观察、生理生化特性鉴定及16S rRNA系统学发育分析鉴定是肠杆菌科沙雷氏菌属中褪色沙雷氏菌。
| [1] | 王俊梅. 生物技术对草原蝗虫的控制效果及应用前景[J]. 草业科学, 2009, 26(9):20-211. |
| [2] | 王生财, 刁治民, 吴保锋. 蝗虫生物防治技术概况与蝗虫微孢子虫的应用[J]. 青海草业, 2004, 13(3):29-32. |
| [3] | 杨正时, 房海.人及动物病原细菌学[M].石家庄:河北科学技术出版社, 2003, 1523-1643. |
| [4] | Martin F, Pol Z, Cavanaugh CM. Bias in template to product ratios in multitemplate PCR[J]. Appl Environ Microbiol, 1998, 64(10):3724-3730. |
| [5] | Garrity GM. Bergey’s Manual of Systematic Bacteriology[M]. Second Edition. Volume Two. Part B. Springer, New York, 2005:799-811. |
| [6] | Hoit JG, Krieg NR, Sneath PHA, et al. Bergey s Manuai of Determinative Bacterioiogy[M]. 9th Edition. Baitimore, Wiiiiams and Wiikins, 1994, 243-247. |
| [7] | 房海, 陈翠珍, 张晓君.肠杆菌科病原细菌[M].北京:中国农业科学技术出版社, 2011:345-364. |
| [8] | 张正, 赵素蕊, 王贺, 等. 70例沙雷菌感染鉴定及药敏分析[J]. 中华医学检验杂志, 1994, 17(6):359-361. |
| [9] | 褚云卓, 年华, 欧阳金鸣. 沙雷菌属在医院的分布及药敏结果分析[J]. 中华医院感染学杂志, 2008, 18(2):276-277, 245. |
| [10] | 来汉江, 杨莉俊, 顾保罗, 等. 居泉沙雷菌与褪色沙雷菌分布及耐药性对比分析[J]. 中华医院感染学杂志, 2010, 20(7):1020-1022. |
| [11] | Su JR, Blossom DB, Chung W, et al. Epidemiologic investigation of a 2007 outbreak of Serratia marcescens bloodstream infection in Texas caused by contamination of syringes prefilled with heparin and saline[J]. Infection Control and Hospital Epidemiology, 2009, 30(6):593-595. |
| [12] | Garcia FR, Paz RC, Gonzalez RS, et al. Cutaneous infection caused by Serratia marcescens in a child[J]. Journal of the American Academy of Dermatology, 2006, 55(2):357-358. |
| [13] | Langrock ML, Linde HJ, Landthaler M, et al. Leg ulcers and abscesses caused by Serratia marcescens[J]. European Journal of Dermatology, 2008, 18(6):705-707. |
| [14] | Plavec T, Zdovc I, Juntes P, et al. Necrotizing fasciitis caused by Serratia marcescens after tooth extraction in a Doberman Pinscher:a case report[J]. Veterinarni Medicina, 2008, 53(11):629-635. |
| [15] | Nam HM, Lim SK, Kang HM, et al. Prevalence and antimicrobial susceptibility of gram-negative bacteria isolated from bovine mastitis between 2003 and 2008 in Korea[J]. Journal of Dairy Science, 2009, 92(5):2020-2026. |
| [16] | 程瑞春, 崔建国, 王洪魁, 等. 柞蚕蛹期灵菌败血病Serratia marcescens C3菌株分离鉴定[J]. 微生物学通报, 2010, 37(6):829-833. |
| [17] | 王俊梅. 生物技术对草原蝗虫的控制效果及应用前景[J]. 草业科学, 2009, 26(9):206-211. |
| [18] | 张龙. 国内外蝗害治理技术现状与展望[J]. 应用昆虫学报, 2011, 48(4):804-810. |
| [19] | Price RE, Bateman RP, Brown HD, et al. Aerial spray trials against brown locust(Locustana pardalina Walker)nymphs in South Africa using oil miscible formulations Metarhizium flacociride[J]. Crop Protection, 1997, 16(4):345-351. |
| [20] | Hunter DM, Milner RJ, Spurgin PA. Aerial treatment of the Australian plague, Chortoicetes terinifera(Orthoptera:Acrididae)with Metarhizium aniscpliae(Deuteromycotina:Hyphomycetes)[J]. Bull Entomology Research, 2001, 91(2):93-99. |
| [21] | 葛绍荣, 刘世贵, 何小仪, 等. Pm-1蝗虫病原菌的鉴定[J]. 生物学杂志, 1994(4):20-21, 13. |
| [22] | 刘世贵, 朱文, 杨志荣, 等. 一株蝗虫病原菌的分离和鉴定[J]. 微生物学报, 1995, 35(2):86-90. |
| [23] | 杨志荣, 朱文, 葛绍荣, 等. 类产碱假单胞菌防治草地蝗虫的研究[J]. 中国生物防治, 1996, 12(2):55-57. |
| [24] | 丁秀琼, 陶科, 刘世贵. 一株蝗虫病原菌的分类鉴定及其毒力测定[J]. 农药, 2007, 46(7):496-499. |
| [25] | 朱文, 杨志荣, 葛绍荣, 等. 苏云金杆菌防治草地蝗虫的研究[J]. 西南农业学报, 1995, 8(2):61-64. |
| [26] | 金虹, 葛绍荣, 陶勇, 等. 一株蝗虫病原菌的鉴定及其毒力和病理研究[J]. 微生物学报, 2005, 45(2):172-176. |
| [27] | 陈瑞屏, 刘清浪. 应用蜡状芽孢杆菌防治棉蝗的初步研究[J]. 广东林业科技, 1995, 11(3):50-52. |





